儿童颅骨嗜酸性肉芽肿的影像学表现及分型探讨
2014-08-28,,,
,, ,
(1.重庆市南川区人民医院放射科,重庆 408400;2.重庆市沙坪坝区中医院放射科,重庆 400000;3.重庆医科大学附属儿童医院:a.放射科;b.脑外科,重庆 400012)
颅骨嗜酸性肉芽肿(skull eosinophilic granuloma,SEG)是朗格汉斯细胞组织细胞增生症(langerhans cell histiocytosis,LCH)发生于颅骨的一种溶骨性病变,以儿童及青少年多见[1-3]。既往有关SEG的报道主要集中于单纯影像学征象研究[4-8]。近年来我们发现,不同影像学表现的SEG其临床表现、治疗方式以及预后也不同。本文通过对2006年1月至2012年1月32例经手术病理证实的SEG临床及影像学资料的分析,探讨SEG的影像学分型及其临床意义。
1 资料与方法
1.1 临床资料
本组患者32例,其中男23例,女9例;年龄1岁2个月至10岁9个月;病程从最短25 d到最长11.6个月不等。29例(93.7%)为单发病灶,其中额骨7例,顶骨15例,颞骨3例,枕骨4例;3例(6.3%)为颅骨多发病灶,均合并其他骨及系统病变,临床表现均有头皮下包块,同时伴有头痛4例、呕吐1例、肢体运动障碍2例、感觉麻木3例;包块不明显者3例,明显者28例,多发3例;包块边界一般清楚,质地韧,具有囊性感3例,同时伴有压痛17例(89.5%)。手术治疗中单纯肉芽肿及侵蚀颅骨切除8例,同时行颅骨修补(颅骨缺损大于3 cm)19例,硬脑膜修补5例,病灶切除后化疗3例。对可联系到的23例进行了随访6个月至6年,其中21例局灶性颅骨破坏均无复发,2例复发均为多发颅骨破坏型。
1.2 方法
所有病例行64排螺旋CT扫描,扫描参数:管电压120 kV、电流180 mA、层厚1.25 mm、层距1.0 mm、螺距比1.375∶1。扫描参数完成后内插为层厚0.625 mm、层距1.0 mm的重建参数,并对有条件病例行三维重建。9例患儿采用1.5 T MR扫描,标准正交头线圈,扫描序列包括矢状位和轴位的快速自旋回波T1WI(TR:400~450 ms,TE:8~12 ms)和T2WI(TR:3 500~5 000 ms,TE:90~120 ms),层厚2~4 mm,间距0.5~1 mm,矩阵256×256,视野(FOV)24~36 cm、激励次数2~4次。对于5岁以下及不配合患儿按0.3~0.5 mL/kg剂量给予10%水合氯醛口服镇静。根据影像学肉芽肿大小、形态、颅骨破坏程度及范围,将SEG分为肿块不明显型、肿块外凸型、肿块双凸型及肿块多发型,分析各型SEG的影像学表现、临床特征、手术方式和效果。
2 结果
2.1 影像学表现
2.1.1 肿块不明显型 X线及CT表现为颅骨局限性的小范围不全性骨质破坏,以板障及外板破坏为主,边缘不光整,无硬化,内板可有少许破坏,但仍大致连续。破坏区肉芽肿形成不明显,多呈轻微凸起、较均匀的稍高密度软组织影(图1)。
2.1.2 肿块外凸型 X线及CT表现为典型的颅骨“穿凿样”骨质破坏,内外板完全破坏后不平衡导致“斜边征”11例,外板破坏范围大于内板多见,破坏区边缘清晰、不光整,无硬化环(图2a),部分可见死骨残留。破坏区肉芽肿明显向外凸起呈丘状或新月形,外缘为白线样颅骨外膜,内侧以颅骨缺损区为基底,肿块密度不均,其内部分可见较低密度的脂质成分(图2b),偶可见部分囊变。颅骨破坏直径大于3 cm者需作颅骨修补(图2c)。MRI:肿块信号不均,主要以T1稍低T2稍高信号为主,其内可见条絮样或斑点状短T1长T2信号影。
2.1.3 肿块双凸型 骨质破坏与肿块外凸型相仿。破坏区肉芽肿块呈“双凸”形,内缘呈弧形向颅内蔓延并压迫硬脑膜(CT和MRI分别表现为线状高密度影和低信号影),线状影模糊或消失提示硬脑膜受累,相邻脑实质有不同程度受压(图3)。4例双凸形肿块沿颅板向周围延伸,包绕相邻的颅骨破坏端,形成明显“袖套征”(图3a、d)。肿块密度与肿块外凸型大致相似。此外,该型颅骨破坏范围多为内板大于外板,与肿块外凸型相反。
2.1.4 肿块多发型 颅骨多发、程度和范围不一的骨质破坏,呈“地图颅”样外观。3例均发生于多系统LCH患者,累及眼眶2例。1例主要为多发颅骨骨质破坏(图4a),另外2例同时还伴有明显的大小不等的软组织肿块形成(图4b)。
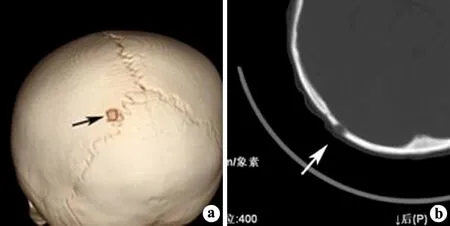
a:CT容积重建示颅骨小范围的不全性颅骨破坏;b:CT图示颅骨局灶性的骨质破坏,以板障及外板破坏为主,边缘不光整,肉芽肿形成不明显,呈“小丘状”凸起,密度呈均匀的稍高密度影
图1肿块不明显型影像表现

a:X线表现为典型颅骨穿凿样骨质破坏,边缘不光整;b:CT多平面重建图示颅板完全破坏,外板破坏范围大于内板;肉芽肿明显形成向外丘状凸起,密度不均,其内可见脂质所致的稍低或轻度负值的密度(小箭头);c:完全清除病灶后行缺损颅骨钛网塑形修补
图2肿块外凸型影像表现及颅骨修补术后情况
2.2 影像学分型与临床关系
SEG各影像学分型与病程、临床表现、手术治疗方式及随访效果均存在明显的对应关系及特殊性,具体为:①肿块不明显型(3例,9.4%)病程约21~58 d,临床表现主要为偶然发现,包块不明显,无压痛,行肉芽肿切除手术,随访3例,均无复发;②肿块外凸型(21例,65.6%)病程约3.5~10.2个月,临床表现主要为包块外凸明显,可进行性增大,常伴压痛,大者有囊性感,行肉芽肿切除、颅骨修补(>3 cm)手术,随访15例,均无复发;③肿块双凸型(5例,15.6%)病程约6.8~11.6个月,临床表现主要为包块清楚,质地韧,颅压增高(头痛、呕吐)及脑实质受压表现(运动障碍、麻木)常见,行肉芽肿切除、颅骨修补(>3 cm)、硬脑膜修补手术,随访3例,均无复发;④肿块多发型(3例,9.4%)病程约4.8~5.6个月,临床表现主要为头颅多发包块,眼眶受累常见,伴多器官系统受累,行肉芽肿大病灶切除手术加化疗,随访2例,均有复发。

a、b:CT显示肉芽肿块呈“双凸”形,肉芽肿块突破内板,内缘压迫“白线样”表现的硬膜囊及邻近相应脑实质,外缘压迫白线样表现的颅骨外膜影,肿块沿颅板向周围延伸,包绕相邻的颅骨破坏端,形成明显“袖套征”;c、d:MR T1WI及T2WI显示肿块信号不均,主要以T1稍低T2稍高信号为主,其内可见条絮样或斑点状短T1长T2信号影,“袖套征”典型
图3肿块双凸型影像表现

a:CT显示颅骨多发的、程度不一骨质破坏;b:CT显示相应部位伴有大小不等的软组织肿块形成
图4肿块多发型影像表现
3 讨论
LCH曾有很多名称,如嗜酸性肉芽肿、韩-薛-柯病、勒-雪病,1953年Liechtenstein发现这些疾病有共同的组织细胞成分而将此类疾病统称为“组织细胞增生症X”[1,3-5]。1987年国际组织细胞学会将其统一命名为LCH。LCH可以发生于任何器官,以网状内皮系统最常见。在骨骼系统中,LCH以累及扁骨最多见,其中又以颅骨更为常见。本组颅骨LCH统计显示顶骨和额骨最容易受累,颅盖骨比颅底骨常见,与文献报道一致[7-9]。
对于SEG的影像学研究,既往已有部分报道,主要围绕“颅骨破坏”和“肉芽肿形成”这两大基本病理改变所导致的影像学征象进行研究,如颅骨破坏造成的“地图颅征”、“斜边征”、“纽扣样死骨征”,以及肿块形成的“袖套征”等[6-8,10]。这些征象对SEG的诊断和鉴别诊断有一定的价值,但对于临床医生而言,单纯依靠这些影像学征象难以对病情的严重程度做出一个准确的判断,从而不能很好地指导临床治疗方案的制定。SEG的影像学表现多种多样,不同影像学表现的SEG其临床表现、治疗方案和效果也不尽相同[4-5,11-13],鉴于此,我们根据SEG肉芽肿大小、形态、颅骨破坏程度及累及范围等,提出了SEG影像学分型,通过影像与临床之间的对照研究,发现各型SEG的影像和临床表现均有一定特征性,而且不同分型的SEG其手术治疗方式和治疗效果也有所区别,说明该分型对SEG临床病情的判断、治疗方案的选择以及预后评估等具有一定的意义。
在SEG的分型中,相对于前三型的局限性骨质破坏,Ⅳ型主要特点为多发的颅骨破坏和大小不等肉芽肿块形成,临床常有多系统器官受累表现,手术不可能切除所有病灶,一般采用较大病灶手术切除辅以全身化疗,术后易复发,预后较差。在前三型中,相对于后两型完全的颅骨破坏和肉芽肿块的明显形成,Ⅰ型以不全性的颅骨破坏和不明显的肉芽肿块形成为主要特点,该型病灶临床表现不明显,多为偶然发现,由于病灶小,手术相对简单,时间短,术后恢复快且不易复发,预后最好。而在Ⅱ型和Ⅲ型中,完全性的颅骨破坏是其主要共同特点,但二者也有一定区别:首先,Ⅱ型包块形成较后者明显,较大者有囊性触感,常伴有压痛,Ⅲ型除包块外还会出现因病变突破内板累及硬脑膜并压迫脑实质引起头痛、呕吐的高颅压表现以及功能区脑组织受压导致的肢体运动障碍及感觉麻木等临床表现。其次,在治疗方面,二者均需对肉芽肿及其侵蚀的颅骨进行切除,并对颅骨缺损直径大于3 cm者进行塑型钛网修补,除此之外,Ⅲ型还需同时对出现受侵的硬脑膜进行切除与修补,手术相对复杂,手术时间及术后恢复时间也较长,二者预后效果都较好,均不易复发。综上所述,SEG各型不论从影像学表现、临床症状,还是从治疗方式以及预后效果方面都具有一定的特征性,客观上存在了影像学分类基础与依据,利用该分型可以对SEG进行全面的影像学评估,从而帮助临床医生制定正确的治疗方案,同时对病情的预后判断也有一定的价值。
[参考文献]
[1] Park SH,Park J,Hwang JH,et al.Eosinophilic granuloma of the skull:a retrospective analysis[J].Pediatr Neurosurg,2007,43(2):97-101.
[2] Wang J,Wu X,Xi ZJ,et al.Langerhans cell histiocytosis of bone in children:a clinicopathologic study of 108 cases[J]. World J Pediatr,2010,6(3):255-259.
[3] Hoover KB,Rosenthal DI,Mankin H.Langerhans cell histiocytosis[J]. Skeletal Radiol,2007,36(2):95-104.
[4] Kilborn TN,Teh J,Goodman TR,et al. Paediatric manifestations of Langerhans cell histiocytosis:a review of the clinical and radiological findings[J]. Clin Radiol,2003,58(4):269-278.
[5] Alexiou GA,Mpairamidis E,Sfakianos G,et al.Cranial unifocal Langerhans cell histiocytosis in children[J]. J Pediatr Surg,2009,44(3):571-574.
[6] 傅筱敏,韩本谊.颅骨嗜酸性肉芽肿的CT和MRI诊断[J].临床放射学杂志,2007,26(3):248-250.
[7] Berhouma M,Krichen W,Chamseddine A,et al.Surgical management of solitary eosinophilic granuloma of the calvaria. Two case reports [J].Neurochirurgie,2009,55(6):555-559.
[8] 王龙胜,郑穗生,江安红,等.骨嗜酸性肉芽肿的影像诊断[J].中国介入影像与治疗学杂志,2012,9(4):270-273.
[9] Takeuchi S,Takasato Y,Masaoka H,et al.Operative case of eosinophilic granuloma of the skull with dural invasion[J].No Shinkei Geka,2008,36(3):239-243.
[10] 杨永胜,余 晖,龙从杰.套袖征:骨嗜酸性肉芽肿的MRI表现[J]. 西南国防医药,2011,21(11):1205-1207.
[11] Binning MJ,Brockmeyer DL.Novel multidisciplinary approach for treatment of langerhans cell histiocytosis of the skull base[J].Skull Base,2008,18(1):53-58.
[12] Marback EF,Guimarães RD,Nader M,et al.Orbital eosinophilic granuloma[J].Arq Bras Oftalmol,2008,71(3):405-409.
[13] Kaul R,Gupta N,Gupta S,et al.Eosinophilic granuloma of skull bone[J].J Cytol,2009,26(4):156-157.
