乌司他丁联合ghrelin对内毒素血症大鼠肠功能障碍的影响
2014-08-28显凯
, ,显凯
(1.第三军医大学大坪医院野战外科研究所创伤科,重庆 400042;2.重庆医科大学附属永川医院急诊科,重庆 402160)
脓毒症(sepsis)指由感染引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),可发展成为多器官功能不全(multiple organ dysfun-ction syndrome,MODS)。在ICU感染患者中,有严重脓毒症或脓毒症休克占30.8%,并且病死率可达38.96%[1]。肠道不仅是脓毒症时脏器损害的重要靶器官,肠道功能障碍更是脓毒症的“始动因素”,也是由脓毒症发展至MODS的重要因素之一[2]。因此,在脓毒症救治过程中,如何保护肠道功能对改善脓毒症预后具有重要意义。乌司他丁(UTI)是一种蛋白酶抑制剂,能同时抑制多种水解酶活性。已发现UTI可以抑制炎症介质的过度释放[3],改善微循环和组织灌注,临床已开始用于脓毒症的治疗。Ghrelin(GHL)是生长激素促分泌素受体(growth hormone secretagogue receptor,GHSR)的内源性配体,具有抗炎作用,能改善脓毒症时肠运动功能[4],显示了其针对脓毒症的潜在应用价值。虽然已有的文献认为,UTI、GHL均可改善脓毒症时脏器功能障碍,减轻炎症反应,但特异针对脓毒症时肠功能障碍的相关研究较少,且相应机制也不甚明了。鉴于肠道在脓毒症发生发展中的重要作用,本实验以内毒素血症为脓毒症模型,观察了UTI、ghrelin对内毒素血症大鼠小肠屏障功能、运动功能及全身和肠道局部炎症反应的影响,以期为脓毒症时肠功能障碍的治疗提供理论及实验依据。
1 材料与方法
1.1 实验动物
健康SPF级SD大鼠60只,雄性,体质量为220~240 g,由第三军医大学大坪医院野战外科研究所实验动物中心提供,动物实验前禁食8 h,禁水4 h。
1.2 主要试剂及仪器
内毒素粉剂(LPS)、ghrelin、小肠葡聚糖蓝-2000(BD-2000);注射用乌司他丁(规格:每支10万U,国药准字H19990134);大鼠肿瘤细胞坏死因子(TNF-α)、大鼠白介素6(IL-6)、大鼠高迁移率族蛋白1(HMGB1)ELISA试剂盒;RNA提取试剂Trizol Reagent;逆转录试剂盒;PCR试剂盒;BCA试剂盒;肠黏膜防御素-5(RD-5)、肠三叶因子家族-3(TFF-3)、β-actin引物由上海百力格生物技术有限公司合成;光学显微镜、PCR仪、分光光度计、酶标仪。
1.3 实验分组及脓毒症模型的建立
将60只大鼠采用随机数字法随机分为5组(n=12),分别为对照组(CON组)、内毒素组(LPS组)、乌司他丁组(UTI组)、ghrelin组(GHL组)、UTI+ghrelin组(UTI+GHL组)。大鼠以3%的戊巴比妥钠(35 mg/kg)腹腔注射麻醉。各实验组麻醉后,以LPS 15 mg/kg腹腔注射构建内毒素血症模型,CON组以等量生理盐水代替内毒素腹腔注射。在LPS注射后10 min,UTI组以UTI 15×104U/kg腹腔注射[5],GHL组给予ghrelin 25 μg/kg腹腔注射[6],UTI+GHL组给予UTI 15×104U/kg+ghrelin 25 μg/kg腹腔注射,CON、LPS组给予同等剂量生理盐水。各组12 h后再次给药。每个实验组于术后12 h和24 h分别处死6只大鼠并留取标本。
1.4 小肠黏膜屏障功能的测定
1.4.1 观察黏膜组织病理变化 剪取回肠2 cm,置于4%的甲醛水溶液中固定48 h,石蜡包埋,连续切片(厚度小于5 μm),HE染色,光镜下观察组织病理学改变。
1.4.2 实时荧光定量PCR检测RD-5和TFF3的mRNA表达水平 Trizol法提取回肠样本中总RNA,鉴定后以1 μl RNA为模板,用PrimeScriptTM RT reagent Kit with gDNA Eraser将其逆转录成cDNA。按照SYBR®Premix Ex TaqTMⅡ操作说明进行荧光定量PCR。反应体系20 μl,扩增条件:94 °C 30 s,94 °C 30 s,55 °C变性1 min,70 °C退火30 s,共40个循环。引物:RD-5,上游为GAAGACACTTGTCCTCCTTTCTG,下游为TGTTGCAGATCCCCATAATGCCT;TFF-3,上游为GATAACCCTGCTGCTGGTCCTG,下游为GGGCACATTTGGGATGCTGGAG;β-actin,上游为AGACAGCCGCATCTTCTTGT,下游为CTTGCCGTGGGTAGAGTCAT。以β-actin为参照,采用Quantity One图像分析软件计算mRNA的相对表达量。
1.5 小肠运动功能测定
随机选取各实验组6只大鼠,于造模后4 h用浓度为1%BD-2000(5 mL/kg)给实验组大鼠灌胃,并在造模后12 h处死动物,取全肠以5 g天平砝码垂挂测量其长度,再测量BD-2000染色长度,计算动物小肠传输百分率(小肠传输百分率=小肠染色长度/小肠总长度×100%)。
1.6 血清炎症因子表达水平测定
处死各组大鼠时经腹主动脉取血,静置30 min后,3 000 r/min离心5 min取血清,-80 ℃保存。根据ELISA试剂盒说明书要求操作,检测血清TNF-α、IL-6、HMGB1水平。
1.7 肠黏膜炎症因子表达水平测定
处死各组大鼠时取肠黏膜,与组织裂解液混合充分研磨,静置30 min后,12 000 r/min离心10 min取上清,用BCA法测蛋白浓度后,用组织裂解液配成50 μg/μl,-80 ℃保存。根据ELISA试剂盒说明书要求操作,检测血清TNF-α、IL-6、HMGB1。
1.8 统计学方法
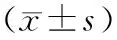
2 结果
2.1 小肠黏膜屏障功能变化
2.1.1 光镜下大鼠小肠组织病理学改变 12 h时观察:CON组小肠各层结构清晰,黏膜表层完整,腺体排列整齐;LPS组小肠绒毛顶端上皮下毛细血管充血及脱落,中央乳糜管扩张,固有层裸露、崩解,毛细血管出血;UTI组小肠出现小部分绒毛顶端上皮脱落,中央乳糜管小幅度扩张;GHL组小肠绒毛顶端上皮下毛细血管充血及脱落,中央乳糜管扩张;UTI+GHL组小肠出现少量绒毛顶端上皮脱落,中央乳糜管小幅度扩张(图1)。24 h时镜下观察小肠组织病理学改变与12 h时结果类似。
2.1.2 肠黏膜RD-5及TFF3的mRNA表达水平变化 12 h时LPS组RD-5及TFF3的mRNA表达水平较对照组显著下降(P<0.01),而UTI组和UTI+GHL组RD-5及TFF3的mRNA表达水平较LPS组明显升高(P<0.01),且UTI+GHL组提高效果优于UTI组(P<0.05),而GHL组对RD-5及TFF3的mRNA表达水平无明显影响(P>0.05)。24 h检测各组数据与12 h时结果相似(图2)。

a:CON组;b:LPS组;c:UTI组;d:GHL组;e:UTI+GHL组
*:与LPS组比较,P<0.05;△:与LPS组比较,P<0.01;#:与UTI+GHL组比较,P<0.05;▲:与UTI+GHL组比较,P<0.01
图2各实验组大鼠回肠黏膜不同时间点RD-5及TFF3的mRNA的表达
2.2 小肠BD-2000推进率
12 h时间点检测各组小肠BD-2000推进率,LPS组较对照组小肠运动功能减弱明显,而GHL组以及UTI+GHL组能够改善脓毒症大鼠小肠运动功能(P<0.05),并且UTI+GHL组效果较GHL组更为显著(P<0.05),但UTI组无明显改善作用(图3)。
2.3 血清炎症介质水平变化
12 h、24 h时间点LPS组血清TNF-α、IL-6、HMGB1水平显著高于对照组及其余各组(P<0.01),UTI+GHL组、UTI组以及GHL组较LPS组各时间点TNF-α、IL-6、HMGB1水平显著降低(P<0.05),见图4。
2.4 回肠黏膜炎症介质水平变化
12 h、24 h时间点LPS组回肠黏膜组织中TNF-α、IL-6、HMGB1水平显著高于对照组及其余各组(P<0.05),UTI+GHL组、UTI组及GHL组TNF-α、IL-6、HMGB1水平显著低于LPS组(P<0.05),与血清中检测结果基本一致(图5)。

*:与LPS组比较,P<0.01;#:与UTI+GHL组比较,P<0.05;△:与UTI+GHL组比较,P<0.01
图3各实验组大鼠小肠BD-2000推进率
*:与LPS组比较,P<0.05;△:与LPS组比较,P<0.01;#:与UTI+GHL组比较,P<0.05;▲:与UTI+GHL组比较,P<0.01
图4各组大鼠不同时间点血清TNF-α、IL-6、HMGB1水平

*:与LPS组比较,P<0.05;△:与LPS组比较,P<0.01;#:与UTI+GHL组比较,P<0.05;▲:与UTI+GHL组比较,P<0.01
图5各组大鼠不同时间点肠黏膜TNF-α、IL-6、HMGB1水平
3 讨论
脓毒症是多因素共同作用导致的获得性疾病,可由先天应激、细胞损伤以及器官功能障碍等因素引起[7],最常累及肠道,造成肠黏膜上皮水肿,上皮细胞膜及细胞间连接断裂,细胞坏死,上皮从绒毛顶端脱落,甚至黏膜全层脱落而形成溃疡。肠道损伤后,其通透性增加、肠屏障功能受损,肠道细菌及其毒素得以吸收进入循环系统而发生细菌移位,使SIRS加剧、失控,严重时诱发MODS,增加救治难度[8]。因而,在脓毒症的防治过程,如何改善肠道功能,是提高其救治成功率的关键之一。
肠道运动功能、消化吸收功能以及屏障功能是维持机体正常功能所必需。肠道屏障由机械屏障、化学屏障、免疫屏障与生物屏障共同构成,其中机械屏障和免疫屏障的功能是判断肠道屏障功能的常见指标。完整的彼此紧密连接的肠黏膜上皮结构构成了肠道的机械屏障;RD-5和TFF-3则是评价肠道免疫屏障功能的标志物。体外实验已经证实RD-5在保护肠道屏障功能中发挥着极为重要的作用[9],TFF-3可与黏液糖蛋白相互作用,具有修复肠黏膜细胞和保护肠黏膜细胞的功能[10]。
在本实验以内毒素诱导的脓毒症模型中,肠黏膜的机械屏障和免疫屏障均受到不同程度的损害,表现为光镜下肠黏膜组织超微结构的改变,例如:小肠绒毛顶端上皮下毛细血管充血及脱落,中央乳糜管扩张,固有层裸露、崩解,毛细血管出血等。同时伴有RD-5和TFF-3 mRNA的表达下调等。UTI和GHL均能不同程度减轻肠黏膜组织超微结构的损害,同时,UTI还能上调肠黏膜RD-5和TFF-3 mRNA的表达,而GHL在本实验条件下,未观察到这种作用,但能加强UTI的效应。说明UTI能有效改善脓毒症时的肠屏障功能,联合应用GHL能进一步减轻肠屏障损伤。本实验观察到内毒素血症时动物出现肠运动功能障碍,表现为小肠BD-2000推进率明显下降。这种肠动力的缺失,可导致中毒性肠麻痹、肠腔积液积气、麻痹性肠梗阻等,严重者可出现肠缺血坏死、穿孔,甚至引起腹腔间隙综合征(abdominal compartment syndrome,ACS)。应用GHL能显著加强内毒素血症大鼠的肠运动功能,其机制可能与降低Bcl-2和Bax的表达,抑制组织细胞凋亡的发生有关[11]。UTI虽然对脓毒症时的肠运动功能影响不明显,但能增强GHL的作用。
TNF-α、IL-6和HMGB1是脓毒症发生、发展中十分重要的炎症介质,可诱发全身炎症反应,进而造成包括肠道在内的诸多脏器损害[12-14]。已有文献报告,UTI和GHL均可抑制全身炎症反应[15-16]。本实验发现,UTI、ghrelin不仅能降低脓毒症时血清TNF-α、IL-6和HMGB1水平,即减轻全身炎症反应,还能显著抑制肠道黏膜组织中的TNF-α、IL-6和HMGB1水平,即还能抑制肠道黏膜组织的局部炎症反应,且二者在全身及脏器组织局部水平上均有协同作用。因此,本实验观察到的UTI对肠屏障功能的保护以及GHL促进肠道运动的机制不仅与二者抑制全身炎症反应的效应有关,同时还与其降低肠黏膜局部组织的炎症反应有着密切联系。
肠道屏障功能和运动功能是相互依赖、紧密联系的。肠运动功能的正常依赖于肠屏障结构的完整;反之,肠屏障结构和功能的损害,必然导致肠运动功能的减弱。因而,虽然本实验未观察到脓毒症时GHL对肠黏膜有直接的保护作用,但却通过改善肠运动功能,增强了UTI对肠黏膜的保护效应。同样,由于对肠黏膜的保护作用,UTI能增强GHL促进肠运动的效应。
综上所述,UTI联合ghrelin能显著改善脓毒症大鼠的肠道功能,其机制可能与其抑制脓毒症大鼠全身炎症反应及肠黏膜局部炎症反应有关,显示了二者联合用于脓毒症时的潜在价值。至于UTI和GHL在抑制全身及肠黏膜局部组织炎症反应方面的协同作用机制,尚需进一步探索。
[参考文献]
[1] Schuerholz T,Marx,G. Management of sepsis[J].Minerva Anestesiol,2008,74(5):181-195.
[2] Hotchkiss RS,Karl IE.The pathophysiology and treatment of sepsis[J].N Engl J Med,2003,348(2):138-150.
[3] Inoue K,Takano H.Urinary trypsin inhibitor as a therapeutic option for endotoxin-related inflammatory disorders[J].Expert Opin Investig Drugs,2010,19(4):513-520.
[4] Baatar D,Patel K,Taub DD.The effects of ghrelin on inflammation and the immune system[J].Mol Cell Endocrinol,2011,340(1):44-58.
[5] Cao YZ,Tu YY,Chen X,et al.Protective effect of Ulinastatin against murine models of sepsis: inhibition of TNF-alpha and IL-6 and augmentation of IL-10 and IL-13[J].Exp Toxicol Pathol,2012,64(6):543-547.
[6] Sibilia V,Rindi G,Pagani F,et al.Ghrelin protects against ethanol-induced gastric ulcers in rats: studies on the mechanisms of action[J].Endocrinology,2003,144(1):353-359.
[7] Glück T,Opal SM.Advances in sepsis therapy[J].Drugs,2004,64(8):837-859.
[8] Yu M,Shao D,Liu J,et al.Effects of ketamine on levels of cytokines,NF-kappaB and TLRs in rat intestine during CLP-induced sepsis[J]. Int Immunopharmacol,2007,7(8):1076-1082.
[9] Salzman NH,Ghosh D,Huttner KM,et al.Protection against enteric salmonellosis in transgenic mice expressing a human intestinal defensin[J].Nature,2003,422(6931):522-526.
[10] Nie SN,Qian XM,Wu XH,et al.Role of TFF in healing of stress-induced gastric lesions[J].World J Gastroenterol,2003,9(8):1772-1776.
[11] 付荣国,刘晓丹,祁彩霞,等.Ghrelin对CKD大鼠十二指肠消化间期移行性复合运动和Bcl-2/Bax表达的影响[J].西安交通大学学报(医学版),2011,32(5):565-568.
[12] Naffaa M,Makhoul BF,Tobia A,et al.Interleukin-6 at discharge predicts all-cause mortality in patients with sepsis[J].Am J Emerg Med,2013,31(9):1361-1364.
[13] Aikawa N,Takahashi T,Fujimi S,et al.A Phase II study of polyclonal anti-TNF-α (AZD9773) in Japanese patients with severe sepsis and/or septic shock[J].J Infect Chemother,2013,19(5):931-940.
[14] Yang M,Cao L,Xie M,et al.Chloroquine inhibits HMGB1 inflammatory signaling and protects mice from lethal sepsis[J].Biochem Pharmacol,2013,86(3):410-418.
[15] Fang Y,Xu P,Gu C,et al.Ulinastatin improves pulmonary function in severe burn-induced acute lung injury by attenuating inflammatory response[J].J Trauma,2011,71(5):1297-1304.
[16] Li WG,Gavrila D,Liu X,et al.Ghrelin inhibits proinflammatory responses and nuclear factor-kappaB activation in human endothelial cells[J].Circulation,2004,109(18):2221-2226.
