松油烯4醇体内外对人肺癌细胞系A-549增殖抑制作用
2014-08-28,,b,,,,
, ,b,,,,
(1.重庆医科大学:a.病理科;b.神经科学研究中心,重庆 400016;2.重庆市日用化学工业研究所,重庆 400065)
松油烯4醇是一种存在于多种植物精油中的单萜类化合物,具有多种生物活性。研究发现含有该种成分的精油具有抗菌、抗炎、除螨、镇咳、抗氧化、抗肿瘤等活性,已经被用于治疗口腔溃疡、牙龈炎、牙根管炎、手足癣以及皮肤感染等疾病,同时也用作护肤品的原料,可减少痤疮引起的红肿等[1-3]。但目前国内外针对松油烯4醇单体的研究还鲜有报道,本实验希望通过松油烯4醇对肺癌细胞株A-549增殖抑制作用及可能的作用机制的研究为肺癌及其他肿瘤化疗提供一个新的选择。
1 材料与方法
1.1 细胞株及实验动物
人细支气管肺泡癌细胞株 A-549由重庆医科大学病理科惠赠;SPF级BALB/c-nu裸小鼠21只购至重庆医科大学实验动物中心,4~5周龄,体质量15~19 g,雌雄不限,动物饲养合格证号:SCXK[渝]2007-0001。
1.2 主要试剂
标准胎牛血清(HyClone公司);DMEM 培养基(高糖型,HyClone 公司);0.25%胰蛋白酶(HyClone公司);MTT(北京鼎国昌盛生物技术有限责任公司);CCK8(碧云天生物技术研究所);松油烯4醇(西亚试剂,纯度大于或等于98%)。
1.3 细胞培养、动物饲养及药品配制
将A549细胞培养于含10%胎牛血清的DMEM高糖完全培养基中,培养基中加入青霉素100 U/mL和链霉素100 Lg/mL。将细胞置于37 ℃,5%CO2孵箱中在饱和湿度下培养,隔日换液1次,每3天以1∶2正常传代培养1次,采用0.25%胰蛋白酶消化细胞。裸鼠实验和饲养均在重庆医科大学动物实验中心恒温、恒湿的 SPF 动物房进行,12 h 昼夜节律,裸鼠可以自由进食和饮水。松油烯4醇以11 ul加入5.5 mL培养液中配成0.2%v/v的母液使用时按比例稀释成0.02%~0.1% v/v工作液。过滤除菌分装后4 ℃条件下保存备用。
1.4 MTT法检测细胞增殖抑制及IC50
将密度为1×104/mL的A549细胞接种于 96 孔板中过夜,每孔100 μl,加入含不同浓度油烯4醇(0、0.02%、0.04%、0.06%、0.08%、0.1%v/v)的培养液(200 μl/孔)培养24 h后,每孔加入20 μl的MTT(5 mg/mL用PBS 配制,pH 7.5)。继续培养4 h后,吸出废液,每孔加入150 μl DMSO,于60 r/min的摇床中振荡10 min。在490 nm波长处用酶联免疫检测仪测定各孔的光吸收值。计算抑制率:抑制率=[1-处理组D(490)值/对照组D(490)值]×100% ,再计算半数抑制浓度(IC50)。
1.5 实验分组
根据MTT实验结果将A-549细胞分为对照组和实验组,对照组用正常培养基培养细胞,实验组分为0.04%、0.06%、0.08%(v/v)组分别以含有相应浓度的松油烯4醇的培养基培养。将21只裸鼠按随机数目表随机分为实验组(0%v/v)、低剂量组(0.06%v/v)、高剂量组(0.08%v/v)。
1.6 CCK-8 比色分析法绘制生长曲线
取对数生长A-549 细胞按(每孔1×103)接种于五块96孔板中,37 ℃,5% CO2培养隔夜贴壁后,加入含松油烯4醇(0、0.02%、0.04%、0.06%、0.08%、0.10%v/v)的培养液(每孔200 μl),边缘孔以PBS填充,同时设置空白孔(培养基CCK-8,无细胞),每组设5复孔,每隔24 h取出一块每孔加入10 μLCCK-8溶液,4 h后测定450 nm各孔的吸光度值,连测5 d。以时间为横轴,每天的吸光度值为纵轴绘制生长曲线。实验重复3次。
1.7 透射电镜观察细胞超微结构改变
细胞培养24 h后用胰酶消化PBS洗涤1次后,将细胞悬液转移到EP管中以1 200 r/min离心10 min。吸弃上清液,沿管壁缓慢加入预先配制好的固定液,4 ℃保存过夜后送电镜室,用 HITACHI-7500透射电镜观察各组细胞的超微结构变化。
1.8 细胞周期及凋亡检测
取对数生长期A-549细胞按5×105个/孔的浓度接种于六孔板中。培养箱内培养过夜贴壁后弃上清,加入无血清DMEM高糖培养液,饥饿同步18 h,使细胞停滞于G0期。按分组方法分组培养24 h后,收集上清液细胞;0.25%胰酶-EDTA消化,1 000 r/min离心10 min,收集贴壁细胞,PBS洗涤2次,1 000 r/m离心10 min。在检测细胞凋亡的试管中先后加入1×Buffer 100 mL,AV染液5 μL,PI染液1 μL,避光15 min,再加入1×Buffer 400 μL,上机检测;检测周期细胞加入70%冷乙醇在4 ℃固定12 h后在试管中加入1 mL的DNA染色剂,避光30 min,上机检测。用随机软件进行数据分析,每组重复3次。
1.9 细胞内钙离子浓度测定
对数生长期的A-549细胞按分组方法分组培养24 h,1 000 r/min,离心5 min。洗涤后,在结合缓冲液中,加入终浓度为5 μmol·L-1的Flou-3/AM,,置CO2培养箱中孵育1 h后反复洗涤后用流式细胞仪检测各组荧光强度,激发波长488 nm。每组重复3次。
1.10 BALB/C(nu/nu)裸小鼠体内移植瘤建立
将肺癌A-549细胞按常规方法培养,消化离心收集后,台盼蓝染色活细胞计数大于99%,计数并调整细胞浓度为5×106个/mL。用带6号针头注射器抽取癌细胞悬液接种于裸鼠右前腋部皮下,每个部位接种 0.2 mL(含活细胞数1×106个),接种后每天观察有无肿瘤形成及注射点有无破溃红肿,经过3~7 d潜伏期,可见接种部位皮下出现瘤结节,并逐渐长大,呈圆形或椭圆形突出于体表,以肿瘤直径0.5 cm为成瘤。
1.11 治疗后抑瘤率的测定
按分组方法将21只裸小鼠按随机数目表随机分为对照组、低剂量组、高剂量组,以相应药物浓度进行腹腔注射给药,每只每天0.1 mL,治疗10 d后脱颈处死,分离瘤组织测量其长短径和重量,移植瘤的体积按公式:V(mm3)=πab2/6计算。根据治疗结束后移植瘤瘤质量及体积计算各组平均瘤质量及平均瘤体积。通过各组平均瘤质量计算抑瘤率( inhibition ratio,IR)。IR=(对照组平均瘤质量-治疗组平均瘤质量)/对照组平均瘤质量×100%。
1.12 统计学处理
2 结果
2.1 松油烯4醇对A-549细胞增殖抑制影响及IC50
不同浓度的松油烯4醇作用A-549细胞株24 h后,从松油烯4醇浓度0.02%v/v开始对细胞株的生长均有抑制作用,与对照组相比,差异均有统计学意义(P<0.05),并呈浓度依赖性(图1)。运用SPSS 17.0分析计算A-549细胞株24 h的IC50为0.067%v/v。

*:与对照组比较,P<0.05;#:与对照组比较,P<0.01
2.2 不同浓度松油烯4醇对A-549细胞生长曲线的影响
根据5 d的CCK8结果来绘制生长曲线,结果显示给药组生长曲线明显较对照组平缓,表明松油烯4醇对A-549细胞的抑制作用呈时间、剂量依赖性(图2)。

*:与对照组比较,P<0.05;#:与对照组比较,P<0.01
2.3 松油烯4醇对A549细胞超微结构的影响
透射电镜观察显示:未用松油烯4醇处理的细胞可见到少量自噬空泡(图3a),松油烯4醇处理24 h后的细胞内可见大量自噬空泡、扩张的内质网等(图3b、c、d)。

a:空白对照组;b:0.04组;c:0.06组;d:0.08组
图3不同浓度松油烯4醇作用与A549细胞后透射电镜观察细胞超微结构改变情况
2.4 A-549细胞周期分布、凋亡、细胞内Ca2+浓度、细胞 膜电位水平测定
2.4.1 A-549细胞周期分布测定 实验结果显示不同浓度松油烯4醇处理细胞24 h后,药物组与对照组比较,松油烯4醇能降低A-549细胞的G1期细胞的比例,升高G2期和S期细胞比例,呈现G2期和S期阻滞作用,并呈剂量依赖性,差异具有统计学意义(P<0.05),见表1、图4。
2.4.2 肺癌A-549细胞凋亡检测 与空白对照组相比,经药物处理24 h后的细胞凋亡的比例均有明显升高,且晚期凋亡的比例呈现一定的剂量-效应关系,见表2、图5。
2.4.3 A-549细胞内钙离子浓度测定 不同药物浓度作用24 h后,各药物干预组细胞内Ca2+荧光强度均明显高于正常对照组,且随着药物浓度的增加而增加,差异有统计学意义(P<0.05),见表2、图6。
2.5 松油烯4醇对肺癌裸鼠移植瘤生长的影响
治疗结束时对照组移植瘤体积及平均瘤质量,见表3、图7。各组移植瘤平均体积和平均质量相互比较差异均有统计学意义(P<0.05)。计算高、低剂量的松油烯4醇对肺癌裸鼠移植瘤生长抑制率分别为53.33%和77.46%。

表1 松油烯4醇对A-549细胞周期的影响
*:与对照组比较,P<0.05;#:与对照组比较,P<0.01

a:空白对照组;b:0.04组;c:0.06组;d:0.08组


分组总凋亡率(%)Ca2+荧光强度对照组1.18±0.16100.30±12.750.04组8.43±0.51*129.7±0.96△0.06组33.75±0.65*781.78±9.24#0.08组44.32±2.35*1014.2±83.47#
*:与对照组比较,P<0.05;#:与对照组比较,P<0.01;△:与对照组比较,P>0.05
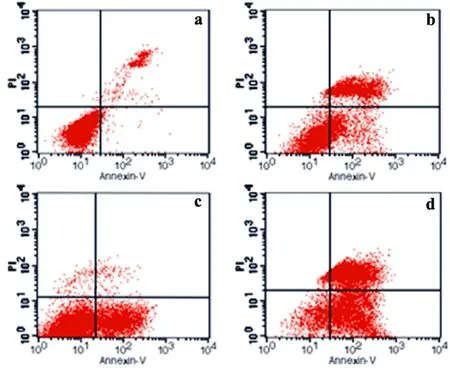
a:对照组;b:0.04%组;c:0.06%组;d:0.08%组
5AnnexinV-FITC/PI双染流式细胞仪分析松油烯4醇处理
A-549细胞后细胞凋亡情况

a:对照组;b:0.04组;c:0.06组;d:0.08组
6不同药物浓度作用于A-549细胞后细胞内Ca2+浓度改变情况

表3 各组裸鼠移植瘤体积、瘤质量及抑制率
*:与对照组比较,P<0.05;#:与对照组比较,P<0.01

a:对照组;b:低剂量组;c:高剂量组
3 讨论
肺癌是世界上最常见的恶性肿瘤之一,随着我国人口老龄化的加剧,经济快速发展带来的环境污染以及吸烟率居高不下等原因,肺癌已成为我国城市人口恶性肿瘤死亡原因的第一位[4-5]。化疗目前是肺癌特别是中晚期肺癌最有效的治疗方法之一。然而传统的肺癌化疗药物常因严重损害人体正常组织细胞而使临床应用受到限制[6-7]。人们期望一种既能抗肿瘤,又不过多损害机体正常组织的新化疗药物的出现。
本实验用人非小细胞肺癌细胞株A-549以及BALB/C裸小鼠移植瘤研究了松油烯4醇对人肺癌的体外及体内作用及其机制。MTT、CCK8以及体内抗移植瘤实验显示与对照组相比,松油烯4醇在0.02%~0.1%v/v浓度范围内对A-549细胞均有明显抑制作用,且呈剂量依赖和时间依赖性的关系。
细胞增殖即是细胞周期循环的过程,因此细胞增殖的抑制既是细胞周期循环停滞的结果。肿瘤细胞的增殖动力学特点表现为细胞群体分布主要与DNA合成活跃的S期有关,细胞一旦进入此期,如无特殊干扰,便能按细胞周期的顺序发展下去,直至重新回到G1期。本研究通过流式细胞仪分析细胞周期表明,不同浓度松油烯4醇处理细胞24 h后,药物组与对照组比较剂量依赖性的降低G1期细胞的比例,升高S期细胞比例,使细胞呈现S期阻滞。
肿瘤的发生不仅与细胞的异常增殖和分化有关,也与细胞程序性死亡功能紊乱有关。细胞程序性死亡是指机体在生长、发育以及受到外来刺激时清除多余、衰老或受损伤的细胞以保持机体内环境平衡和维持正常生理活动过程的一种自我调节机制。正常生命个体每天有数以亿计的细胞诞生,同时又有数以亿计的细胞程序性死亡,两者处于一种动态平衡,一旦失衡就可能导致肿瘤的发生。细胞凋亡和自噬被称为Ⅰ型和Ⅱ程序性细胞死亡,目前使用的大多数化疗药物就是通过诱导细胞凋亡和自噬而达到杀灭肿瘤细胞作用的[8-11]。本实验研究发现松油烯4醇具有诱导A549细胞凋亡和自噬增强的作用。
很多文献指出,凋亡以及自噬过程与线粒体有着非常密切的关系,而线粒体是细胞内的钙库,调节着细胞内Ca2+的平衡[12-14]。故本实验用流式细胞技术检测了药物处理后细胞内Ca2+浓度改变情况,发现给药组Ca2+浓度升高并呈剂量依赖性 ,说明在细胞程序性死亡过程中,Ca2+可能也参与其中,并发挥了一定的作用,但有关它们之间具体的联系还有待进一步的研究。
总之,本实验证实松油烯4醇具有抑制人肺癌A-549细胞增殖的作用,并呈一定的剂量依赖性和时间依赖性,其可以阻止A-549细胞周期,并诱导细胞发生凋亡和自噬,诱导凋亡和自噬的途径可能与细胞内Ca2+超载相关。至于松油烯4醇抑制A-549细胞增殖阻滞细胞周期以及诱导凋亡和自噬的确切机制仍需后期研究进一步证实。
[参考文献]
[1] Tighe S,Gao YY,Tseng SC.Terpinen-4-ol is the Most Active Ingredient of Tea Tree Oil to Kill Mites[J].Transl Vis Sci Technol,2013,2(7):2-8.
[2] Furneri PM,Paolino D,Saija A,et al.In vitro antimycoplasmal activity of Melaleuca alternifolia essential oil[J].J Antimicrob Chemother,2006,58(3):706-707.
[3] Cox SD,Mann CM,Markham JL,et al.The mode of antimicrobial action of the essential oil of Melaleuca altenifolia (tea tree oil)[J].J Appl Microbiol,2000,88(1):170-175 .
[4] 吴鹏昌,张 伟.茶树油的研究进展[J].综述报告,2009,18(3):61-62
[5] 陈仁杰,张金良,阚海东.中国大气污染与肺癌关系的流行病学研究回顾[J].卫生研究,2011,40(2):243-245.
[6] 陈万青,张思维,邹小农.中国肺癌发病死亡的估计和流行趋势研究[J].中国肺癌杂志,2010,13(5):488-493.
[7] Lúcio KA, Rocha Gda G, Monção-Ribeiro LC,,et al.Oleanolic acid initiates apoptosis in non-small cell lung cancer cell lines and reduces metastasis of a B16F10 melanoma model in vivo[J].PLoS One,2011,6(12):e28596.
[8] Fu ZY,Han JX,Huang HY.Effects of emodin on gene expression profile in small cell lung cancer NCI-H446 cells[J].Chin Med J (Engl),2007,120(19):1710-1715.
[9] Mathew R,Karantza-Wadsworth V,White E.Role of autophagy in cancer[J].Nat Rev Cancer,2007,7(12):961-967.
[10] Li J,Hou N,Faried A,et al.Inhibition of autophagy augments 5-fluorouracil chemotherapy in human colon cancer in vitro and in vivo model[J].Eur J Cancer,2010,46(10):1900-1909.
[11] Lockwood TD,Minassin IA.Protein turnover and proliferation.Failure of SV-3T3 cells to increase lysosomal proteinases,increase protein degradation and cease net protein accumulation[J].Biochem J,1982,206(2):251-258.
[12] Cao Y,Klionsky DJ.Physiological functions of Atg6/Beclin 1: a unique autophagy-related protein[J].Cell Res,2007,17(10): 839-849.
[13] Guo WJ,Ye SS,Cao N,et al.ROS-mediated autophagy was involved in cancer cell death induced by novel copper(II) complex[J].Exp Toxicol Pathol,2010,62(5):577-582.
[14] Rodriguez-Enriques S,He L,Lemasters JJ.Role of mitochondrial permeability transition pores in mitochondrial autophagy[J].Int J Biochem Cell Biol,2004,36(12):2463-2472.
