SOX6和SOX9基因转染对人原发性骨关节炎关节软骨间充质祖细胞增殖和成软骨分化的调控作用
2014-08-28,,,,,,,
,, ,, ,,,
(沈阳军区总医院骨科,辽宁 沈阳 110016)
原发性骨关节炎(osteoarthritis, OA)关节软骨中间充质祖细胞(mesenchymal progenitor cells,MPCs)数量仅占其关节软骨细胞数量的3%~4%,虽然OA关节软骨MPCs比正常人增殖活跃,但其成软骨、成骨分化能力较低。如何利用有效基因过表达,调控原发性OA关节软骨MPCs的增殖和成软骨分化作用,恢复OA关节软骨细胞调节和维持软骨组织损伤与修复的动态平衡,具有重要的科学意义和临床应用前景。在体外培养中添加细胞因子易流失,且细胞因子价格昂贵,因此结合应用转基因技术,将具有促进关节软骨MPCs增殖和成软骨分化的目的基因导入其中,在细胞中高表达促进关节软骨MPCs的增殖和分化,修复退变和损伤的软骨,无疑具有重要的作用。目前对SOX家族促软骨分化作用研究,国内外相关文献报道较少。本实验应用基因转染技术,用SOX6、SOX9基因感染原发性OA关节软骨的MPCs,诱导其成软骨分化,比较SOX6、SOX9基因感染和未感染组细胞的成软骨分化能力的变化。进一步探讨基因治疗在关节软骨退变中应用的可行性,为临床治疗软骨退变和软骨损伤提供新的理论支持。
1 材料与方法
1.1 实验材料
采用免疫磁珠方法分选得到原发性OA及正常人关节软骨MPCs。SOX6、SOX9基因转染相关试剂:脂质体( 美国lipofectAMINE 2000 )、Ⅱ 型胶原多克隆抗体(美国santa cruze) Pme I,Pac I内切酶(英国 NEB)、Xho I,Sal I,T4连接酶及T载体(大连宝生物公司)、腺病毒载体。主要仪器设备:细胞培养、RT-PCR检测仪器设备。
1.2 方法
1.2.1 SOX6、SOX9基因的构建 细胞及细胞株(人胚肾FT-293细胞)购自invitriogen公司。pAdTrack-CMV-SOX6,SOX9的构建。pAdtrack-CMV-SOX6,SOX9穿梭质粒的鉴定。使用Sal I、Xho I双酶切后,凝胶电泳鉴定应见到576bp片段为SOX6,SOX9,9.2kb片段为pAdtrack-CMV载体片段。pAdEasy-SOX6,SOX9重组质粒构建与鉴定。pAdEasy-SOX6,SOX9重组腺病毒基因组质粒的鉴定。
1.2.2 pAdEasy-SOX6,SOX9重组腺病毒的包装、筛选及鉴定 本实验中腺病毒载体是一种复制缺陷病毒,不能自行包装成为具有感染能力的病毒颗粒,因此我们必须在293包装细胞中进行包装。本试验所采用的293细胞是由Invitrogen公司提供的FT-293细胞,与普通的293细胞相比,具有较强的黏附能力和空斑形成能力。均成功包装为有感染能力的腺病毒。
1.2.3 病毒纯化 以CsCl2方法纯化病毒,并进行滴度测定。通过RFP阳性细胞计数法测定。滴度=IU×计量孔相对于第一孔的稀释倍数/第一孔加入病毒体积。
1.2.4 SOX6、SOX9基因感染原发性OA关节软骨MPCs 以不同滴度(1×104,2×104,3×104,4×104,5×104)病毒感染细胞,24 h后观察感染效率,确定最佳感染浓度。
1.2.5 基因感染原发性OA关节软骨MPCs的成软骨分化 进行基因感染及未感染细胞成软骨诱导培养,每日倒置显微镜下观察比较基因转染和未转染组OA关节软骨MPCs的形态变化和生长情况,观察周期14 d。基因转染和未转染组细胞成软骨分化检测指标包括:①TB染色;②Ⅱ型胶原免疫细胞化学检测(方法同前);③Ⅱ型胶原mRNA定量RT-PCR检测。成软骨诱导培养2周,取6孔板中的细胞,用定量RT-PCR检测细胞Ⅱ型胶原mRNA表达。操作方法同Ⅱ型胶原基因mRNA检测。
1.3 统计学方法

2 结果
2.1 SOX6、SOX9基因的构建、鉴定及纯化
2.1.1 pAdTrack-CMV-SOX6,SOX9腺病毒穿梭质粒构建 成功获得SOX6,SOX9基因克隆,经过PCR检测,该基因克隆证实与Genebank报道序列一致(见图1)。图1结果显示,SOX基因克隆左为SOX6,条带为2 500bp左右,右为SOX9,条带为1 750bp左右。(Marker为DL2000,由上至下依次为2 000,1 000,750,500,250,100 bp)。pAdTrack-CMV-SOX6,SOX9双酶切鉴定(见图2)。图2结果显示,T-SOX6,SOX9和pAdTrack-CMV双酶切获得SOX6,SOX9目的片段和病毒载体骨架质粒pcDNA3.1-SOX6,SOX9重组载体经Sal I、Xho I双酶切,凝胶电泳后,紫外透射反射检测仪上可观察到预期大小的目的片段(SOX6约2 500bp,SOX9约1 800bp)。经Sal I、Xho I双酶切后pAdTrack-CMV同样可以释放出同样大小目的片段,与预期的结果相符。重组pAdEasy-SOX6,SOX9经Pac I酶切可见23 kb SOX6和4.0 kb SOX9片段。

图1 PCR检测SOX6,SOX9基因克隆

a:pAdTrack-CMV释放出预期大小目的片段;b:pAdEasy-SOX6,SOX9经Pac I酶切可见23 kb和4.0 kb左右片段
图2SOX6、SOX9双酶切鉴定
2.1.2 病毒包装、纯化与滴度测定 脂质体包裹pAdEasy-SOX6,SOX9同源重组腺病毒基因组质粒转染293FT包装细胞10 d后,光镜下观察到空斑形成,细胞变圆、肿胀、脱壁,细胞核变大等病变。绿色荧光的表达情况显示,荧光显微镜下观察,在绿色荧光激发通道GFP受激发,表达GFP基因的细胞发出明亮的绿色荧光(见图3)。重组腺病毒感染的293细胞,在培养2~3 d后有绿色荧光表达,并且逐渐增多,荧光表达逐步增强。Ad-SOX6,SOX9重组腺病毒经293FT细胞5轮扩增提高滴度,之后大量扩增,采用倍比稀释法测定腺病毒滴度为5×1010PFU/mL。

a:pAdEasy-SOX6,同源重组腺病毒基因组质粒转染健康293包装细胞收获病毒,再次感染293FT细胞;b:pAdEasy-SOX9,同源重组腺病毒基因组质粒转染健康293FT包装细胞收获病毒,再次感染293FT细胞
图3pAdEasy-SOX9绿色荧光的表达情况(×100)
2.2 SOX6、SOX9基因能有效感染OA关节软骨MPCs细胞
结果显示,接种5×103MPCs细胞于96孔培养板,培养1 d后加入不同滴度病毒液SOX6或SOX9病毒液感染细胞,24 h后观察显示两种基因包装病毒在2×104滴度时对MPCs细胞具有良好的侵袭性,感染效率近100%,且细胞生长状态良好(1×104滴度时感染效率仅60%,3×104~5×104滴度时有部分细胞死亡),见图4。

a:同视野普通光镜;b:同视野荧光;c:同视野普通光镜;d:同视野荧光
图4SOX6及SOX9对MPCs的感染(×200)
2.3 SOX6、SOX9基因感染的原发性OA关节软骨 MPCs成软骨分化潜能
2.3.1 细胞形态学观察 基因感染组细胞经成软骨诱导培养,可见明显的细胞聚集生长、基质分泌,高密度接种处可形成多个结节,并逐渐增大;未感染组细胞聚集培养后形成结节数量少,结节形态小,分泌基质少,见图5。
2.3.2 TB染色 SOX9基因感染组软骨诱导分化的“微团”结节培养14 d,其TB染色深浓;SOX6基因感染组成软骨诱导分化“微团”结节培养14 d,TB染色也呈深染,但弱于SOX9;未感染组成软骨诱导分化“微团”结节培养14 d,TB染色浅淡(见图6)。
2.3.3 Ⅱ型胶原免疫细胞化学染色 SOX9基因感染组成软骨诱导分化的“微团”结节培养14 d,Ⅱ型胶原呈强阳性表达(图7a);SOX6基因感染组成软骨诱导分化“微团”结节培养14 d,Ⅱ型胶原呈阳性表达(图7b);未感染组成软骨诱导分化“微团”结节培养14 d,Ⅱ型胶原表达呈弱阳性(图7c)。
2.3.4 Ⅱ型胶原mRNA表达 图8结果显示,SOX6能增强Ⅱ型胶原mRNA的表达,是未感染组的3.8倍(P<0.05)。SOX9基因对Ⅱ型胶原mRNA的表达具有更强的促进作用,感染组是未感染组的5.15倍(P<0.01)。

a:SOX9感染组;b:SOX6感染组;c:未感染组
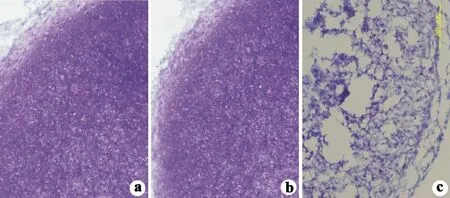
a:SOX9感染组;b:SOX6感染组;c:未感染组

a:SOX9感染组;b:SOX6感染组;c:未感染组
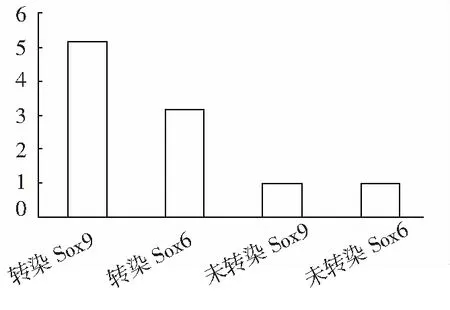
图8 SOX6、SOX9基因感染组和未感染组Ⅱ型胶原mRNA基因表达变化
3 讨论
SOX基因家族是控制发育的一类新的以SRY基因为代表的基因家族[1]。这类基因功能的实现依赖于一个DNA的结合基序列称为HMG2box编码的产物[2-3]。SOX9在软骨细胞分化过程中发挥非常必要的作用,其对于建立软骨生长板及促进正常的软骨内成骨和及时发育都是必需的,并且SOX9与SOX6共同表达于所有分化的软骨细胞和软骨前细胞[4]。SOX9主要参与对软骨细胞分化进行调节的过程,而对于正常状态关节软骨的代谢变化与Ⅱ型胶原的表达没有增强效应[5]。既往文献报道SOX9参与调节软骨细胞的成熟过程,但其对软骨细胞的具体作用,离体培养细胞环境与体内环境存在的差异等问题有待进一步研究[6]。SOX9基因作用于软骨细胞的分化阶段,SOX9在退变的软骨细胞中表达明显增多,该基因参与软骨退变和OA软骨细胞的分化与调控过程[7]。Yang等[8]通过实验证实了通过纤维蛋白凝胶封装或转染SOX基因(SOX5, 6, 9)的移植间充质干细胞能够成功分化为成熟的软骨细胞并用于重建透明关节软骨。Kim等[9]通过实验指出,SOX基因(SOX5, 6, 9)在人类间充质干细胞的表达明显低于软骨细胞。电穿孔介导的共转染SOX基因(SOX5, 6, 9)能够增强人类间充质干细胞的软骨形成并抑制人类间充质干细胞的肥大。SOX9基因转染能够改善软骨形成[10],SOX9基因功能的缺失会导致体外鼠胚胎干细胞软骨分化的缺陷[11]。SOX5, SOX6和SOX9的结合能够为永久性软骨的诱导提供足够信号[12]。转录因子SOX9在软骨分化过程中发挥重要作用, SOX5、SOX6的基因表达需要SOX9[13]。转录因子SOX9在软骨形成过程中发挥重要作用,但是在软骨内骨化的晚期起抑制作用。单独SOX9基因或SOX9基因与SOX5、SOX6基因过度表达都会抑制小鼠初级软骨细胞的成熟与钙化[14]。SOX6和SOX9对成软骨分化的调控作用非常复杂,存在的争议也较多[15-16]。诸多因素如细胞培养条件、细胞的增殖状态等均会影响SOX基因对MSCs成软骨分化的调节作用,尤其是细胞的分化状态对SOX9作用的影响更为巨大,有关的确切机制尚不明,考虑可能与以下因素有关:①细胞因子刺激后信号传递途径的改变及细胞表面受体表达的改变;②周围细胞外基质发生变化影响胶原合成效应。SOX9调节转录的确切分子机制还不是很清楚,只有确定了它们作用的靶基因,研究才能进一步突破[17-18]。
本实验观察了SOX6、SOX9基因转染的OA关节软骨中的MPCs的成软骨分化过程,结果发现SOX6、SOX9基因转染的OA关节软骨MPCs细胞经微球培养后可见明显的细胞聚集现象,形成大量的乳白色类软骨样结节;未转染组形成结节数量少,形态小,分泌基质少。OA关节软骨MPCs基因转染组细胞成软骨分化诱导后TB染色显示Ⅱ型胶原染色呈强阳性,未转染组仅为阳性着色;Ⅱ型胶原定量RT-PCR检测结果发现SOX6基因转染OA关节软骨MPCs细胞,在成软骨分化过程中,能显著增强Ⅱ型胶原mRNA的表达,是未转染组的3.8倍;SOX9基因对Ⅱ型胶原mRNA的表达具有更强的促进作用,转染组是未转染组的5.15倍,说明SOX6、SOX9转染OA关节软骨MPCs能显著促进OA关节软骨MPCs成软骨分化并合成关节软骨细胞外基质Ⅱ型胶原,促进软骨退变和损伤的修复。Lee等[19]通过实验指出,脂肪干细胞与SOX基因(SOX5, SOX6, SOX9)共转导能够明显促进骨软骨缺损模型的在体软骨愈合并且能够阻止手术诱导的骨关节炎的退行性变。Kim等[20]通过实验指出,髋关节骨关节炎与SOX9启动子表观遗传学的改变有关,包括DNA的甲基化及组蛋白修饰的改变。Lee等[21]通过实验指出,SOX基因(SOX5, 6, 9)及蛋白随着人类关节软骨骨关节炎的进展而减少。Haag等[22]通过人体标本的实验研究指出,SOX6与SOX9在骨关节炎软骨细胞转录水平的下降是骨关节炎软骨细胞表型稳定性丢失的原因。本研究为临床上进行MPCs基因转染,促进其增殖和分化,体外扩增修复关节软骨损伤提供新的治疗方法。
[参考文献]
[1] Sekiya I, Tsuji K, Koopman P, et al. SOX9 enhances aggrecan gene promoter/enhancer activity and is up-regulated by retinoic acid in a cartilage-derived cell line, TC6[J]. J Biol Chem, 2000, 275(15):10738-10744.
[2] Shakibaei M, Seifarth C, John T, et al. Igf-I extends the chondrogenic potential of human articular chondrocytes in vitro: molecular association between Sox9 and Erk1/2[J]. Biochem Pharmacol, 2006, 72(11):1382-1395.
[3] Kulyk WM, Franklin JL, Hoffman LM. Sox9 expression during chondrogenesis in micromass cultures of embryonic limb mesenchyme[J]. Exp Cell Res, 2000, 255(2):327-332.
[4] Murakami S, Lefebvre V, de Crombrugghe B. Potent inhibition of the master chondrogenic factor Sox9 gene by interleukin-1 and tumor necrosis factor-alpha[J]. J Biol Chem, 2000, 275(5):3687-3692.
[5] Akiyama H, Chaboissier MC, Martin JF, et al. The transcription factor Sox9 has essential roles in successive steps of the chondrocyte differentiation pathway and is required for expression of Sox5 and Sox6[J]. Genes Dev, 2002, 16(21):2813-2828.
[6] Trippel SB, Ghivizzani SC, Nixon AJ.Gene-based approaches for the repair of articular cartilage[J]. Gene Ther, 2004, 11(4):351-359.
[7] Bi W, Huang W, Whitworth DJ, et al.Haploinsufficiency of Sox9 results in defective cartilage primordia and premature skeletal mineralization[J]. Proc Natl Acad Sci USA, 2001, 98(12):6698-6703.
[8] Yang HN, Park JS, Woo DG, et al.Chondrogenesis of mesenchymal stem cells and dedifferentiated chondrocytes by transfection with SOX Trio genes[J]. Biomaterials, 2011, 32(30):7695-7704.
[9] Kim HJ, Im GI. Electroporation-mediated transfer of SOX trio genes (SOX-5, SOX-6, and SOX-9) to enhance the chondrogenesis of mesenchymal stem cells[J]. Stem Cells Dev, 2011, 20(12):2103-2114.
[10] Kupcsik L, Stoddart MJ, Li Z, et al. Improving chondrogenesis: potential and limitations of SOX9 gene transfer and mechanical stimulation for cartilage tissue engineering[J]. Tissue Eng Part A, 2010, 16(6):1845-1855.
[11] Hargus G, Kist R, Kramer J, et al. Loss of Sox9 function results in defective chondrocyte differentiation of mouse embryonic stem cells in vitro[J]. Int J Dev Biol,2008,52(4):323-332.
[12] Ikeda T, Kamekura S, Mabuchi A, et al. The combination of SOX5, SOX6, and SOX9 (the SOX trio) provides signals sufficient for induction of permanent cartilage[J]. Arthritis Rheum,2004,50(11):3561-3573.
[13] Akiyama H, Chaboissier MC, Martin JF, et al. The transcription factor Sox9 has essential roles in successive steps of the chondrocyte differentiation pathway and is required for expression of Sox5 and Sox6[J]. Genes Dev, 2002,16(21):2813-2828.
[14] Amano K, Hata K, Sugita A, et al. Sox9 family members negatively regulate maturation and calcification of chondrocytes through up-regulation of parathyroid hormone-related protein[J]. Mol Biol Cell,2009,20(21):4541-4551.
[15] Spokony RF, Aoki Y, Saint-Germain N, et al. The transcription factor Sox9 is required for cranial neural crest development in Xenopus[J]. Development, 2002, 129(2):421-432.
[16] Vidal VP, Chaboissier MC, de Rooij DG, et al. Sox9 induces testis development in XX transgenic mice[J]. Nat Genet, 2001, 28(3):216-217.
[17] Bowles J, Schepers G, Koopman P. Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators[J]. Dev Biol, 2000, 227(2):239-255.
[18] 赵庆华.SOX9蛋白对人颈椎退变疾病透明软骨细胞作用的实验研究[D].第二军医大学.2007.
[19] Lee JM, Im GI.SOX trio-co-transduced adipose stem cells in fibrin gel to enhance cartilage repair and delay the progression of osteoarthritis in the rat[J]. Biomaterials, 2012, 33(7):2016-2024.
[20] Kim KI, Park YS, Im GI.Changes in the epigenetic status of the SOX-9 promoter in human osteoarthritic cartilage[J]. J Bone Miner Res, 2013, 28(5):1050-1060.
[21] Lee JS, Im GI. SOX trio decrease in the articular cartilage with the advancement of osteoarthritis[J]. Connect Tissue Res, 2011,52(6):496-502.
[22] Haag J, Gebhard PM, Aigner T. SOX gene expression in human osteoarthritic cartilage[J]. Pathobiology. 2008,75(3):195-199.
