结直肠癌组织与血液KRAS/BRAF基因突变表达一致性检测分析
2014-08-28马文华李娜赵利平张明明安永辉
马文华 李娜 赵利平 张明明 安永辉
·论著·
结直肠癌组织与血液KRAS/BRAF基因突变表达一致性检测分析
马文华 李娜 赵利平 张明明 安永辉
目的我国大部分结直肠癌患者发现的时候已经是中晚期,很难取到病理组织行KRAS、BRAF基因检测,故限制靶向药物应用,此实验研究目的是对原发肿瘤和血清KRAS/BRAF基因突变一致性进行研究。方法共纳入48例患者,分别对血清和肿瘤组织中KRAS及BRAF基因表达情况采用液相芯片技术进行检测。结果原发肿瘤组织KRAS突变率40%(19/48),血清42%(20/48)。在19例肿瘤组织样本KRAS突变,14例血清样本中的相同的突变,符合率73.7%(14/19)。在1个肿瘤组织检测到BRAF基因突变,在血清样本中未发现BRAF基因突变。结论在KRAS基因的原发肿瘤和配对血清样本之间突变率有很好的一致性。
结直肠癌;KRAS基因;BRAF基因;突变;液相芯片技术
结直肠癌作为最常见的恶性肿瘤之一,位居癌症死因第3 位,每年有超过一百万的大肠癌新增病例[1]。目前抗EGFR治疗基因靶标临床研究主要集中于KRAS、BRAF基因。BRAF基因的突变是野生型KRAS患者疗效不佳主要因素[2]。在结直肠癌应用靶向药物之前行KRAS基因突变检测已经被NCCN指南推荐。而行BRAF基因突变检测也是必要的。但中晚期结直肠癌患者组织标本获取率低,许多晚期结直肠癌患者很难在治疗前及治疗中取得组织标本以明确KRAS、BRAF基因突变状况。另外由于肿瘤组织的异质性、原发灶和转移灶基因型表达存在差异[3]。本研究对肿瘤组织及血清KRAS、BRAF突变情况分别进行检测,探讨在结直肠肿瘤组织与血液中KRAS /BRAF之间的一致性程度,确定血液中KRAS/BRAF基因突变情况是否可以替代结直肠癌组织学基因检测。
1 资料与方法
1.1 一般资料 患者2010年8月至2013年8月,共有45例。这些患者均经病理组织学证实。并通过影像学及手术结果,根据美国癌症联合委员会(AJCC)结直肠癌的TNM分期系统进行分期。
1.2 标本制备与检测方法 组织标本为手术切除肿瘤组织或石蜡包埋切片;采集外周血5 ml,基因突变检测由广州益善公司负责检测,采用液相芯片技术进行突变检测,此技术具有特异性强,灵敏度高,重复性好的特点,突变富集-液相芯片技术特别适用于血浆、胸腹水等体液标本的检测。
1.3 统计学分析 应用SPSS 15.0软件,应用Kapparel统计方法,κ系数(k≥0.7较高的一致性, 0.7>κ≥0.4一致性一般, κ<0.4一致性较差)被用来比较组织与血清K-RAS,B-RAF基因突变的一致性。
2 结果
2.1 患者的特点 在48例患者中,男32例,女16例;年龄27~83岁,平均年龄56岁。原发肿瘤位于结肠有26例(54.2%),位于直肠22例(45.8%)。肿瘤分期情况如下:患者为Ⅰ期4例,Ⅱ期18例,Ⅲ期20例和Ⅳ期6例。
2.2 KRAS基因肿瘤组织与血清突变情况 在48个样本中,原发肿瘤组织KRAS突变率40%(19/48),血清42%(20/48)。在19例肿瘤组织样本KRAS突变,14例血清样本中的相同的突变,符合率73.7%(14/19)。突变位点位于相同密码子。9例KRAS突变情况的不一致(27.8%),其中5例在肿瘤组织中KRAS突变但血清中为野生型, 4例血清中KRAS基因突变但组织中为野生型。肿瘤组织和血液样本KRAS突变率之间的一致性较高(κ= 0.60),分别行ⅠⅡ期、Ⅲ期、Ⅳ期KRAS基因组织与血清突变符合率比较,突变符合率与分期无关。见表1、2。
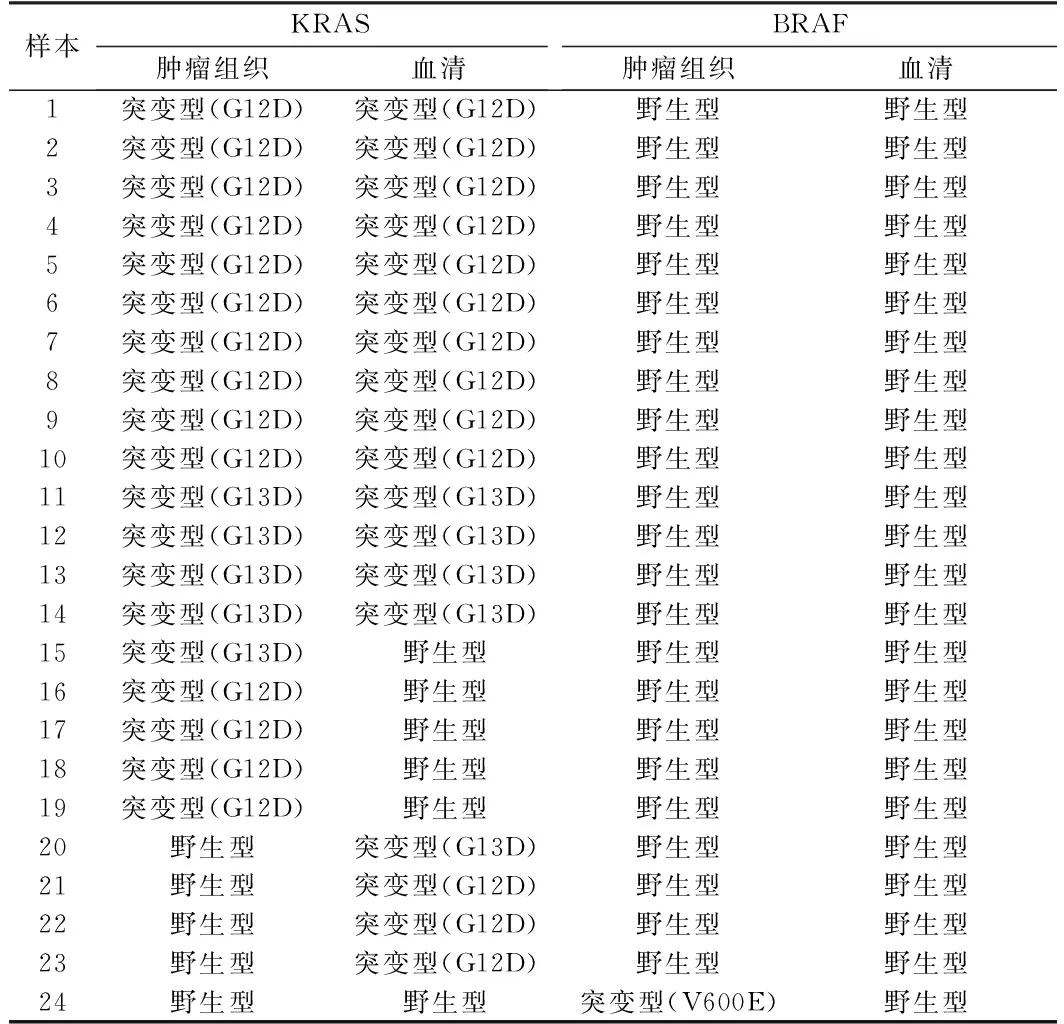
表1 KRAS/BRAF基因在组织与血清表达情况
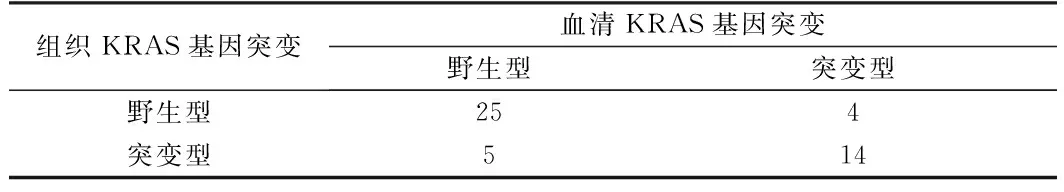
表2 血清和原发肿瘤KRAS突变统计分析(kappa=0.60)
2.3 BRAF肿瘤组织和血清突变情况 在1个肿瘤组织检测到BRAF基因突变,占2%(1/48),在血清样本中未发现BRAF基因突变,考虑到基因表达率低,此次研究样本量少,故未行统计分析。
3 讨论
KRAS基因突变是结直肠癌发展过程中早期常见事件。大约35%~45%的人类肿瘤细胞中出现KRAS基因突变[4],并且KRAS基因活化在肿瘤发生中可能作为启动事件。既往研究报道可在血液中检测到肿瘤细胞[5,6],邹江等[7]用PCR-RFLP法检测结直肠癌患者血浆和癌组织的KRAS基因突变,结果表明组织与血浆间有很好的一致性。
BRAF和KRAS同属MAP激酶(MAPK)通路成员,分为ARAF、BRAF、CRAF三个亚型,而BRAF在3个亚型中突变频率最高, 大约7%~8%的人类肿瘤发生BRAF突变[8], 主要发生于结肠癌、黑色素瘤和甲状腺癌中。该突变导致下游MEK-ERK 信号通路持续激活, 对肿瘤的生长增殖和侵袭转移至关重要, 是抗黑色素瘤等V600E 突变肿瘤的有效作用靶标之一。2011年,首个BRAFV600E 靶向抑制剂威罗菲尼被FDA 批准上市, 用于治疗BRAFV600E 突变的晚期黑色素瘤患者[9], BRAF和KRAS突变是相互排斥的。在这项研究中,只有1例患者检测到BRAF基因突变发生在野生型KRAS患者中。
既往研究表明,血清游离DNA可能来源于细胞凋亡或坏死的肿瘤细胞释放在血清中。另一个可能的机制是,游离循环DNA是由活细胞主动释放[10]。因此他是利用血清检测来预测组织基因突变的理论基础,因临床工作中部分病人病理组织不能获取,而血清取得方便性,如通过试验研究两者之间有高度一致性,则KRAS/BRAF基因突变的检测可能是由血清标本中的基因突变的检测取代。
在本研究中,我们首先评估了血清样品中KRAS和BRAF基因突变之间的一致性程度,KRAS基因突变在组织与血清中(K=0.60)存在一致性,故由此可推荐对于不能获取组织的患者可通过血清检测来替代。因BRAF突变率低,血清中未发现突变,未行统计分析。
本研究中基因突变率组织与血清并不完全一致,可能与循环DNA或转移组织与原发肿瘤存在异质性有关[10]。另一种可能性是肿瘤组织基因检测因取材局限性,所以并不能反映肿瘤的整体基因情况;此外,释放的DNA的血浆被稀释,检测技术的敏感性等都有可能妨碍了血浆DNA突变情况检测准确性。
通过此研究,我们已经证明循环KRAS突变的血清和原发性大肠癌的肿瘤一致。我们认为血浆KRAS基因突变情况可以反映结直肠癌肿瘤组织的KRAS基因突变情况,为检测肿瘤靶点提供新的检测方法。也为无法取得病理组织患者带来新的治疗希望,此研究不足之处在于样本量偏少,希望能扩大研究样本量,进一步的临床试验,并能基于血清基因突变情况开展靶向治疗研究。
1 Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008.Int J Cancer,2010,127: 2893-2917.
2 Loupakis F, Ruzzo A, Cremolini C, et al.KRAS codon 61, 146 and BRAF mutations predict resistance to cetuximab plus irinotecan in KRAS codon 12 and 13 wild-type metastatic colorectal cancer.Br J Cancer,2009,101:715-721.
3 Di Fiore F, Charbonnier F, Lefebure B,et al.Clinical interest of KRAS mutation detection in blood for anti-EGFR therapies in metastatic colorectal cancer.Br J Cancer,2008,99:551-552.
4 Plesec TP,Hunt JL.KRAS mutation testing in colorectal cancer.Adv Anat Pathol,2009,16:196-203.
5 Stroun M,Anker P,Maurice P,et al.Neoplastic characteristics of the DNA found in the plasma of cancer patients.Oncology,1989,46:318-322.
6 Goebel G,Zitt M,Zitt M,et al.Circulating nucleic acids in plasma or serum (CNAPS) as prognostic and predictive markers in patients with solid neoplasias.Dis markers,2005,21:105-120.
7 邹江,钱家鸣,李晓,等.血浆K-ras基因突变检测在结肠癌诊断中的意义.中华肿瘤内科杂志,2002,22:371-373.
8 Cutler RE, Jr Stephens RM, Saracino MR, et al.Autoregulation of the Raf-1 serine/threonine kinase.Proc Natl Acad Sci USA,1998,95:9214-9219.
9 Vultur A, Villanueva J, Herlyn M.Targeting BRAF in advanced melanoma: a first step toward manageable disease.Clin Cancer Res, 2011, 17: 1658-1663.
10 Pathak AK, Bhutani M, Kumar S, et al.Circulating cell-free DNA in plasma/serum of lung cancer patients as a potential screening and prognostic tool.Clin Chem,2006,52:1833-1842.
10.3969/j.issn.1002-7386.2014.07.037
050031 石家庄市,河北医科大学第一医院肿瘤科
安永辉,050031 河北医科大学第一医院肿瘤科;
E-mail:sjzyhd@vip.sina.com
R 735.3
A
1002-7386(2014)07-1048-03
2013-11-14)
