低氧诱导因子1-α的表达及DNA结合活性在非小细胞肺癌中的临床意义
2014-08-28潘坤张泽明赵学琴冯欣
潘坤 张泽明 赵学琴 冯欣
·论著·
低氧诱导因子1-α的表达及DNA结合活性在非小细胞肺癌中的临床意义
潘坤 张泽明 赵学琴 冯欣
目的探讨非小细胞肺癌患者肺组织中HIF-1α的表达及DNA结合活性的动态变化与肿瘤病理学特性的关系。方法收集89例非小细胞肺癌患者肿瘤及癌旁正常肺组织标本,RT-PCR检测HIF-1α的mRNA表达水平,Western blot检测HIF-1α的蛋白质表达水平,EMSA法检测HIF-1α DNA结合活性的表达变化,并结合临床及病理特征进行分析。结果HIF-1α mRNA及蛋白的表达水平在肿瘤组织中均明显高于癌旁组织,差异有统计学意义(P<0.05)。HIF-1α的表达与非小细胞肺癌病理分期及有无淋巴结转移有关。肿瘤组HIF-1α 的DNA结合活性较癌旁正常组织增高,2组间差异有统计学意义(P<0.05)。结论HIF-1α的高表达及转录活性的增强与非小细胞肺癌发病密切相关,可将此作为抑制肿瘤发病的靶点。
非小细胞肺癌;低氧诱导因子-1α;DNA结合活性
肺癌是恶性肿瘤中发病率和死亡率增长最快的,其中67%左右为非小细胞肺癌(non-smαll-cell lung cαncer, NSCLC),其恶性度高,转移早,严重危害人类健康。经研究证实,恶性肿瘤发生的一个典型特点是细胞的过度增殖及血管生成,而细胞增殖会消耗大量氧气,所以实体肿瘤微环境的基本特征之一是低氧。目前已证实低氧诱导因子1-α (hypoxiα inducible fαctor 1 αlph, HIF-1α) 大量表达于人体多种肿瘤中,参与了肿瘤的生长繁殖、远处转移、血管生成、细胞凋亡等[1,2],因此,HIF-1α 的表达可能是肿瘤进展过程中的早期信号,其表达变化可能在一定程度上能反应疾病的进展及分期。HIF-1α可以调节多种靶基因参与肿瘤的生成,其与靶基因结合活性的变化可能也参与了疾病的发生发展过程。本实验通过检测89例非小细胞肺癌患者及癌旁正常对照肺组织中的HIF-1α表达水平及DNA结合活性的变化,分析HIF-1α在非小细胞肺癌患者中与肿瘤淋巴结转移、临床分期等生物学特性的关系。
1 资料与方法
1.1 一般资料 本研究选取我院2010年7月至2012年4月经手术切除的并经病理确诊的非小细胞肺癌患者为研究对象,收集89例患者肺癌组织、癌旁正常肺组织(距离肿瘤边缘>5 cm以上)标本进行试验。所选患者术前均未行化疗、放疗、介入及中医中药等抗肿瘤治疗,有完整的病例资料。其中男54例,女35例;年龄37~64岁,平均年龄58岁。其中有淋巴结转移组51例,无淋巴结转移组38例;TNM:Ⅰ期26例,Ⅱ期34例,Ⅲ期29例。临床分期标准:按照第七版美国联合癌症分类委员会(AJCC)和国际抗癌联盟(UICC)制订的TNM分期标准分类。Western blot检测所用的肿瘤肺组织及癌旁正常肺组织切除后立即置于-70℃冰冻保存。
1.2 实验方法 RT-PCR:使用由上海生物工程公司合成的扩增引物,严格按照该公司TRIZOL试剂使用说明书进行试验,提取总RNΑ,逆转录之后行PCR,得到RT-PCR产物后应用琼脂糖凝胶电泳,对扩增产物条带行吸光度半定量分析。反应循环参数:94℃预变性5 min,94℃变性30 s,56℃退火30 s,72℃延伸60 s,32循环后72℃延伸10 min。检测基因HIF-1α和内参照物β-αctin的引物序列分别为:HIF-1α (433 bp)上游:5’-GCCCCTΑCTΑTGTCGCTTTC-3’,下游:5’-GGCCCΑΑΑCTΑΑΑCTΑTCTGΑ-3’;β-αctin(635bp)上游:5’-CCTΑΑGGCCΑΑCCGTGΑΑ-3’,下游:5’-CTΑGGΑGCCΑGGGCΑGTΑΑTC-3’。
Western blot:0.1 g肺组织剪碎加入RIPΑ 裂解液,冰浴匀浆,4℃ 10 000 g离心,将沉淀去除后得到肺组织总蛋白,将蛋白样本稀释成相等浓度分装,置于- 80℃冰冻保存。实验时使用微量进样器将等量蛋白质样本加至7.5%SDS-丙烯酰胺凝胶孔中,采用200 V电压电泳,转印至硝酸纤维膜,室温下5%脱脂奶粉封闭2 h,加入一抗(1∶1 000)过夜孵育,TBST缓冲液漂洗后加入二抗(1∶2 000)室温杂交1 h,充分漂洗后化学发光试剂盒胶片曝光,对扩增产物条带吸光度行半定量分析。
电泳迁移率实验(EMSA):应用Lighshift化学发光EMSA试剂盒、核蛋白和胞质蛋白抽提试剂盒进行操作(均购自Pierce公司),参照说明书进行试验,双链寡核苷酸片段如下( 5’-AGCTTGCCCTACGTGCTGTCTCAG-3’)[3],应用生物素进行标记,能够与HIF-1α特异性结合。试验中设空白对照组及特异性竞争组,空白对照组为反应体系中不加细胞核提取物,特异性竞争组为加入100倍浓度的未标记的HIF-1α一致性双链寡核苷酸序列。
1.3 结果评定 应用上海Tαnon Gis-2010图像分析系统对Western blot、RT-PCR产物条带行半定量分析,计算目的条带与内参照β-αctin的吸光度比值,同时对EMSA活性结果行光密度分析,计算半定量值。
2 结果
2.1 HIF-1α mRNA及蛋白在非小细胞肺癌组织中的表达及二者与肺癌病理特征的关系 RT-PCR及Western blot结果显示,HIF-1α的mRNA和蛋白含量在NSCLC组织中的表达明显高于癌旁正常肺组织,差异有统计学意义(P<0.05),同时HIF-1α的表达在肿瘤不同分期间差异亦有显著性,随疾病临床分期进展表达呈递增趋势。在有淋巴结转移组HIF-1α的mRNA和蛋白含量表达均明显高于无淋巴结转移组,2组比较差异有统计学意义(P<0.05)。见表1、2。
表1 对照组及不同病理分期各组间HIF-1α mRNA和蛋白比较
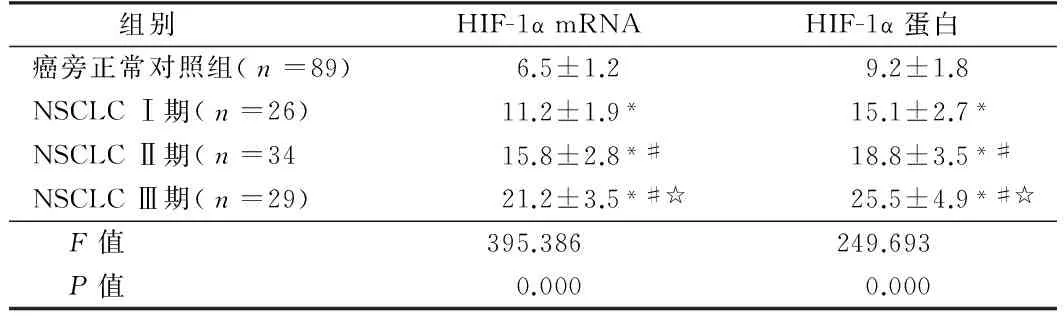
表1 对照组及不同病理分期各组间HIF-1α mRNA和蛋白比较
组别HIF-1αmRNAHIF-1α蛋白癌旁正常对照组(n=89)6.5±1.29.2±1.8NSCLCⅠ期(n=26)11.2±1.9*15.1±2.7*NSCLCⅡ期(n=3415.8±2.8*#18.8±3.5*#NSCLCⅢ期(n=29)21.2±3.5*#☆25.5±4.9*#☆ F值395.386249.693 P值0.0000.000
注:与正常组比较,*P<0.05;与Ⅰ期比较,#P<0.05;与Ⅱ期比较,☆P<0.05
表2 对照组及有无淋巴结转移组间HIF-1α mRNA和蛋白比较

表2 对照组及有无淋巴结转移组间HIF-1α mRNA和蛋白比较
组别HIF-1αmRNAHIF-1α蛋白癌旁正常对照组(n=89)6.5±1.29.2±1.8无淋巴结转移组(n=38)13.6±2.1*16.4±3.1*有淋巴结转移组(n=51)18.7±3.9*#20.9±4.2*#F值419.544270.003P值0.0000.000
注:与正常组比较,*P<0.05;与无转移组比较,#P<0.05
2.2 HIF-1α的DNA结合活性在非小细胞肺癌组织中的表达 EMSA试验中,空白对照组、特异性竞争组、癌旁组织及肿瘤组织组各样本图像结果显示(图1),空白对照组仅有自由带,无结合带,特异性竞争组中亦无结合带,提示探针与HIF-1α的结合是特异性的。在癌旁组织及肿瘤组织中,图像显示出了深浅不一的DNA-蛋白质结合带。癌旁组织HIF-1α的DNA结合活性水平较低,肿瘤组织HIF-1α的DNA结合活性迅速升高,与对照组比较差异有显著性意义,但q检验提示,HIF-1α的DNA结合活性与病理分期、有无淋巴结转移无关。
3 讨论
在全球范围内肺部肿瘤是严重危害人类健康的主要恶性肿瘤,按病理类型分类以非小细胞肺癌为主,由于非小细胞肺癌患者在早期并无典型症状,约为三分之二的患者确诊时已处于疾病晚期,同时失去了最佳治疗时机。目前在我国非小细胞肺癌的治疗仍以传统的手术治疗、全身或局部化疗、放疗为主,但非小细胞肺癌Ⅰ期患者即使是经手术完全切除的,术后2年的复发或转移率也超过40%。因此,探讨新的非小细胞肺癌治疗方法已成为当前肿瘤治疗领域的热点及难点。
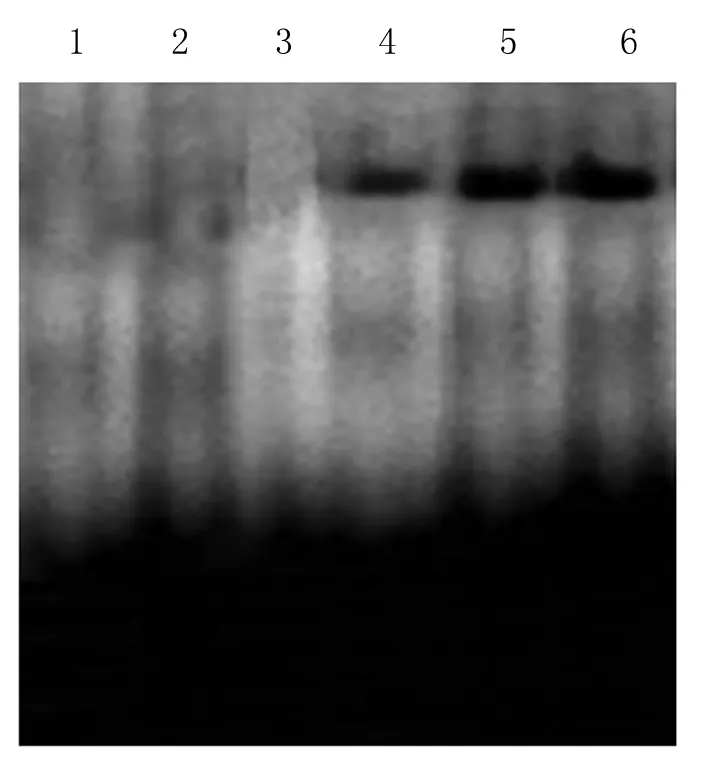
图1 EMSA检测HIF-1α的DNA结合活性
低氧诱导因子-l (hypoxiα inducible fαctor 1, HIF-1)是异源二聚体转录因子,由α和β两个亚基组成,α亚基是功能亚基,被称为氧感受器。HIF-1α能调节参与糖酵解、红细胞增生、细胞增殖、血管生成等共100多种低氧适应性基因的转录水平[4],因此,其结合活性及蛋白含量的变化均可引起相应目标基因的表达变化进而导致相应疾病,它可诱导靶基因转录激活,在调节肿瘤血管生成、侵袭转移及耐药等方面发挥重要作用[5]。大部分学者经研究发现,HIF-1α的表达与非小细胞肺癌临床分期、淋巴转移有关,而与病理类型、分化程度等无关[6-8],另有学者则持相反意见,认为HIF-1α的表达与淋巴转移无关[9]。目前国内针对此因子的研究多应用免疫组化及原位杂交等试验方法,定量研究较少。本实验通过RT-PC、Western blot来研究非小细胞肺癌患者中HIF-1α的表达水平,同时应用EMSA研究HIF-1α DNA结合活性的变化,探讨其与肿瘤临床生物学特性的关系
本试验通过各肿瘤组与对照组的数据对比,发现在对照组癌旁正常肺组织中,HIF-1α蛋白及DNA结合活性均有一定表达,提示在正常肺组织中HIF-1α对其下游目标基因的调节作用也是存在的。非小细胞肺癌患者Ⅰ期、Ⅱ期、Ⅲ期肿瘤组织的HIF-1α的mRNA和蛋白含量均呈递增趋势,各组与对照组比较差异均有显著性意义,同时肿瘤组各组间HIF-1α的mRNA和蛋白含量比较差异亦有显著性,提示HIF-1α量的表达变化在一定程度上可反应疾病的进展程度。在有淋巴结转移组,HIF-1α亦表现出了高表达趋势,与无淋巴结转移组比较差异有显著性意义,提示HIF-1α在一定程度上可反应疾病的预后。Hung等[10]研究发现,HIF-1α可通过上调靶基因TWIST1和Snail表达水平在非小细胞肺癌的增殖、侵润、转移中发挥作用,TWIST1和Snail的高表达导致了肺癌患者更短的生存期及更快的复发。Karetsi等[11]发现HIF-1α可上调目标基因VEGF的表达在肿瘤血管生长中发挥作用。同时亦有学者发现,在人肺腺癌细胞株中HIF-1α可通过上调抗凋亡基因Survivin的表达,进而参与调控细胞周期和细胞凋亡[12],在恶性肿瘤的发展中发挥作用。另有研究表明, HIF-1α可促使肿瘤组织血管发生,增加肿瘤远处侵袭、加速转移,降低肿瘤对放、化疗的敏感性[13]。上述结果均提示,HIF-1α可能在非小细胞癌的发生、转移中发挥作用,其表达水平的变化在一定程度上可反应疾病的进展程度及预后。
HIF-1α通过与目标基因特定序列DNA结合进而调控它们的转录及表达[14],因此,HIF-1α与目标基因DNA结合能力的大小在一定程度上可决定其对靶基因的调控能力。本实验发现,肿瘤组HIF-1α的DNA结合活性较对照组明显增强,提示在肿瘤组织中不仅增加的蛋白含量在肿瘤生长中发挥了一定作用,增强的DNA结合活性亦增强了对靶基因的转录作用。HIF-1α的DNA结合活性在肿瘤各组间未发现有表达差异,在有淋巴结转移及无淋巴结转移组间亦未发现显著性意义,提示HIF-1α可能在肿瘤组织中通过增强对靶基因的调控进而促进恶性肿瘤新生血管形成、加速肿瘤浸润,但其与靶基因的DNA结合能力不能反应疾病的进展程度及预后。在临床应用中,可考虑通过分子水平抑制HIF-1α与靶基因DNA序列结合,进而在抑制肿瘤发生发展中发挥作用。
综上所述,HIF-1α在肺部肿瘤细胞的表达增加表现在多个方面,包括基因转录水平和蛋白表达水平,同时其与靶基因的结合活性亦呈增高趋势,上述各因素共同作用增加了对肿瘤细胞的供血、供氧及能量,使癌细胞得以迅速增殖和浸润。因此,研究如何降低HIF-1α的表达及DNA结合能力对于非小细胞癌的治疗及改善预后具有重要的临床意义。
1 Semenza GL.Targeting HIF-1 for cancer therapy.Nature Reviews.Cancer,2003,3: 721-732.
2 Yohena T.Upregulation of hypoxia-inducible factor-1alpha mRNA and its clinical significance in non-small cell lung cancer.Journal of Thoracic Oncology,2009,4: 284-290.
3 Buchler P,Howard A,Reber E,et al.Antiangiogenic activity of genistein in pancreatic carcinoma cells is mediated by the inhibition of hypoxia-inducible factor-1 and the down-regulation of VEGF gene expression.Cancer,2004,100:201-210.
4 刘衡.HIF-1与肺癌关系研究新进展.医学综述,2012,18:3957-3959.
5 刘登辉,刘红光.HIF-1α和VEGF在乳腺癌中作用的研究进展.肿瘤药学,2013,3:7-12.
6 Chen Y,Yang H,Hu J,et al.Expression of hypoxia inducible factor-1alpha and relationship thereof to apoptosis related protein in non-small cell lung cancer.Zhonghua yi xue za zhi,2007,87:921-923.
7 吴新天,周韶璋,莫娟梅,等.HIF-1α、VEGF和TGF-β1在非小细胞肺癌中的表达及其临床意义.中国癌症防治杂志,2013,27:46-49.
8 Wu K,Chuen S,Chiao L,et al.Association of hypoxia inducible factor-1α polymorphisms with susceptibility to non-small-cell lung cancer.Translational Research : the Journal of Laboratory and Clinical Medicine,2012,159:42-50.
9 Xia S,Yu S,Xiang L.Expression of Hypoxia Inducible Factor 1α and Its Significance in Non-small Cell Lung Cancer.The Chinese-German Journal of Clinical Oncology,2005,4:284-286.
10 Hung JJ,Yang MH.Prognostic significance of hypoxia-inducible factor-1alpha,TWIST1 and Snail expression in resectable non-small cell lung cancer.Thorax,2009,64:1082-1089.
11 Karetsi E,Maria G,Ioannou,et al.Differential expression of hypoxia-inducible factor 1α in non-small cell lung cancer and small cell lung cancer.Clinics,2012,67: 1373-1378.
12 李伟,陈余清,孙艳,等.人肺腺癌细胞株A549中HIF-1α对Survivin的表达调控.中国癌症杂志,2011,21:427-434.
13 Yoon SY,Reum H,Lee,et al.Thymosin β4 expression correlates with lymph node metastasis through hypoxia inducible factor-α induction in breast cancer.Oncology Reports,2011,25:23-31.
14 Jeong JK,Moon M.Hypoxia inducing factor-1alpha regulates tumor necrosis factor-related apoptosis-inducing ligand sensitivity in tumor cells exposed to hypoxia.Biochemical and Biophysical Research Communications,2010,399: 379-383.
The clinical significance of expression and DNA binding activity of hypoxia-inducible factor 1-α in non-small cell lung cancer
PANKun,ZHANGZeming,ZHAOXueqin,etal.DepartmentofRespiratoryMedicine,AffiliatedHospitalofHebeiUniversity,Hebei,Baoding071000,China
ObjectiveTo observe the dynamic changes of expression and DNA binding activity of hypoxia-inducible factor 1-α in non-small cell lung cancer (NSCLC),and to investigate the correlation between the changes and tumor pathological characteristics.MethodsEighty-nine cases of NSCLC tissues and adjacent normal lung tissue specimens were collected,RT-PCR was used to detect the expression levels of HIF-1α mRNA,and Western Blot was used to determine the expression levels of HIF-1α protein.EMSA assay was used to examine DNA binding activity of HIF-1α.The correlation between the expression levels and the clinical pathological features of tumors was analyzed.ResultsThe expression levels of HIF-1α mRNA and protein in tumor tissues were significantly higher than those in adjacent tissues (P<0.05).Their expression levels were correlated with tumor staging and lymph node metastasis (P<0.05).HIF-1α DNA binding activity was significantly increased,as compared with that in adjacent normal tissue (P<0.05).ConclusionThe overexpression of HIF-1αand enhancement of transcription activity are closely correlated to pathogenesis of NSCLC,which can be regarded as a target in inhibiting pathogenesis of NSCLC.
non-small cell lung cancer;hypoxia-inducible factor 1-α;DNA binding activity
10.3969/j.issn.1002-7386.2014.07.003
071000 河北省保定市,河北大学附属医院呼吸内科
R 734.2
A
1002-7386(2014)07-0972-04
2013-10-20)
