口服三苯氧胺对子宫内膜的影响
2014-08-28欧新辉范元春
欧新辉 范元春
·论著·
口服三苯氧胺对子宫内膜的影响
欧新辉 范元春
目的通过比较口服三苯氧胺(TAM)对于患者子宫内膜病变发生的影响及检测子宫内膜中子宫内膜血管内皮生长因子-A(VEGF-A)、血管生成素-2(ANG-2)、缺氧诱导因子-1(HIF-1)的表达,研究口服TAM对子宫内膜的影响。方法试验组为80例乳腺癌患者口服TAM(均满1年)后出现阴道不规则出血、子宫内膜增厚或质地不均(B超提示),行宫腔镜检查并电切取其子宫内膜送病理检查。另外取同期就诊的120例以上述症状就诊的未口服TAM的患者作为对照组,也行宫腔镜检查并电切取其子宫内膜送病理检查。比较其子宫内膜病变的发生有何差异。选取实验组及对照组中子宫内膜病变(包括:子宫内膜息肉、子宫内膜不典型增生、子宫内膜癌)的患者。应用SP免疫组织化学方法检测VEGF-A、ANG-2、HIF-1在实验组(TAM组)和对照组中的蛋白表达,并对比口服TAM对于子宫内膜的影响及相互关系。结果术后病理证实:TAM组:子宫内膜单纯性增生及复杂性增生40例(50%),不典型增生9例(11.25%),子宫内膜息肉样增生22例(27.5%),子宫内膜癌4例(5%),黏膜下肌瘤5例(6.25%)。对照组:子宫内膜单纯性增生及复杂性增生80例(66.7%),不典型增生8例(6.67%),子宫内膜息肉样增生25例(20.8%),子宫内膜癌3例(3.75%),黏膜下肌瘤4例(2.5%)。TAM组中子宫内膜病变(子宫内膜息肉、不典型增生、子宫内膜癌)的发生率为43.75%,明显高于对照组的30%(χ2=3.963,P<0.05)。免疫组化的检测显示出:VEGF-A、ANG-2、HIF-1在TAM组和对照组中均有表达,只有子宫内膜息肉样增生组织在TAM组与对照组中的表达有统计学意义(P<0.05)。不典型增生组织和子宫内膜癌组织中三种蛋白的表达在不同组中的比较差异无统计学意义(P>0.05)。结论乳腺癌患者术后长期口服三苯氧胺增加了子宫内膜息肉、子宫内膜不典型增生及子宫内膜癌等病变的发生率;口服三苯氧胺增加了VEGF-A、ANG-2、HIF-1三种蛋白在子宫内膜息肉样增生中的发生率。
子宫内膜;血管内皮生长因子A;血管生成素2;缺氧诱导因子-1;三苯氧胺
三苯氧胺(TAM)是最早用于乳腺癌辅助内分泌治疗的药物[1],现已广泛应用与各期乳腺癌术后的辅助治疗,在预防乳癌的复发和缓解病情上起重要作用。TAM是一种选择性雌激素受体调节剂,通过与体内的雌激素竞争性结合雌激素受体(ER)发挥作用[2],从而起到抗雌激素的作用,但是TAM同时具有弱的雌激素作用。TAM的抗雌激素作用可以治疗乳腺癌和晚期子宫内膜癌,同时其类雌激素作用也可以使子宫内膜细胞增生,子宫内膜增生,进一步刺激可以导致子宫内膜不典型增生甚至癌变可能。目前子宫内膜病变的发生机制尚不明了,其中许多学者达到一个共识:即无孕激素拮抗的单纯雌激素的长期刺激增加了子宫内膜癌的发生风险。子宫内膜血管内皮生长因子-A(VEGF-A)、血管生成素-2(ANG-2)、缺氧诱导因子-1(HIF-1)三种因子在肿瘤血管的形成中起到重要作用,本研究通过比较口服TAM对于患者子宫内膜病变发生的影响及检测子宫内膜中子VEGF-A、ANG-2、HIF-1的表达,研究口服TAM对子宫内膜的影响及探讨三苯氧胺致子宫内膜癌变的机制,以指导三苯氧胺的临床应用,以及为子宫内膜癌的预防和治疗提供新的临床思路。
1 资料与方法
1.1 一般资料 随机选择2010年1月至2013年1月在我院就诊的乳腺癌术后口服TAM患者70例(试验组),口服TAM均为1年以上,用量为20~30 mg/d,平均年龄50.4岁,其就诊原因为阴道不规则出血、子宫内膜增厚或质地不均(B超提示),行宫腔镜检查并电切取其子宫内膜送病理检查。同时选取同期的以上述症状就诊的未服用TAM的120例患者作为对照组,平均年龄49.2岁,同样行宫腔镜检查并电切取其子宫内膜送病理检查。
1.2 试剂 VEGF-A、HIF-1鼠抗人单克隆抗体均购自Santa Cruz Biotechnology公司公司,ANG-2鼠抗人单克隆抗体购自武汉博士德生物有限公司,ER、PR鼠抗人单克隆抗体均购自斯迈特生物有限公司。SP免疫组化试剂盒为北京中衫生物工程有限公司产品。
1.3 实验方法
1.3.1 分组:选取试验组(TAM组)及对照组中子宫内膜病变(包括:子宫内膜息肉、子宫内膜不典型增生、子宫内膜癌)的患者。
1.3.2 免疫组织化学方法检测:VEGF-A、ANG-2、HIF-1采用免疫组化SP法,按照说明操作。石蜡标本5 μm连续切片后,3%双氧水封闭内源性过氧化物酶20 min,经微波炉修复抗原,滴加一抗,4℃孵育过夜,分别滴加二抗。室温放置20 min,链亲和素-过氧化物酶溶液温育30 min(室温),二氨基联苯胺(DAB)显色15 min,苏木素对比染色后,脱水,透明,封片。以PBS代替一抗作为阴性对照。
1.3.3 判定结果的标准:在肿瘤细胞浆或细胞核上VEGF-A、ANG-2、HIF-1分别呈棕黄色为阳性,阳性细胞数<25%为(-),阳性细胞数≥25%且<50%为(+),阳性细胞数≥50%且<75%为(++),阳性细胞数≥75为(+++),将(-)归为阴性组,(+)、(++)和(+++)归为阳性组。先在100倍镜头下随意选取10个视野,然后400倍镜头下在每一视野中连续记数100个癌细胞,记录其中阳性细胞数,计算阳性细胞百分数,取平均值。根据肿瘤细胞染色强度和阳性细胞百分率得分之和评估其基因蛋白的表达阳性率。
1.4 统计学分析 应用SPSS 11.5统计软件,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 口服TAM对子宫内膜病变发生率的影响 TAM组:子宫内膜单纯性增生及复杂性增生40例(50%),不典型增生9例(11.25%),子宫内膜息肉样增生22例(27.5%),子宫内膜癌4例(5%),黏膜下肌瘤5例(6.25%)。对照组子宫内膜单纯性增生及复杂性增生80例(66.7%),不典型增生8例(6.67%),子宫内膜息肉样增生25例(20.8%),子宫内膜癌3例(%),粘膜下肌瘤4例(2.5%)。TAM组中子宫内膜病变(子宫内膜息肉、不典型增生、子宫内膜癌)的发生率为43.75%,明显高于对照组的30%(χ2=3.963,P<0.05)。
2.2 免疫组化结果
2.2.1 2组标本中VEGF-A、ANG-2和HIF-1的阴性对照均无阳性染色,VEGF-A、 ANG-2阳性染色主要位于细胞胞浆,HIF-1阳性染色位于细胞核和(或)细胞浆。
2.2.2 VEGF-A、ANG-2、HIF-1的阳性表达率:TAM组(35例)中VEGF-A、ANG-2、HIF-1的阳性表达率分别为:子宫内膜息肉样增生组织:54.5%、59.1%、45.5%;不典型增生组织:55.6%、66.7%、44.4%;子宫内膜癌组织:50%、75%、50%。对照组(36例)中VEGF-A、ANG-2、HIF-1的阳性表达率分别为:子宫内膜息肉样增生组织:24%、20%、16%;不典型增生组织:75%、62.5%、50%;子宫内膜癌组织:66.7%、66.7%、66.7%。子宫内膜息肉样增生组织在TAM组与对照组中的表达比较,差异有统计学意义(χ2值分别为4.62、7.567、4.854,P<0.05),不典型增生组织和子宫内膜癌组织中三种蛋白的表达在不同组中的比较差异无统计学意义(χ2值分别为0.701、0.194、0.032、0.058、0.052和0.194,P>0.05)。TAM组不同组织的VEGF-A、ANG-2、HIF-1表达比较,差异均无统计学意义(χ2值分别为0.0361、0.4422和0.0361,P<0.05)。见表1。
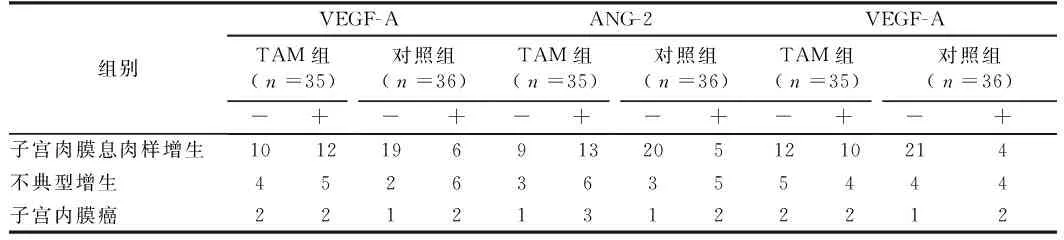
表1 TAM组与对照组中不同组织VEGF-A、ANG-2、HIF-1的阳性表达率 例
3 讨论
子宫内膜癌为女性生殖道常见的恶性肿瘤之一,发达国家中发病率居女性生殖道恶性肿瘤首位,病死率居第二位。在我们国家今年发病率有上升趋势,其中年轻患者有增多趋势。其发病机制尚不明确,即无孕激素拮抗的单纯雌激素的长期刺激增加了子宫内膜癌的发生风险。TAM作为乳癌术后的辅助用药,其对于子宫内膜的影响目前研究不断深入。
TAM广泛应用与乳腺癌术后的患者,它是一种选择性雌激素受体调节剂,通过与体内的雌激素竞争性结合雌激素受体(ER)发挥作用,结合ER后可以使体内能与雌激素结合的ER量减少,从而阻断体内雌激素发挥作用,进而阻断了体内ER的再合成。ER蛋白的作用机体分为两种,分别为:TAF1和TAF2。前者一般处于稳定的状态;而后者需要雌激素激活。TAM发挥作用的机制是:与ER结合后激活了TAF1,但是并不激活TAF2,也因此TAM在抗雌激素的同时具有了弱的雌激素作用[2]。Neven等[3]研究发现,乳癌术后长期服用TAM的患者在服药前后行宫腔镜检查,服用TAM后有4例出现了子宫内膜息肉,1例发生了子宫内膜癌,其中7例已经萎缩的内膜显示了轻度增生。Hann等[4,5]研究均发现了绝经后的乳腺癌患者长期服用TAM后其子宫内膜发生了改变,其增生较前活跃甚至进展为子宫内膜息肉或者子宫内膜癌。本研究中也证实长期口服TAM(1年及以上)的乳腺癌患者其子宫内膜息肉、子宫内膜不典型增生和子宫内膜的发生率较对照组升高。因此,口服三苯氧胺的乳癌患者应定期检测子宫内膜,发现病变即时处理。
研究表明,肿瘤的发生发展都与新生血管的生成密切相关[6]。VEGF具有强的促血管生成的能力,可以促进血管内皮细胞的分裂和增生,同时可以增强毛细血管的通透性,被认为是机体中促肿瘤血管生成中的“泰斗”[7],通常人们所谓的VEGF-A即为VEGF,是目前惟一特异的作用于血管内皮的细胞因子,其作用机制包括:促进内皮细胞的增值和迁移;增加毛细血管的通透性,为内皮细胞的血管的生长提供营养支持;可以促进细胞外基质的降解,促进血管的生成。其表达受多种因素的调控。如想了解其调控机制需要进一步研究。
另外一个与血管生成密切相关的家族是促血管生成素(ANG)家族,是目前已知的独特的血管生成因子,其具有核糖核酸活性。包括四个成员:ANG-1,ANG-2,ANG-3,ANG-4。其中ANG-2在家族中其重要作用,ANG-2的表达是肿瘤血管生成及发展的促进因素,与肿瘤血管数目、肿瘤分期和患者的预后密切相关[8]。研究发现,ANG与膀胱癌[9]、急性白血病[10]、肾癌[11]的发生发展关系密切。在妇科肿瘤中的研究也引起了大家的关注。
瘤组织不同于正常组织的较为特异的改变是肿瘤中大多存在着缺氧的微环境[12]。缺氧诱导因子-1(HIF-1)在缺氧条件下能激活多种基因,从而维持人类在缺氧条件下继续生存。肿瘤在缺氧状态下可以引起一些列的反应,为其继续在机体生存创造条件[13],HIF-1在这一过程中发挥着重要作用[14,15],它调控着细胞对微环境的适应状态,其表达对于促进肿瘤细胞的代谢、增值和生长有重要的意义。VEGF-A和H-F-1共同起着调控肿瘤血管生成的作用,缺氧条件下可以上调VHGF-A的表达[16]。
VEGF-A和HIF-1在前列腺癌、黑色素瘤和肝癌形成中,对血管生成的促进作用已经有研究[17-21]。但是VEGF-A、ANG-2、HIF-1三者在妇科肿瘤尤其是子宫内膜癌中的研究还不多,本研究表明:在对照组中,三者的阳性表达率为:子宫内膜息肉样增生组织:24%、20%、16%;不典型增生组织:75%、62.5%、50%;子宫内膜癌组织:66.7%、66.7%、66.7%,而在TAM组,三者的阳性表达率为:子宫内膜息肉样增生组织:54.5%、59.1%、45.5%;不典型增生组织:55.6%、66.7%、44.4%;子宫内膜癌组织:50%、75%、50%。经统计后发现,服药组的三者的表达率在子宫内膜息肉样增生组有明显升高,其余2组变化不明显。我们预期估计三者的表达在不同组织中是有变化的,但是结果显示不明显可能与不典型增生组织和子宫内膜癌组织样本量小有关,还需进一步扩大样本量继续研究。
我们的研究最终还是要归于临床,该实验提示我们在对乳腺癌患者术后长期口服三苯氧胺的患者随访中,应密切监测其子宫内膜变化,宫腔镜作为现在成熟的腔镜技术在诊断和治疗上有很重要的意义。同时,大量研究发现VEGF-A、ANG-2、HIF-1在肿瘤血管的形成及发展中起了促进的作用,我们可以设法降低其表达,以遏制病变的进展。
乳腺癌患者术后长期口服三苯氧胺增加了子宫内膜息肉、子宫内膜不典型增生及子宫内膜癌等病变的发生率。口服三苯氧胺增加了VEGF-A、ANG-2、HIF-1三种蛋白在子宫内膜息肉样增生中的发生率。
1 丁小文.乳腺癌新辅助内分泌治疗研究进展.国际肿瘤学杂志,2006,33:38-41.
2 Yang MT,Lian ZQ.Advancement in endocrine therapy for breast cancer.Chinese Journal of Cancer,2007,26:440-444.
3 Neven P,De Muylder X,Van Belle Y,et al.Hysteroscopic follow-up during tamoxifen treatment.Eur J Obstet Gynecol Reprod Biol,1990,35: 235-238.
4 Hann LE,Giess CS,Bach AM,et al.Endometrial thickness in tamoxifen-treated patients:correlation with clinical and pathologic findings.AJR,1997,168:657-661.
5 Marconi D,Exacoustos C,Cangi B,et al.Transvaginal sono graphic and hysteroscopic findings in postmenopausal women receiving tamoxifen.Am Assoc Gynecol Laparosc,1997.4:331-339.
6 Folkman J.Role of angiogenesis in tumor growth and metastasis.Semin Oncol,2002,29:15-18.
7 Fong GH,Rossant J,Gertsenstein M,et al.Role of the Flt-1 receptor tyrosine kinase in regulating the assembly of vascular endothelium.Nature,1995,376:66-70.
8 Ahmad SA,Liu W,Jung YD,et al.The effects of angiopoietin-1 and-2 on tumor growth and angiogenesis in human colon cancer.Cancer Res,2001,61:1255-1259.
9 Oka N,Yamamoto Y,Takahashi M,et al.Expression of angiopoietin-1 and-2,and its clinical significance in human bladder cancer.BJU Int,2005,95:660-663.
10 Loges S,Heil G,Bruweleit M,et al.Analysis of concerted expression of angiogenic growth factors in acute myeloid leukaemia:expression of angiopoietin-2 represents an independent prognostic factor for overall survival.J Clin Oncol,2005,23:1109-1117.
11 Maruyama E,Sakamoto T,Azuma H,et al.Involvement of angiopoietins in cancer progression in association with cancer cellfibroblast interaction.Anticancer Res,2005,25:171-177.
12 Sutherland RM.Tumor hypoxia and gene expression-implications for malignant progression and therapy.Acta Oncol,1998,37:567-574.
13 Semenza GL.Hypoxia-inducible factor 1:control of oxygen homeostasisin health and disease.Pediatr Res,2001,49:614-617.
14 Semenza GL,Agani F,Booth G,et al.Structural and functional analysis of hypoxia-inducible factor 1.Kidney Int,1997,51:553-555.
15 Wang GL,Jiang BH,Rue EA,et al.Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension.Proc Natl Acad Sci USA,1995,92:5510-5514.
16 Lee JS,Kim HS,Jung JJ,et al.Expression of vascular endothelial growth factor in adenocarcinomas of uterine cervix and relation to angiogenesis and P53 and c-erbB-2 protein expression.Gynecol Oncol,2002,85:469-471.
17 胡正茂,刘志苏,袁玉峰.Ang2、HIF-1α及VEGF在肝细胞癌中的表达及其临床意义腹部外科,2007,20:53-54.
18 Iervolino A,Trisciuoglio D,Ribatti D,et al.Bcl-2 overexpression in human melanoma cells increases angiogenesis through VEGF mRNA stabilization and HIF-1-medicated transcriptional activity.FASEB J,2002,16:1453-1455.
19 Choi KS,Bae MK,J eong JW,et al.Hypoxia-induced angio-genesis during carcinogenesis.J Biochem Mol Biol,2003,36:120-127.
20 Boddy JL,Fox SB,Han C,et al.The androgen receptor is significantly associated with vasular endothelial growth factor and hypoxia sensing via hypoxia-inducible factorsHIF-1α,HIF-2α,and the prolyl hydroxylases in human prostate cancer.Clin Canceres,2005,11:7658-7663.
21 Kato H,Yoshikawa M,Miyazaki T,et al.Expression of vascular endot helial growth factor(VEGF)and its receptors (Flt-1 and Flk-1)in esophageal squamous cell carcinoma.Anticancer Res,2002,22:3977-3984.
10.3969/j.issn.1002-7386.2014.07.030
050011 河北省武强县医院妇产科(欧新辉);河北医科大学第四医院妇产科(范元春)
范元春,050011 河北医科大学第四医院妇产科;
E-mail:022402022abc@163.com
R 994.11
A
1002-7386(2014)07-1033-04
2013-10-29)
