乌司他丁对大鼠创伤性脑水肿后NF-κB及IL-1β表达的影响
2014-08-28都义日杜雪江于建设
都义日 杜雪江 于建设
·论著·
乌司他丁对大鼠创伤性脑水肿后NF-κB及IL-1β表达的影响
都义日 杜雪江 于建设
目的通过观察大鼠创伤性脑水肿后脑组织中核转录子-κB(NF-κB)及白介素-1β(IL-1β)的变化,探讨乌司他丁(UTI)在大鼠创伤性脑水肿过程中对脑组织的保护作用及其机制。方法将30只健康成年SD大鼠随机分为正常对照组、创伤性脑水肿组及UTI干预组,每组10只。并于伤后8、24、72采用免疫组化法及血清ELISA法检测脑组织NF-κB和IL-1β的水平。结果创伤性脑水肿组和UTI组脑水肿部位NF-κB的活性和IL-1β的水平均较对照组明显升高(P<0.01),且于24 h达到最高值,于72 h时有所下降;UTI组各时间点与创伤性脑水肿组比较差异均有统计学意义(P<0.01)。结论乌司他丁对大鼠创伤性脑水肿引起的脑损伤具有明显的脑保护作用,通过抑制NF-κB和IL-1β信号传导通路是乌司他丁脑保护作用的重要机制之一。
乌司他丁 ;脑保护;核转录因子-κB;白介素-1β
创伤性脑损伤(traumatic brain injury,TBI)后,在原发的脑损伤的基础上发生于细胞水平上的继发性脑损害可造成难以逆转的神经功能损害。包括兴奋性损害、钙平衡的改变、自由基损害、炎性反应及细胞凋亡等。其中炎性介质是参与许多颅脑损伤后脑水肿形成的重要因素之一。因此,如何通过抑制炎症介质的释放,减轻脑损伤后炎性反应,从而降低神经功能障碍的发生越来越多的受到关注。乌司他丁(Ulinastatin,UTI)作为一种蛋白酶抑制剂,研究表明,UTI可通过抑制NF-κB的活性来抑制炎性介质的释放,从而发挥脑保护作用[1]。本研究通过观察大鼠创伤性脑水肿后脑组织中核转录因子-κB(NF-κB)及IL-1β的变化,探讨UTI在大鼠创伤性脑水肿过程中对脑组织的保护作用及其机制。
1 材料与方法
1.1 实验动物及分组 选择SD大鼠30只,雌雄不拘,体重300~350 g。按照随机数字表分为正常对照组、创伤性脑水肿组及UTI干预组,每组10只。UTI治疗组预先静脉给予5×104U/kg ;其余两组给予等量0.9%氯化钠溶液。
1.2 模型制作 在室温条件下,用戊巴比妥(40 mg/kg)麻醉后,固定于脑立体定向仪上,头顶剪毛,常规消毒。采用Marmarou等[2]创立的自由落体撞击法制作。于大鼠麻醉后,切开头皮,暴露顶骨,以牙科树脂将直径10 mm、厚3 mm的金属头盔牢固粘于顶骨前、后囟之间。以450 g砝码自1.5 m高度自由落下,建立创伤性脑水肿模型。
1.3 指标的测定
1.3.1 脑组织NF-κB的测定:3组分别于伤后8、24、72 h 3个时间点横断大鼠脊髓,取出脑组织并用4%多聚甲醛液固定后,梯度酒精脱水、二甲苯透明、浸焟,常规石蜡包埋,切片。采用免疫组化染色检测NF-κB活性。以水肿部位周围胞浆/胞核中出现棕色颗粒为阳性细胞,并测定阳性细胞的平均光密度值。
1.3.2 大鼠脑组织IL-1β水平测定:3组分别于伤后8、24、72 h3个时间点取0.2 ml脑组织匀浆上清液和血清,采用放射免疫法测定IL-1β。
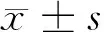
2 结果
2.1 创伤性脑水肿后各组NF-κB活性的影响 创伤性脑水肿组和UTI组脑水肿部位NF-κB的活性较对照组明显升高(P<0.01),且于24 h达高峰,于72 h时有所下降;在观察的时间点里,UTI组各时间点均与创伤性脑水肿组比较差异均有统计学意义(P<0.01)。见表1。
表1 创伤性脑水肿后3组NF-κB活性的变化

表1 创伤性脑水肿后3组NF-κB活性的变化
组别8h24h72h对照组0.057±0.0050.048±0.0060.061±0.007创伤性脑水肿组0.211±0.009*0.343±0.018*0.268±0.012*UTI组0.176±0.007*#0.250±0.010*#0.201±0.009*#
注:与对照组比较,*P<0.01;与创伤性脑水肿组比较,#P<0.01
2.2 创伤性脑水肿后各组IL-1β水平 创伤性脑水肿组和UTI组脑水肿部位IL-1β水平较对照组明显升高(P<0.01),且于24 h达高峰;在观察的时间点里,UTI组各时间点均与创伤性脑水肿组比较差异均有统计学意义(P<0.01)。见表2。
表2 创伤性脑水肿后3组IL-1β水平的变化
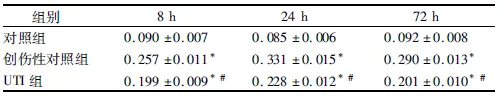
表2 创伤性脑水肿后3组IL-1β水平的变化
组别8h24h72h对照组0.090±0.0070.085±0.0060.092±0.008创伤性对照组0.257±0.011*0.331±0.015*0.290±0.013*UTI组0.199±0.009*#0.228±0.012*#0.201±0.010*#
注:与对照组比较,*P<0.01;与创伤性脑水肿组比较,#P<0.01
3 讨论
脑水肿是过多的水分积聚在脑实质内造成大脑肿胀的疾病,是颅脑损伤后较常见的继发损伤。脑水肿引发的颅内压增高、脑疝将进一步加重神经功能损害,是颅脑损伤后治疗的关键所在。传统治疗方法针对脑水肿主要干预措施是给予甘露醇等脱水或行去骨瓣减压术[3],但均存在不同程度的副作用。为了能够达到靶点治疗的目标,研究人员着力于探讨创伤性脑水肿的发生机制,并寻找到更有效而又副作用少的治疗方法。
研究发现,在创伤性脑损伤后,损伤的部位浸润各种炎性细胞,并分泌大量的炎性细胞因子,继而在炎性细胞因子的作用下:一方面作为保护性机制诱导神经修复和重建的同时炎性细胞因子作为损害因素,进一步加重脑水肿和神经细胞的损害,并引起一系列的级联反应加重神经系统的破坏。创伤性脑水肿的炎性反应由一系列炎性细胞因子参与,其中包括IL-1β、IL-6、IL-8、肿瘤坏死因子(TNF-α)、热休克蛋白(HSP)等。在白介素家族中,IL-1β与脑损伤关系最为密切。IL-1β是单核巨噬细胞合成和分泌的急性炎性因子,它通过促进炎症作用可激活脑内的小胶质细胞,促进白细胞和内皮细胞的黏附而激发炎性反应从而破坏血脑屏障[4]。IL-1β在脑损伤的早期就可以显著升高,介导中性粒细胞向内皮细胞滚动、黏附、渗透并造成脑水肿和急性炎性反应。在创伤性脑损伤后,NF-κB的激活、白介素和TNF-α的表达将共同参与并加重神经系统功能的损害的过程[5,6]。
NF-κB是调控炎性介质释放的细胞内核转录因子。NF-κB是目前发现的与炎症有关的重要转录因子之一,是多种信号传导途径的汇聚点,在调节创伤性脑水肿后炎症反应中诱导多种细胞因子和趋化因子的表达,并对多种关键酶的表达[7]具有重要的调控作用。静息状态下,NF-κB以非共价键结核的方式与其抑制因子I kB相结合,以无活性的形式存在于胞浆。在IL-1β、TNF-α、内毒素等刺激因素作用下被激活后,NF-κB被磷酸化,并被蛋白酶水解,从而使NF-κB进入细胞核内,并开始启动和调控一系列细胞因子和黏附分子的表达[8]。与此同时,由NF-κB调节生成的产物如IL-1β、TNF-α、内毒素等将继续激活 NF-κB,从而形成级联瀑布效应。越来越多的研究证实NF-κB的激活是炎性介质释放后炎症反应失控的重要步骤[7-9]。因此,如何抑制NF-κB的激活成为阻止炎性反应发生并引起一系列脑损伤的治疗关键所在。
目前研究表明,如何在早期抑制细胞因子和有害物质的生成是治疗颅脑损伤的重点[8]。乌司他丁(UTI)作为一种蛋白酶抑制剂,近年来越来越多的被用于脑保护作用的研究当中[9]。UTI主要通过清除氧自由基、抑制炎性反应,免疫调节等方面发挥器官保护作用。本研究通过UTI治疗创伤性脑水肿后发现,创伤性脑水肿组和UTI组脑水肿部位NF-κB的活性和IL-1β的水平均较对照组明显升高(P<0.01),且于24 h达到较高值,于72 h时有所下降;在观察的时间点里,UTI组各时间点均与创伤性脑水肿组比较差异均有统计学意义(P<0.01)。说明经UTI治疗组NF-κB活性和IL-1β的水平均较创伤性脑水肿组明显降低。通过本研究发现UTI对NF-κB和IL-1β均具有明显的抑制作用,进而减轻炎性反应、稳定细胞膜,保护血脑屏障的结构和功能,从而起到减少神经系统的功能损害的作用。
本实验通过对创伤性脑水肿后NF-κB和IL-1β水平的变化及UTI对其进行干预后的影响的观察,探讨UTI对创伤性脑水肿后炎症反应的保护作用,发现UTI可通过抑制NF-βB表达,进一步抑制炎性细胞因子如IL-1β、IL-6、TNF-α等的表达,从而有效的保护脑细胞,减轻脑水肿,显著减轻继发性脑损伤,并为创伤性脑水肿的临床治疗提供了新思路。
1 陈伟峰,刘德红,何卫平,等.乌司他丁对大鼠全脑缺血再灌注后NF-κB 的影响.广西中医学院学报,2006,9:11-14.
2 Marmarou A,Foda MA,van den Brink W,et al.A new model of diffuse brain injury in rats.Part I:Pathophysiology and biomechanics.J Neurosurg,1994,80:291-300.
3 Scaife ER,Statler KD.Traumatic brain injury :preferred methods and targets for resuscitation.Curr Opin Pediatr,2010,22:339-345.
4 Chen B,Liao WQ,Xu N,et al.Adiponectin protects against cerebral ischemia- reperfusion injury through anti-inflammatory action.Brain Res,2009,1273:129-137.
5 Hang CH,Shi JX,Li JS,et al.Concomitant upregulation of nuclear factor-κB activity,proinflammatory cytokines and ICAM-1 in the injured brain after cortical contusion trauma in a rat model.Neurology India,2005,53:312-317.
6 Hang CH,Shi JX,Li JS,et al.Up-regulation of intestinal nuclear factor kappa B and intercellular adhesion molecule-1 following traumatic brain injury in rats.Word JGastroenterol,2005,11:1149-1154.
7 Goebeler M,Gillitzer R,Kilian K,et al.Multiple signaling pathways regulate NF-Kappa B-dependent transcription of the monocyte chemoattractant protein-1 gene in primary endothelial cell.Blood,2001,97:46-55.
8 Iha H,Peloponese JM,Verstrepen L,et al.Inflammatory cardiac valvulitis in TAXlBPI-deficient mice through selective NF-kappa B activation.EMBO J,2008,27:629-641.
9 于熙,田国刚,田毅.乌司他丁的脑保护作用研究进展.海南医学院学报,2010,16 :948-950.
Effect of ulinastatin on the expression of nuclear factor-κB and interleukin-1β in rats with traumatic encephaledema
DUYiri,DUXuejiang,YUJianshe.DepartmentofAnesthesia,AffiliatedHospitalofInnerMongoliaMedicalUniversity,Hohhot010050,China
ObjectiveTo observe the changes of expression levels of nuclear factor-κB (NF-κB) and interleukin-1β (IL-1β) in rats with traumatic encephaledema in order to explore the protective effect and possible action mechanism of ulinastatin(UTI).MethodsThirty healthy adults SD 30 rats were randomly divided into three groups:normal control group,traumatic encephaledema group and UTI intervention group.The levels of NF-κB and IL-1β in serum and brain tissue homogenate (BTH) were detected by immunohistochemisty and enzyme-linked immunosorbent assay (ELISA) at the 8th,12th,24th,72th hour after trauma.ResultsThe levels of NF-κB and IL-1β in encephaledema position were significantly increased,as compared with those in control group (P<0.01),which reached peak at the 24th hour,however,which reduced slightly at the 24th hour;there were significant differences in the changes of levels of NF-κB and IL-1β in every time point between UTI group and traumatic encephaledema group(P<0.01).ConclusionUTI has obvious protective effect on the brain injury caused by traumatic encephaledema in rats,it may be one of the action mechanisms to inhibit the signal transduction way of NF-κB and IL-1β.
ulinastatin;protection brain;NF-κB ;interleukin-1β
10.3969/j.issn.1002-7386.2014.07.006
项目来源:内蒙古医科大学青年基金资助项目(编号:NY2011QN004)
010050 呼和浩特市,内蒙古医科大学附属医院麻醉科
R 742
A
1002-7386(2014)07-0981-03
2013-10-25)
