缺血后适应对心肌缺血再灌注兔超氧化物歧化酶酶蛋白活力浓度、丙二醛浓度的影响
2014-08-28李方江张文婷王晓元
李方江 张文婷 王晓元
·论著·
缺血后适应对心肌缺血再灌注兔超氧化物歧化酶酶蛋白活力浓度、丙二醛浓度的影响
李方江 张文婷 王晓元
目的观察缺血后适应对心肌缺血再灌注兔丙二醛(manlondialdehyde,MDA)浓度、超氧化物歧化酶(superoside dismutase,SOD)酶蛋白活力浓度的影响。方法24只日本大耳白兔随机分为3组(n=8),采用结扎兔左冠状动脉前降支30 min、复灌120 min建立心肌缺血再灌注模型。假手术组:动脉下仅穿线不结扎;缺血再灌注组:直接恢复再灌注;缺血后适应组:缺血后30 min即刻给予3轮复灌30 s/缺血30 s作为后适应,再灌注120 min。检测3组MDA浓度、SOD酶蛋白活力浓度。结果缺血再灌注组较假手术组外周血MDA浓度明显升高(P<0.01),SOD酶蛋白活力浓度明显降低(P<0.01);缺血后适应组较缺血再灌注组外周血MDA浓度明显降低(P<0.01),SOD酶蛋白活力浓度明显升高(P<0.01)。结论心肌缺血再灌注可导致兔外周血MDA浓度升高,SOD酶蛋白活力浓度降低;缺血后适应可显著降低心肌缺血再灌注兔外周血MDA浓度,提高SOD酶蛋白活力浓度,具有减轻心肌缺血再灌注损伤的作用。
缺血后适应;心肌缺血再灌注损伤;超氧化物歧化酶;丙二醛
心肌缺血再灌注损伤(myocardial ischemia and reperfusion injury,MIRI)是指缺血心肌在恢复血流引起大量自由基生成、能量代谢障碍、钙离子超负荷等,从而导致心肌超微结构、电生理、功能及代谢的进一步损害。这种再灌注损伤可导致心肌和微血管功能顿抑、心律失常及心肌坏死,严重影响缺血后心脏功能的恢复,危及患者生命。缺血后适应(ischemic post conditioning,IPOC)是指在缺血损伤后的心肌恢复血流再灌注后立即给予数次短暂的缺血/再灌注(ischemia-reperfusion,I/R)后处理,能提高心肌对之前较长时间I/R的耐受性,从而减轻MIRI[1,2]。本研究探讨IPOC对兔心肌缺血再灌注心肌外周血丙二醛(MDA)浓度、超氧化物歧化酶(SOD)酶蛋白活力浓度的影响,报告如下。
1 材料与方法
1.1 动物与试剂
1.1.1 实验动物:健康日本大耳白兔24只,体重2.0~3.5 kg。雌雄各12只,由河北北方学院动物实验中心提供。用前适应性喂养1周。
1.1.2 主要药品及试剂:乌拉坦(北京笃信精细制剂厂);96孔板超氧化物歧化酶(superoside dismutase,SOD)测定试剂盒、96孔板丙二醛(manlondialdehyde,MDA)测定试剂盒(武汉博士德生物科技有限公司)。
1.1.3 仪器:LEAD-2000多道电生理记录仪(四川锦江电子科技有限公司);动物呼吸机(上TOPO, 美国Kent公司);Rayto酶标仪(RT-2100C,美国Rayto公司);中佳中低速台式离心机(KDC-40,浙江科大创新股份有限公司中佳分公司);恒温水浴箱(美国Thermo公司);医用DW-86W420低温冷冻冰箱(-86℃,山东海尔)。
1.2 方法
1.2.1 动物模型的制备:分离兔耳缘静脉,经兔耳缘静脉注射20%乌拉坦5 ml/kg,麻醉后固定于实验台。四肢及胸前皮下置入电极,连接LEAD-2000多道电生理记录仪,监测心电图变化。经兔耳缘静脉建立液体通路,林格氏液300 ml以5 ml·kg-1·h-1静脉滴注补液。颈部正中皮肤备皮、消毒,经气管行T字型切开后插管,接动物呼吸机进行机械控制呼吸,频率控制在45次/min,氧流量保持在0.8 L/min。分离右颈总动脉,将24号静脉留置针一端置入右颈总动脉内结扎固定,另一端通过压力换能器连接LEAD-2000多道电生理记录仪监测实验全程血压及心电图变化。胸部备皮、消毒。沿胸骨左缘3~4肋间隙作切口开胸,逐层分离进入胸腔,暴露心脏,切开心包,同时取少量心包组织作为缝线垫片。拨开左心耳可见左冠状动脉自主动脉根部发出,确认左冠状动脉前降支(left anteriordescending coronary artery,LAD)即沿左心室间沟下行的动脉分支,在LAD根部穿双股2-0丝线,线两端各穿一缝线垫片(防止结扎时割裂心肌),结扎其中一股造成心肌梗死,复灌时剪断此线;另一股丝线穿缝线垫片后两端并拢套一自制的细塑料管,在行缺血后处理时拉紧该细塑料管造成缺血,放松则恢复灌注(推管法)。建模成功标准:结扎丝线后,心电图胸导联ST段出现弓背向上抬高、T波高耸等表现,为缺血成功;剪断丝线后,抬高的ST段下降,为复灌成功。
1.2.2 实验动物分组与处理:采用分离LAD,结扎30 min、复灌120 min的方法建立心肌I/R模型。24只健康日本大耳白兔分为:①假手术组(sham-operated group,S组,n=8):仅开胸并分离LAD,但不阻断血流;②缺血再灌注组(I/R组,n=8):结扎LAD 30 min后,复灌120 min;③缺血后适应组(IPOC组,n=8):结扎LAD 30 min后,即刻复灌,给予3轮复灌30 s/缺血30 s作为后处理,复灌120 min。
1.3 监测指标 MDA浓度及SOD酶蛋白活力浓度:于再灌注结束即刻颈动脉抽取动脉血1 ml,以4 500 r/min分离血清,-80℃冰箱保存,解冻后MDA浓度以硫代巴比妥酸盐(thiobarbituricacid,TBA)法用MDA测定试剂盒测定,SOD酶蛋白活力浓度以黄嘌呤氧化酶法用SOD测定试剂盒测定。
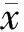
2 结果
与S组比较,I/R组、IPOC组的MDA浓度显著升高(P<0.01);与I/R组比较,IPOC组MDA浓度明显降低(P<0.01)。与S组比较,I/R组、IPOC组的SOD酶蛋白活力浓度显著降低(P<0.01);与I/R组比较,IPOC组SOD酶蛋白活力浓度明显升高(P<0.01)。见表1。
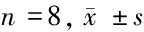
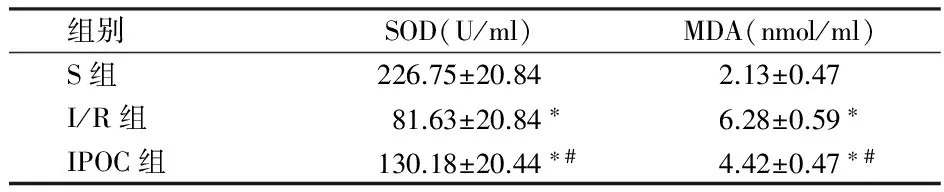
组别SOD(U/ml)MDA(nmol/ml)S组226.75±20.842.13±0.47I/R组81.63±20.84∗6.28±0.59∗IPOC组130.18±20.44∗#4.42±0.47∗#
注:与S组比较,*P<0.01;与I/R组比较,#P<0.01
3 讨论
IPOC是Zhao等[1]2003年首次系统阐述了的概念,即在缺血损伤的心肌在恢复血流再灌注后立即重复数次予以短暂的I/R处理,能提高心肌对之前较长时间I/R的耐受性,从而减轻I/R损伤,称之为IPOC。该研究建立狗的心肌I/R的模型,发现与未进行IPOC处理的对照组比较,I/R组的心律失常的发生率亦明显减低,心肌梗死面积、细胞凋亡明显减少,心肌细胞的炎性反应明显减轻。该实验分析IPOC可能通过减少氧自由基生成、抑制中性粒细胞活化、调节再灌注早期冠状动脉动力学状态从而减轻水肿和防止血管内皮损伤,达到保护心肌的作用。随后大量的动物实验及小样本临床研究证实其具有临床可控性及临床应用价值[3-5]。
MIRI时线粒体功能受损导致氧自由基(OFR)的清除减少,氧自由基通过与生物膜磷脂中的多价不饱和脂肪酸发生反应,引发链式脂质过氧化物反应,形成以MDA为代表的一系列脂质过氧化产物,最终导致心肌细胞膜、其他基质功能的过氧化损害[6,7]。MDA作为血清代谢指标可间接反映心肌细胞损伤的严重程度。SOD是体内的主要抗氧化酶,可通过清除氧自由基,保护细胞免受自由基的损伤[8]。实验中通过SOD和MDA的检测可以对缺血再灌注的损伤和后处理方式的抗氧化作用进行评价,进而反映后处理的心肌保护作用[9,10]。
本试验结果表明:所有试验组与S组比较MDA浓度显著升高(P<0.01);IPOC组较I/R组MDA浓度明显降低(P<0.01)。所有试验组与S组比较SOD酶蛋白活力浓度显著降低(P<0.01);IPOC组较I/R组SOD酶蛋白活力浓度明显升高(P<0.01)。其中IPOC对心肌缺血再灌注的保护可能:(1)减少氧自由基生成和抑制中性粒细胞活化;(2)调节再灌注早期冠状动脉动力学状态从而减轻水肿和防止血管内皮损伤,达到保护心肌的作用[1,4]。
本试验表明心肌缺血再灌注损伤可致兔外周血MDA浓度升高,SOD酶蛋白活力浓度降低,缺血后适应显著降低心肌缺血再灌注兔外周血MDA浓度、提高SOD酶蛋白活力浓度,具有减轻心肌缺血再灌注损伤的作用。
1 Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion comparison with ischemic preconditioning.Physiol Heart Circ Physiol,2003,285:579-588.
2 吴烨,何玲.心肌缺血再灌注损伤的机制研究进展及相关药物的研发.药学进展,2010,7:305-311.
3 田涛,马宾,王明霞,等.缺血后处理对减轻兔心肌缺血再灌注损伤作用的研究.中华全科医学,2012,10:170-176.
4 Laskey WK.Brief repetitive balloon occlusions enhance reperfusion during percutaneous coronary intervention for acute myocardial infarction:a pilot study.Cardiovasc Interv,2005,65: 361-367.
5 Staat P,Rioufol G,Piot C,et al.Postconditioning the human heart.Circulation,2005,112: 2143-2148.
6 Lee WH,Gounarides JS,Roos ES,et al.Influence of peroxynitrite on energy metabolism and cardiac function in a rat ischemia-reperfusion model.Am J Physiol Heart Circ Physiol,2003,285: H1385-H1395.
7 赵旭,范英昌,杜云.丹酚酸 B 对局灶性脑缺血/再灌注大鼠血清超氧化物歧化酶活力和丙二醛含量的影响.天津中医药,2008,25:63-65.
8 Machlin LJ,Bendich A.Free radical tissue damage: protective role of antioxidant nutrients.The FASEB Journal,1987,1:441-445.
9 于月新,李巨,郑莉彦,等.缺血再灌注损伤对家兔超氧化物歧化酶、丙二醛、诱导型一氧化氮合酶水平影响的研究.妇产与遗传,2012,3:31-471.
10 沈继龙,朱克军,顾红军,等.大鼠心肌缺血再灌注损伤不同时相氧化应激相关指标的变化.临床和实验医学杂志,2013,3:177-178.
10.3969/j.issn.1002-7386.2014.21.024
张家口市科技局指令性科研课题(编号:12110044D-2)
075000 河北省张家口市,河北北方学院第一附属医院心血管内科(李方江);河北北方学院研究生部(张文婷、王晓元)
R 542.2
A
1002-7386(2014)21-3265-03
2014-03-11)
