EGCG对5-氟尿嘧啶用于食管癌CaEs-17细胞增加疗效的实验研究
2014-08-28张润华王贤和陈萍邓守恒蔡晓军
张润华 王贤和 陈萍 邓守恒 蔡晓军
·论著·
EGCG对5-氟尿嘧啶用于食管癌CaEs-17细胞增加疗效的实验研究
张润华 王贤和 陈萍 邓守恒 蔡晓军
目的观察表没食子儿茶素没食子酸酯(EGCG)体外增强5-氟尿嘧啶(5-Fu)对食管癌CaEs-17细胞化疗敏感性的作用,并探讨可能的作用机制。方法实验分为空白对照组、5-Fu组(培养液中5-Fu终浓度为6 μmol/L),EGCG组(培养液中EGCG终浓度为20 mg/L)、联合组(培养液中EGCG终浓度为20 mg/L,5-Fu浓度为6 μmol/L),4组作用24 h,CCK-8法和细胞克隆形成法检测细胞增殖抑制率和存活率,金氏公式评价二药的协同效果;流式细胞仪检测细胞凋亡率及周期分布;Transwell法检测细胞侵袭力;免疫印迹法检测突变型P53(mtP53)蛋白表达水平。结果EGCG、5-Fu均可抑制CaEs-17细胞增殖、诱导细胞凋亡、降低细胞存活率和侵袭力;EGCG、5-Fu均可阻滞细胞于G0/G1期,并能下调mtP53蛋白表达水平(P<0.05),二药联用上述作用效果更为显著(P<0.01)。结论EGCG能够增强5-Fu对食管癌CaEs-17细胞的化疗敏感性,这种作用部分是通过下调mtP53蛋白实现的。
食管癌;表没食子儿茶素没食子酸酯;5-氟尿嘧啶;化疗
5-氟尿嘧啶(5-fluorouracil,5-Fu)是第一个人工合成的抗肿瘤代谢药物,其作为嘧啶类的氟化物,在体内可通过抑制胸腺嘧啶核苷酸合成酶活性,阻断脱氧嘧啶核苷酸转换成胸腺嘧啶核苷核,干扰肿瘤细胞DNA合成起到杀灭肿瘤的作用,其具有较广的抗瘤谱,是临床上包括食管癌在内的消化道肿瘤道选的化疗药物之一,然而,骨髓抑制、胃肠道反应及血液毒性等不良反应限制了其最大疗效的发挥。如何在不增加甚至减少5-Fu用量的基础上提高其化疗疗效是肿瘤药物研究领域的热点。表没食子儿茶素没食子酸酯(EGCG)[1,2]是绿茶中含量最高,活性最强的单体,其在体外亦具有广谱的抗肿瘤作用。研究还发现EGCG与紫杉醇联用尚具有增加肺癌细胞对紫杉醇敏感性的作用[3],EGCG与5-Fu联用抗肿瘤作用如何笔者未见报道,本文对其在体外联用抗食管癌作用进行研究,报告如下。
1 材料与方法
1.1 试剂与仪器 表没食子儿茶素没食子酸酯(EGCG)、甲基纤维素(CPS4000)、碘化丙锭(PI)为美国Sigma产品;5-Fu江苏南通精华药业产品;CCK-8试剂盒购自日本同仁公司;Transwell小室购自美国Costar公司;兔抗人突变型P53(mtP53)单抗及山羊抗兔的二抗购于北京中杉金桥生物技术有限公司;其他试剂均为进口分装分析纯;Mini-Prote电泳仪(美国伯乐公司);图像采集系统(日本Olympus公司);Mod 550型全自动酶标仪(美国Bio-Rad公司);Epics Elite ESP型流式细胞仪(美国Coulter公司)。
1.2 细胞及培养 食管癌细胞株CaEs-17购自中国科学院上海细胞生物研究所,培养于含10%灭活小牛血清的RPMI1640培养基内,于37℃、饱和湿度,5%CO2条件下培养,每2~3天用0.25%胰酶消化,1∶2传代。
1.3 CCK-8法检测单独及联合给药对细胞增殖的影响 取指数生长期CaEs-17细胞,以1×105个/孔接种于96孔板,37℃、饱和湿度,5%CO2条件下培养24 h后吸出原培养液,分为EGCG组(培养液中EGCG终浓度为20 mg/L)、5-Fu组(培养液中5-Fu终浓度为6 μmol/L)、联合组(培养液中EGCG终浓度为20 mg/L,5-Fu终浓度为6 μmol/L),另设空白对照组(只加入RPMI1640培养基,未给予其他任何处理),EGCG和5-Fu各取1/2 IC50值,EGCG IC50值参照预实验结果,5-Fu IC50值参照文献[4],继续培养24 h后,吸去上清液,每孔加入10 μl CCK-8试剂,继续培养1 h,酶标仪检测各孔在450 nm波长下的吸光度(OD)值,代入公式计算细胞增殖抑制率。增殖抑制率=(对照组OD值-实验组OD度)/对照组OD值×100%。
1.4 克隆形成法检测细胞增殖[5]细胞分组及处理同1.3,参照文献配制半固体培养基,收集经EGCG、5-Fu单独和联合作用24 h的各组细胞,PBS洗去药物,离心1 000 r/m×3 min,用含20%小牛血清的培养液稀释成7.0×103个/ml单细胞悬液,于24孔板预加1.2%甲基纤维素培养基1.0 ml/孔,加入单细胞悬液50 μl,使每孔细胞数为350个,每个浓度设4个复孔,混匀后置37℃,5%CO2培养箱中孵育12~14 d后于倒置显微镜下计数细胞克隆数,计算细胞存活率(给药组平均克隆数/未给药组平均克隆数×100%),实验重复3次。
1.5 流式法检测细胞周期及凋亡 细胞分组及处理同1.3,收集各组作用24 h细胞,0.01 mol/L PBS 0.5 ml重悬细胞,加70%乙醇1 ml,-20℃固定24 h,加入PI (终浓度为50 μl/ml)和RNA酶(终浓度为0.25 mg/ml),室温下避光孵育30 min后流式细胞仪作DNA分析,以ModFit LT软件分析,拟合计算各时相细胞的百分比。
1.6 Transwell法检测细胞侵袭性改变 细胞分组及处理同1.3,以NIH3T3细胞培养液做趋化液,在Transwell上室内加入100 μl不含小牛血清的RPMI1640,37℃孵育1 h,加入上述各组细胞悬液20 μl(调细胞浓度为1.0×105个/ml),每组4个复孔。37℃ 12 h后取出滤膜,甲醇固定,HE染色。显微镜下计数滤膜外表面的细胞数,每张滤膜随机取5个视野(×200)取均值,实验重复3次,以相对侵袭抑制率表示肿瘤细胞的侵袭力,相对侵袭抑制率(%)=(对照组-实验组)/对照组×100%。
1.7 免疫印迹法检测mtP53蛋白表达 细胞分组及处理同1.3,收集细胞,PBS洗2次,裂解,离心,收集上清,即为细胞总蛋白,进行蛋白定量,调节每份样品蛋白浓度,加等量蛋白于上样缓冲液,煮沸,在SDS聚丙烯酰胺凝胶中进行电泳。电泳后转膜,依次加入mtP53蛋白一抗和二抗,显色,拍照。Quanti Scan软件进行蛋白条带扫描分析。
1.8 协同作用评价 以金氏公式[6]q=E(a+b)/[( Ea+Eb)-Ea×Eb]评价药物合用是否有协同作用:E(a+b)为合用抑制率,Ea和Eb分别为A药和B药的抑制率。分子为实测合并效应,分母为期望合并效应,q 在0.85~1.15为单独相加(+),q在1.15~2.0为增强(++),q在2.0为明显增强(+++),q在0.85~0.55为拮抗(-),q <0.55为明显拮抗(-)。
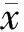
2 结果
2.1 单独和联合给药对细胞增殖的抑制作用 6 μmol/L 5-Fu和20 mg/L EGCG作用食管癌细胞24 h对细胞增殖产生的抑制率分别为46.4%和37.5%,二药合用,则抑制率升高至81.7%,合用产生的抑制率大于两药单独应用,q值为1.23,表明两药合用产生的抑制效果远大于两药单独相加,产生协同增强效应。见表1。
2.2 单独和联合给药对细胞周期分布、凋亡的影响 6 μmol/L 5-Fu单独作用食管癌细胞24 h,G0/G1期细胞数目由43.8%升高至69.7%(P<0.01),而S期细胞数目则由45.6%下降至21.3% (P<0.05),细胞周期被阻滞于G0/G1期。20 mg/L EGCG单独作用24 h可使食管癌G0/G1期细胞数目由43.8%明显上升至55.3% (P<0.05),细胞周期亦被阻滞于G0/G1期。二药联用 G0/G1期阻滞现象更为显著,G0/G1期细胞数目由43.8%增高87.3%,S期细胞数目由45.6%减少至9.6%,G2/M期细胞数目则由11.7%下降至3.2%(P<0.01)。二药均可诱导细胞凋亡,联用效果更为显著(P<0.01)。见表2。
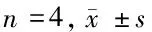

EGCG(mg/L)5⁃Fu(μmol/L)抑制率(%)q值协同等级00020037.5±2.20646.4±1.920681.7±2.51.23++

表2 EGCG与5-Fu单独和合用对CaEs-17细胞
注:与空白对照组比较,*P<0.05,#P<0.01
2.3 单独和联合给药对细胞侵袭力和存活率的影响6 μmol/L、5-Fu、20 mg/L EGCG单独作用食管癌细胞24 h均可明显抑制细胞克隆形成,降低细胞存活(P<0.05),二药合用效果更为显著(P<0.01)。细胞侵袭实验也显示出相似的作用结果,表现为与空白对照组比较,经5-Fu、EGCG单独或联合作用后的食管癌细胞穿过基底膜的能力大大降低,二药合用后效果更为显著(P<0.05或<0.01)。见表3。
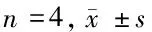

组别存活率(%)侵袭细胞(个)抑制率(%)空白对照组-229±23-5⁃Fu组44.3±2.2∗139±26∗39.3±2.2∗EGCG组54.2±2.8∗183±18∗20.1±1.6∗5⁃Fu+EGCG组31.6±1.7#108±20#52.8±2.7#
注:与空白对照组比较,*P<0.05,#P<0.01
2.4 单独和联合给药对细胞mtP53蛋白表达的影响 免疫印迹及灰度扫描定量检测结果发现,未经处理的空白对照食管癌细胞中存在着mtP53蛋白的高表达,灰度值为(0.987±0.013), 经5-Fu、EGCG单独作用24 h,细胞内mtP53蛋白灰度值分别降至(0.598±0.019)(P<0.05)和(0.385±0.012)(P<0.01)。而二药联合作用24 h,灰度值则降至(0.163±0.009)(P<0.01),下调作用更加显著。见图1。
3 讨论
EGCG作为绿茶中的主要成分,具有显著的清除氧自由基、抗氧化、抗衰老及抗肿瘤等功效[7-9]。目前有关EGCG的抗肿瘤研究多集中在诱导细胞凋亡,阻滞细胞周期,抑制肿瘤血管生成等方面,而对EGCG的放化疗增敏及降低放化疗毒性等方面的研究却较少。本文中,笔者联用1/2IC50值的EGCG和5-Fu作用于体外培养的食管癌细胞株CaEs-17,采用CCK-8法和克隆形成法检测其对细胞增殖的影响,结果发现,EGCG、5-Fu均可明显抑制细胞增殖,降低其存活,合用效果更显著,证实EGCG确实具有增强5-Fu化疗敏感性的作用。由于克隆形成实验检测的是单个细胞的增殖能力,故本部分实验结果提示,在5-Fu化疗中联用EGCG不仅可对处于增殖期的细胞产生杀伤作用,还可明显抑制肿瘤干细胞的增殖,这比单纯抑制或者杀死癌细胞本身具有更大的价值[10]。
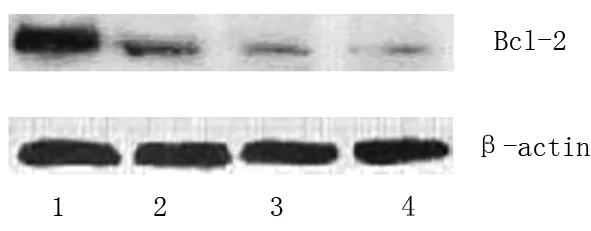
图1 EGCG与5-Fu单独和合用对食管癌细胞mtP53蛋白表达的影响(1,2,3,4分别为空白对照组、5-Fu组、EGCG组、EGCG+5-Fu组)
肿瘤发生不仅与细胞增殖失控有关,还与细胞凋亡有关。笔者采用流式细胞法检测了经EGCG、5-Fu单独和联合作用后的细胞凋亡率,结果显示,二药单独或联用均可明显诱导细胞出现凋亡,联用效果更为显著。对细胞周期进行分析也显示出相似的结果,EGCG、5-Fu无论单独还是合用均可增加G0/G1期细胞比例,降低S期细胞比例,阻滞细胞周期于G0/G1期,合用阻滞效果更为显著。由于细胞增殖的速度主要取决于细胞周期的长短,而细胞周期的长短又主要取决于G1期,G0/G1期阻滞可使细胞增殖周期延长,从而诱导细胞出现凋亡[11]。
侵袭是恶性肿瘤复发转移的主要原因之一。笔者采用Transwell法检测结果显示,5-Fu、EGCG亦可对食管癌细胞的侵袭能力产生明显的抑制作用,二药合用,抑制效果更加显著。提示5-Fu联合EGCG尚能起到抑制5-Fu单药化疗后食管癌易出现的复发和转移等作用。
P53是一种常见的抑癌基因,主要起到“分子警察”的作用,在保持正常细胞基因组完整性上发挥作用。正常组织野生型P53蛋白表达量很少,且半衰期很短,很难检测到。突变型P53(mtP53)系由野生型P53突变而来,其表达的蛋白可使细胞增殖失控、凋亡受阻,最终使细胞发生癌变[12]。本实验中,未经处理的食管癌细胞中存在着mtP53蛋白的高表达,而经5-Fu、EGCG单独和联合作用后该蛋白表达明显受到抑制,合用抑制效果更为明显,表明上述EGCG、5-Fu两种药物单独和合用对食管癌细胞产生的抑制增殖、诱导凋亡和阻止侵袭等药理作用至少部分是与其能下调mtP53蛋白表达有关,但具体的分子机制尚需进行深入研究。
1 Ahmad N,Feyes DK,Nieminen AL,et al.Green tea constituent epigal-locatechin-3-gallate and induction of apoptosis and cell cycle arrest in human carcinoma cells.Natl Cancer Inst,1997,89:1881.
2 温旭烨,李记英,蒋洁琳,等.表没食子儿茶素没食子酸酯的抗癌机制的研究进展.食品工业科技,2013,34:347-349.
3 王江江,徐莉,董扬,等.EGCG联合紫杉醇对肺癌A549细胞增殖、凋亡的影响.重庆医科大学学报,2012,37:306-308.
4 王正文,崔海宁,龚军,等.金雀异黄素增加5-Fu对胃癌SGC-7901细胞疗效的体外研究.海南医学院学报,2013,19:1354-1356.
5 韩锐主编.抗癌药物研究与实验技术.第1版.北京:北京医科大学中国协和医科大学联合出版社,1996.284-290.
6 戴体俊.合并用药的定量分析.中国药理学通报,1998,14:479-451.
7 李彬彬,黄培春,黄国良,等.EGCG对鼻咽癌细胞增殖、凋亡及E2F-1表达的影响.肿瘤防治研究,2012,39:1407-1410.
8 张东鹏,杨志伟,潘正波.EGCG对前列腺癌细胞端粒酶的抑制作用及可能的机制.武汉大学学报,2012,33:339-341.
9 魏芳,刘浩,张配,等.EGCG对三阴乳腺癌细胞MDA-MB-231的增殖抑制作用及机制.中国药理学通报,2013,29:680-683.
10 魏丽惠.体外人癌细胞对抗癌药物的敏感性(集落法与小孔法比较).北京医学院学报,1983,15:307-309.
11 邓守恒,曹凤军,蔡晓军,等.硒化壳聚糖诱导人早幼粒白血病细胞凋亡的研究.时珍国医国药,2010,21:1178-1179.
12 Speidel D.Transcription-independent P53 apoptosis:an alternative route to death.Trends Cell Biol,2010,20:14-24.
EffectofEGCG’sinenhancingchemotherapysensitivityof5-fluorouracilonhumanesophagealcancerlineCaEs-17invitro
ZHANGRunhua,WANGXianhe,CHENPing,etal.
OncologyCenter,People’sHospitalAffiliatedtoHubeiMedicalCollage,Hubei,Shiyan442000,China
ObjectiveTo observe the effect of epigallocatechin-3-gallate (EGCG) in enhancing chemotherapy sensitivity of 5-fluorouracil (5-Fu) on human esophageal cancer line-CaEs-17 in vitro,and to explore possible action mechanism.MethodsThe experiment consisted of four groups:blank control group,5-Fu group (final concentration of 5-Fu:6μmol/L in culture medium),EGCG group (final concentration of EGCG:20mg/L),combination group (final concentration of EGCG:20mg/L and 5-Fu:6μmol/L),affected for 24 hours in four groups.The inhibitory rate on cell proliferation and survival rate were detected by CCK-8 method and cell clone formation test,respevtively;the synergism effect of two drugs was evaluated according to Jin’s formula;the cell apoptosis rate and cell cycle distribution were detected by flow cytometry;cell invasiveness was determined by Transwell method;the expression levels of mutant P53 (mtP53) protein were detected by Western Blot.ResultsBoth EGCG and 5-Fu could inhibit the proliferation of CaEs-17 cells,induce cell apoptosis,decrease cell survival rate and cell invasiveness,moreover,both EGCG and 5-Fu could block cell at G0/G1 stage and cloud down-regulate the expression levels of mtP53 protein (P<0.05),the effects of combined application of two drugs were more obvious (P<0.01).ConclusionEGCG can enhance chemotherapy sensitivity of 5-Fu on human esophageal cancer line-CaEs-17 in vitro,which is performed partly through down-regulating the expression levels of mutation P53 protein.
esophageal cancer;epigallocatechin-3-gallate;5-fluorouracil;chemotherapy
10.3969/j.issn.1002-7386.2014.21.002
项目来源:湖北省自然科学基金资助项目(编号:2008CDZ022)
442000 湖北省十堰市,湖北医药学院附属人民医院肿瘤中心
蔡晓军,442000 湖北医药学院附属人民医院;
E-mail:1220658176@qq.com
R 735.1
A
1002-7386(2014)21-3208-04
2014-05-09)
