核糖体蛋白S6对果蝇发育的影响
2014-08-28李红艳
李红艳
(西藏民族学院医学院; 高原环境与疾病相关基因研究实验室, 咸阳 712082)
核糖体蛋白的主要作用在于参与核糖体聚集和蛋白质合成. 另外在细胞周期[1]、凋亡[2-5]和DNA损伤[6]过程中一些核糖体蛋白也发挥着一定作用,与核糖体组分作用无关[7]. 研究发现人类某些疾病的发生与一些核糖体蛋白表达异常密切相关,如Diamond-Blackfan贫血症[8],特纳综合征[9],丧失听力[10]和癌症[11].S6是真核细胞中核糖体小亚基中一个主要的磷酸化蛋白. 在果蝇中利用P转座子插入突变法建立的S6突变系,果蝇致死. 主要原因是引起了果蝇造血细胞中核的过度复制,导致组织过度生长所致[12]. 但有关S6蛋白在果蝇发育中的具体作用尚不清楚. 本实验利用RNAi技术分别在果蝇和果蝇S2细胞中干扰S6基因表达,探讨S6蛋白对果蝇发育的影响及可能机制. 以期为深入了解S6蛋白在果蝇发育中的作用提供更多的实验基础和理论依据.
1 方法和材料
1.1 S6RNAi转基因果蝇的获得和培养
以果蝇S6cDNA编码区为模板进行PCR扩增(上游引物:5-caagcggccgctcggtgacgagtggaagg-3;下游引物:5-ccggaattcgcgaatggaggcagaacg-3). 将PCR产物克隆到SympUAST-w载体上,获得S6-SympUAST-w质粒. 将S6-SympUAST-w质粒通过显微注射法注射到果蝇W1118胚胎中,经果蝇筛选和分子鉴定获取S6RNAi转基因果蝇. 实验中用到的其他果蝇品系包括act5c-Gal4、Hsp70-Gal4、ey-Gal4、sca-gal4和vg-Gal4. 除特殊说明,果蝇培养在18 ℃或25 ℃玉米粉-蔗糖培养基上.
1.2 果蝇体长测量
S6RNAi雄蝇与Hsp70-Gal4雌蝇进行杂交,在培养基上间隔1 h产卵. 产卵后24 h,将幼虫在37 ℃热激30 min. 热激后间隔24 h随机收集幼虫,每组10只,直到对照组发育至蛹期为止. 用带有CCD摄像头(莱卡)的MZ16体视显微镜对收集到的幼虫拍照. 通过MetaMorph软件分析图片,测量幼虫体长.
1.3 细胞凋亡检测
在PBS缓冲液中解剖S6RNAi/vg-Gal4三期幼虫翅膀disc,解剖好的disc立即放到4 ℃果蝇培养基(Gibco)中,使其维持正常的生理环境. 再将其转移到一个加有50 μL培养基的载玻片上,用100 μL的培养基清洗1次. 以质量浓度为1 μg/mL的吖啶橙(Sigma)室温染色5 min. 染色后直接用荧光显微镜观察拍照.
1.4 体外转录及细胞转染
通过PCR扩增果蝇S6编码序列(上游引物[含有一个T7启动子]:5-taatacgactcactatagggagaatgaagctcaacgtttcctat-3;下游引物:5-taatacgactcactatagggagattacttcttgtcgctggagac-3).PCR产物经高纯度PCR纯化试剂盒纯化(Roche Molecular Biochemicals). 以纯化的产物为模板,用MEGAscript T7体外转录试剂盒(Ambion)合成单链RNAs(ssRNAs). ssRNAs在95 ℃/5 min,65 ℃中退火30 min,然后自然降温至室温,即生成双链RNAs(dsRNAs). dsRNAs经乙醇沉淀后重悬在合适体积的无RNase水中. 通过琼脂糖凝胶电泳对dsRNAs进行定量,保存在-80 ℃备用.
S2细胞系(果蝇S2胚胎细胞)培养在Schneider基本培养基(Gibco)中,补加10%胎牛血清(Gibco)、160 μg/mL青霉素、250 μg/mL链霉素和4 mmol/L L-谷氨酸(Sigma). 25 ℃培养在75 cm 的盘里(Corning). 细胞以1∶10的比例每3天传1代. 在S2细胞中对S6基因进行干扰:细胞以1×106个/mL的密度培养在35 cm大小培养盘的无血清培养基里.S6dsRNAs (5 μg/mL)加到1 mL无血清培养基中,室温培养1 h. 1 h后,补加2 mL含有10%胎牛血清的正常培养基继续培养. 分别在处理后的第4和第8天收集经过S6RNAi的细胞,用作实验分析. 在相同条件下,GFPdsRNA用作对照.
1.5 基因表达检测
根据RNeasy Mini Kit(Qiagen)试剂盒说明提取第8天S6RNAi组和GFPRNAi组的细胞总RNA. 在进行RT-PCR之前,提取的RNAs用DNase (TaKaRa)进行处理. 纯化的RNA用作第一链cDNA合成. 用M-MLV反转录酶(Invitrogen)和oligo-dT引物合成cDNA. 在25 μL反应体系中,每个样品用1 μL cDNA做模板. PCR反应在相同条件下进行:95 ℃预变性5 min;94 ℃,30 s,60 ℃,30 s,72 ℃,45 s,30个循环;最后72 ℃延伸8 min. 用到的引物见表1.

表1 RT-PCR中用到的引物Table 1 The primers for RT-PCR
1.6 统计分析
所有实验至少重复3次,通过Excel软件对结果分析. 数值以平均值±标准差表示. 显著性分析用t检验,P<0.05表示差异显著.
2 结果与分析
2.1 RNAi干扰S6果蝇发育延缓
果蝇的发育经历4个时期:卵、幼虫(一期、二期和三期幼虫)、蛹和成蝇. 实验为了实现S6基因在果蝇周身及局部器官删除,分别用了act5c-Gal4和Hsp70-Gal4驱动子驱动S6基因的干扰. 结果对照组发育正常,而S6RNAi/act5c-Gal4果蝇都死在胚胎期.S6RNAi/Hsp70-Gal4从一期到三期幼虫发育延迟,在幼虫期维持10~12 d,体积比较小,生命力不旺盛,死在蛹期之前. 而对照组在幼虫期维持6~7 d,正常发育到蛹期和成蝇,完成一个正常的生命周期. 在48 h初,S6RNAi/Hsp70-Gal4体长与对照组相比没有明显变化;72 h后,比对照组果蝇发育显著延迟(P<0.05)(图1A,1B).表明S6蛋白对果蝇早期发育不可缺少.

图1 减少S6蛋白表达阻滞果蝇幼虫发育
Figure 1 Decreased expression of S6 protein caused theDrosophilalarvae growth arrest
2.2 RNAi干扰S6果蝇的眼睛、翅膀和刚毛发育缺陷
与对照组果蝇比较,用ey-gal4、vg-gal4和sca-gal4驱动子分别在果蝇眼睛、翅膀和刚毛中删除S6蛋白表达. 果蝇S6RNAi/ey-gal4眼睛明显变小(图2A).S6RNAi/vg-gal4翅膀皱缩(图2B). 另外果蝇S6RNAi/sca-gal4刚毛变短(图2C). 可见S6蛋白的正常表达与果蝇器官发育紧密相关.
2.3 RNAi干扰S6果蝇细胞增殖与凋亡
果蝇S2细胞在转染了S6dsRNAs后,与对照组比(转染了GFPdsRNAs的),其细胞生长受到阻滞、数目明显减少(图3B). 通过吖啶橙染色发现,在果蝇S6RNAi/vg-gal4三期幼虫翅膀disc中有明显凋亡信号. 暗示S6删除后导致的果蝇表型变化是由细胞凋亡引起的(图3A).
RT-PCR分析表明:果蝇删除S6基因后,细胞凋亡相关基因p53,hid,reaper和dcp-1转录水平升高.Bcl-2(细胞凋亡抑制因子)转录水平降低(图4A). 细胞周期相关基因cdc45,cyclinE,MCM5,MCM3,incenp和cyclinB在S6基因干扰后转录水平也受到了影响(图4B).

图2 减少S6蛋白表达对果蝇眼睛(A)、翅膀(B)和刚毛表型(C)的影响
Figure 2 The effect of S6 protein reduction on the eye(A), wing(B) and bristle phenotype(C) in flies
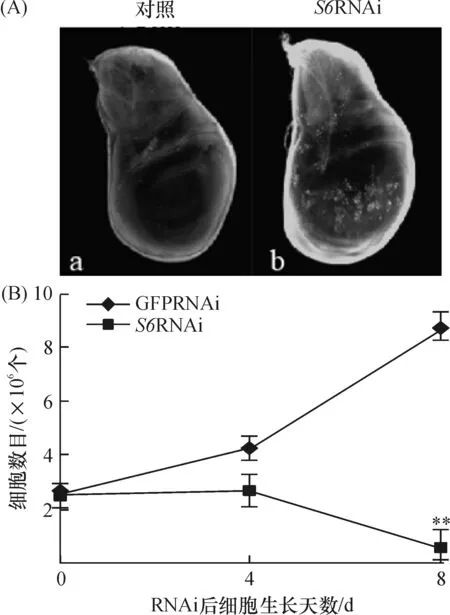
图3 RNAi干扰S6果蝇翅膀disc(A)和S2细胞数目(B)
Figure 3 Wing discs of flies(A) and cell mumber of S2 cells(B) in RNAiS6 Drosophila
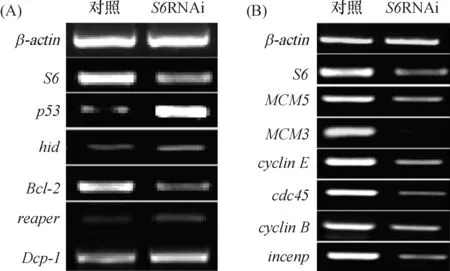
(A)S6RNAi后,p53、hid、Dcp-1,Bcl-2和reaper转录水平的变化;(B)S6RNAi后,MCM5、MCM3、cdc45、cyclinB、cyclinE和incenp转录水平的变化
图4 S2细胞中减少S6表达对细胞凋亡和细胞周期相关基因表达的影响
Figure 4 The effect ofS6-depletion in S2 cells on the expression of the genes related to apoptosis and cell cycle
3 讨论
为了探讨S6基因在果蝇生长发育中的作用,本文用了不同的驱动子使S6基因在果蝇中表达减少. 由表型分析可见:S6蛋白对于果蝇正常发育是必要的,其表达减少会引起细胞增殖受抑和凋亡的发生. 细胞增殖与细胞凋亡之间的平衡决定了细胞的生长状态[13]. 干扰S6基因表达引起:细胞数目减少、果蝇翅膀disc中有细胞凋亡以及细胞周期与凋亡相关基因的异常表达,这些结果一致暗示:S6基因干扰后引起果蝇表型异常是由细胞凋亡引起的.
P53在细胞凋亡中主要通过使线粒体释放细胞色素C[14-15],引起caspase活性升高,最终启动细胞凋亡[9]. 果蝇中2个重要凋亡诱导因子hid和reaper[16-17]可直接或间接激活p53,以诱导凋亡发生[18]. 另外这2个基因通过caspase引起凋亡[19-20]. Dcp-1是第一个被发现的果蝇ICE/CED-3蛋白激酶caspase家族成员,也在凋亡中有着重要作用[21]. Bcl-2是凋亡的一个抑制因子[22-24]. 减少Bcl-2表达可以通过释放细胞色素c激活Dcp-1[15]. 在S6干扰后hid,reaper,Dcp-1和p53转录水平升高,而Bcl-2转录水平降低.
细胞凋亡与细胞周期密切相关. 过表达cyclinE激活caspase诱导造血细胞凋亡[25]. MCM3和MCM家族的其他成员在基因复制中有着重要作用[26]. 在细胞周期中,p53负调控MCM5[27]. 而cdc45与MCM5/cdc46相互作用,共同调控细胞周期[28]. 另外,cyclin B表达水平降低会导致细胞周期阻滞在G2期,并且是一个p53依赖的负调控过程[29]. Incenp与Aurora B和survivin相互作用,形成复合物:Aurora B/incenp/survivin,在染色体分离中起作用[30-32]. 研究发现,survivin表达水平升高减少p53表达,因为通过caspases和Survivin调控了Mdm2分裂,增加了p53降解[33]. 本研究结果证实在S6RNAi后MCM5、MCM3、cdc45、cyclinB和incenp表达减少,而cyclinE和p53增加.
综上所述,S6干扰后主要是通过细胞凋亡和细胞周期阻滞的方式引起果蝇表型异常的,这将为更深入研究S6的生物学功能提供理论依据,同时也为果蝇的发育研究提供新的思路.
致谢 感谢清华大学孙方霖教授以及陈苏同学在实验中的帮助.
参考文献:
[1] Volarevic S, Thomas G. Role of S6 phosphorylation and S6 kinase in cell growth[J]. Progress in Nucleic Acid Research and Molecular Biology, 2001, 65: 101-127.
[2] Sonenberg N. Translation factors as effectors of cell growth and tumorigenesis[J]. Current Opinion in Cell Biology, 1993, 5: 955-960.
[3] Chen F W, Davies J P, Ioannou Y A. Differential gene expression in apoptosis: Identification of ribosomal protein 23K, a cell proliferation inhibitor[J]. Molecular Genetics and Metabolism, 1998, 64: 271-282.
[4] Chen F W, Ioannou Y A. Ribosomal proteins in cell proliferation and apoptosis[J]. International Reviews of Immunology, 1999, 18: 429-448.
[5] Lohrum M A, Ludwig R L, Kubbutat M H, et al. Regulation of HDM2 activity by the ribosomal protein L11[J]. Cancer Cell, 2003, 3: 577-587.
[6] Ben-Ishai R, Scharf R, Sharon R, et al. A human cellular sequence implicated in trk oncogene activation is DNA damage inducible[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87: 6039-6043.
[7] Soulet F, Al Saati T, Roga S, et al. Fibroblast growth factor-2 interacts with free ribosomal protein S19[J]. Biochemical and Biophysical Research Communications, 2001, 289: 591-596.
[8] Draptchinskaia N, Gustavsson P, Andersson B, et al. The gene encoding ribosomal protein S19 is mutated in Diamond-Blackfan anaemia[J]. Nature Genetics, 1999, 21: 169-175.
[9] Fisher E M, Beer-Romero P, Brown L G, et al. Homologous ribosomal protein genes on the human X and Y chromosomes: Escape from X inactivation and possible implications for Turner syndrome[J]. Cell, 1990, 63: 1205-1218.
[10] O′Brien T W, O′Brien B J, Norman R A. Nuclear MRP genes and mitochondrial disease[J]. Gene, 2005, 354: 147-151.
[11] Ruggero D, Pandolfi P P. Does the ribosome translate cancer?[J]. Nature Reviews Cancer, 2003, 3: 179-192.
[12] Stewart M J, Denell R. Mutations in theDrosophilagene encoding ribosomal protein S6 cause tissue overgrowth[J]. Molecular and Cellular Biology, 1993, 13: 2524-2535.
[13] Kastan M B, Canman C E, Leonard C J. P53, cell cycle control and apoptosis: Implications for cancer[J]. Cancer and Metastasis Reviews, 1995, 14: 3-15.
[14] Schuler M, Bossy-Wetzel E, Goldstein J C, et al. P53 induces apoptosis by caspase activation through mitochondrial cytochromecrelease[J]. Journal of Biological Chemistry, 2000, 275: 7337-7342.
[15] Chooi W Y, James S M, Burns D K. Decrease in ribosomal proteins 1, 2/3, L4, and L7 inDrosophilamelanogasterin the absence of X rDNA[J]. Molecular Genetics and Genomics, 1982, 187: 364-369.
[16] Grether M E, Abrams J M, Agapite J, et al. The head involution defective gene ofDrosophilamelanogasterfunctions in programmed cell death[J]. Genes & development, 1995, 9: 1694-1708.
[17] White K, Grether M E, Abrams J M, et al. Genetic control of programmed cell death inDrosophila[J]. Science, 1994, 264: 677-683.
[18] Brodsky M H, Weinert B T, Tsang G, et al.DrosophilamelanogasterMNK/Chk2 and p53 regulate multiple DNA repair and apoptotic pathways following DNA damage[J]. Molecular and Cellular Biology, 2004, 24: 1219-1231.
[19] White K, Tahaoglu E, Steller H. Cell killing by theDrosophilagene reaper[J]. Science, 1996, 271: 805-807.
[20] Zhou L, Schnitzler A, Agapite J, et al. Cooperative functions of the reaper and head involution defective genes in the programmed cell death ofDrosophilacentral nervous system midline cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94: 5131-5136.
[21] Li X, Scuderi A, Letsou A, et al. B56-associated protein phosphatase 2A is required for survival and protects from apoptosis inDrosophilamelanogaster[J]. Molecular and Cellular Biology, 2002, 22: 3674-3684.
[22] Sharma S, Haldar C, Chaube S K, et al. Long-term melatonin administration attenuates low-LET gamma-radiation-induced lymphatic tissue injury during the reproductively active and inactive phases of Indian palm squirrels (Funambulus pennanti)[J]. British Journal of Radiology, 2010, 83: 137-151.
[23] Miyashita T, Harigai M, Hanada M, et al. Identification of a p53-dependent negative response element in the bcl-2 gene[J]. Cancer Research, 1994, 54: 3131-3135.
[24] Miyashita T, Krajewski S, Krajewska M, et al. Tumor suppressor p53 is a regulator of bcl-2 and bax gene expression in vitro and in vivo[J]. Oncogene, 1994, 9: 1799-1805.
[25] Mazumder S, Gong B, Almasan A. Cyclin E induction by genotoxic stress leads to apoptosis of hematopoietic cells[J]. Oncogene, 2000, 19: 2828-2835.
[26] Kearsey S E, Maiorano D, Holmes E C, et al. The role of MCM proteins in the cell cycle control of genome duplication[J]. Bioessays, 1996, 18: 183-190.
[27] Agarwal M K, Ruhul Amin A R, Agarwal M L. DNA replication licensing factor minichromosome maintenance deficient 5 rescues p53-mediated growth arrest[J]. Cancer Research, 2007, 67: 116-121.
[28] Hardy C F. Identification of Cdc45p, an essential factor required for DNA replication[J]. Gene, 1997, 187: 239-246.
[29] Krause K, Wasner M, Reinhard W, et al. The tumour suppressor protein p53 can repress transcription of cyclin B[J]. Nucleic Acids Research, 2000, 28: 4410-4418.
[30] Sugihara Y, Honda H, Iida T, et al. Proteomic analysis of rodent ribosomes revealed heterogeneity including ribosomal proteins L10-like, L22-like 1, and L39-like[J]. Journal of Proteome Research, 2010, 9: 1351-1366.
[31] Cheeseman I M, Anderson S, Jwa M, et al. Phospho-regulation of kinetochore-microtubule attachments by the Aurora kinase Ipl1p[J]. Cell, 2002, 111: 163-172.
[32] Bolton M A, Lan W, Powers S E, et al. Aurora B kinase exists in a complex with survivin and INCENP and its kinase activity is stimulated by survivin binding and phosphorylation[J]. Molecular and Cellular Biology, 2002, 13: 3064-3077.
[33] Wang Z, Fukuda S, Pelus L M. Survivin regulates the p53 tumor suppressor gene family[J]. Oncogene, 2004, 23:8146-8153.
