PEG-PLA-PGL/RGD涂层支架对冠脉支架置入术后再狭窄的影响
2014-08-25张基昌宋春莉刁鸿英于雲鹏
张基昌,宋春莉,刘 斌,赵 卓,李 倩,刘 佳,刁鸿英,鲁 洋,于雲鹏
(吉林大学白求恩第二医院,吉林 长春130041)
冠状动脉支架置入术后再狭窄一直是心脏病介入治疗研究的热点。目前应用的药物涂层支架如雷帕霉素与紫杉醇涂层支架,大大减少了再狭窄的发生率。但该两种支架均是通过抑制细胞增殖来防止再狭窄,都是非平滑肌细胞选择性药物,在阻止平滑肌细胞增生的同时也阻止血管内皮细胞增生,使支架被内皮细胞覆盖时间过长或难以被覆盖,容易形成血栓[1,2]。故导致冠脉内支架置入术后患者服用双重或三重抗血小板药物时间增长,从而增加了患者的医疗费用,增加了患者长期双重抗血小板治疗出血风险,而且长期内皮修复不完全,会刺激内膜增生导致再狭窄。目前普遍认为在抑制平滑肌增殖的同时,加速内皮损伤的修复更重要。同时加速内皮修复受损内膜可降低支架暴露于血液中时间,降低支架置入术后远期血栓发生率,减少患者长期多重抗血小板治疗的时间[4-7]。本研究应用通过将支架表面接枝精氨酸-甘-天冬氨酸三肽聚合物(RGD),促进内皮祖细胞(Endothelial progenitor cell,EPC)在支架上附着,加速受损内膜修复的途径来实现消除再狭窄,该研究在国内外报道极少。
1 材料与方法
1.1 实验材料
316L不锈钢裸支架(购自乐普公司),PEG-PLA-PGL/RGD(中国科学院长春应用化学研究所提供),HE染色剂;氯化钠、盐酸、枸橼酸、枸橼酸钠、甲醛等。
1.2 实验动物
健康良种小型猪共18只,均为雄性,月龄3-5个月,体重20-25 kg/只。随机分为3组,即裸支架组,PEG-PLA-PGL/RGD支架组,紫杉醇涂层支架组,每组6只。常规喂养,术前观察1周。术前3天起每只猪双联抗血小板药物:拜阿司匹林100 mg日一次口服及氢氯吡格雷75 mg日一次口服,至相应观察终点时间结束药物治疗。麻醉采用速眠新2(846合剂)0.1 ml/kg 肌内注射,猪四肢无力无法行走后,3%戊巴比妥钠生理盐水溶液0.2 ml/kg 耳缘静脉推注,速度为2 ml/min,术中按需追加3%戊巴比妥钠生理盐水溶液,剂量为初始剂量1/4-1/5。
1.3 涂层支架的制备
生物可降解高分子聚乙二醇-聚乳酸-聚谷氨酸共聚物(PEG-PLA-PGL)的合成,PEG-PLA-PGL/RGD均由中国科学院长春支架涂层应用化学研究所协助完成。
1.4 冠脉损伤模型制备及支架置入术
麻醉后,使猪仰卧于手术台上,消毒铺巾。常规手术准备。分离右侧股动脉,穿刺并置入6F动脉鞘管。经动脉鞘管给予肝素钠150 U/kg,之后按照标准PTCA术步骤操作。选择左前降支、回旋支和右冠状动脉中较为平直的血管段,定量冠状动脉造影 ( QCA)测定直径,按照球囊/血管直径比例为1.2-1.3∶1的比例,10-15大气压、15 s单次过度扩张血管,释放支架,形成冠状动脉损伤模型。退出球囊后造影确认,支架充分扩张、无严重内膜撕裂及血栓形成、前向血流TIMI 3级为手术成功。术后撤除导管,拔除股动脉鞘,结扎动脉。缝合包扎后将动物送回动物房,常规喂养。术后给予青霉素300万U抗感染。继续双联抗血小板治疗,剂量同术前。注意观察动物精神状态、进食情况、有无黑便、血尿等出血倾向。
1.5 标本制备
分别在术后4及12周时每组选择处死实验猪3头,迅速取出心脏,置入含有肝素的生理盐水中。从升主动脉根部伸入7F扩张管分别伸至左右冠状动脉开口处,用上述液体冲洗冠状动脉3-4次,用止血钳封扎升主动脉及各心腔出口防止漏液。小心分离置入支架处血管段至少1 cm,包括支架置入血管部位的近端及远端,不可使血管与支架分离。置于4%多聚甲醛固定24 h,石蜡包埋后硬质切片机切片,间断均匀横向切片,切片厚度为4-5 μm,染色。制作成病理组织学切片,光镜下行组织学定量评价。
1.6 病理形态学分析
由计算机图像系统分别测定新生内膜面积、管腔横断面积。新生内膜面积为原始管腔和狭窄管腔面积之差(原始管腔面积- 狭窄管腔面积),面积狭窄百分比由下列公式计算:面积狭窄百分比=100×[1-(狭窄管腔面积÷原始管腔面积)] 。
1.7 统计学处理
2 结果
2.1 一般情况
本实验研究了9只实验猪。手术操作顺利,支架置入成功,扩张完全。实验猪术后饮食、精神及排便正常,未见出血倾向。处死动物后,未见心脏大体标本有瘢痕等异常情况出现。
2.2 涂层支架一般性状
光学显微镜观察涂层支架扩展时的顺应性,支架直径达到4 mm时,涂层无明显裂开、剥脱现象。
2.3 内膜增生定量评价
在光镜下可见,支架置入后第4周,三组支架表面均有内膜覆盖,但覆盖程度及内膜增生程度已有差异。紫杉醇组支架大部分已覆盖完全,但仍有部分位置未被覆盖,即内皮化不完全,在覆盖内膜的位置未见明显的内膜增生;NIR组支架表面均有内膜覆盖,但内膜相对较厚;RGD组支架表面有完整内膜覆盖,内膜未见明显增生。至第12周时,三组支架上内膜均覆盖完全,可见NIR组支架内膜增生明显,血管管腔较另两组明显狭窄,而紫杉醇支架组及RGD组内膜厚度相当,未见明显增生。三组支架在第4周及第12周典型内膜增生情况见图1所示。由于未行电镜下观察,光镜下观察内皮化不全及内膜增生有一定局限性。
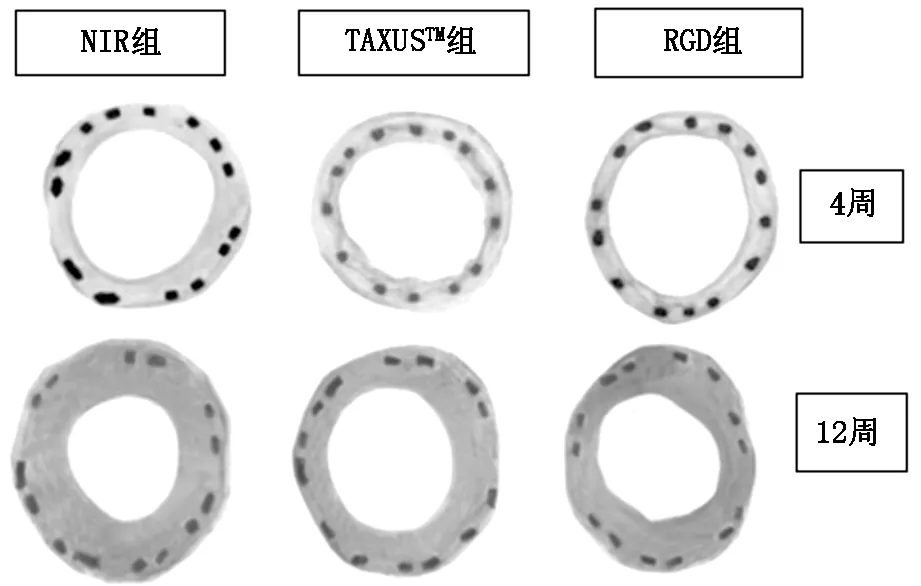
图1 三组支架在第4周及第12周内膜增生情况(25×)
通过表1中定量评价结果可见,在第4周及第12周,各组之间IEMA无统计学差异,提示各组在置入支架时,三组支架扩张程度无差异。管腔面积狭窄百分数(%AS)可以理解为单位面积上的内膜增生量,可以相对更准确的反应内膜增生的程度。第4周时,NIR组与紫杉醇支架组在%AS上表现出了显著差异,但RGD组与另两组比较均无差异,说明在支架置入后4周内,RGD组的内皮化效果应该介于NIR组及TAXUS组之间,但更倾向于内皮化不全还是内膜增生并无统计学数据支持。内膜增生至12周时,NIR组%AS几乎达到支架内再狭窄的判定标准(50%),而另两组则狭窄不明显。除TAXUS组与NIR组%AS表现出显著性差异外,4周时,紫杉醇组与NIR组比较aP<0.05;12周时RGD组及紫杉醇组分别与NIR组比较,bP<0.05、cP<0.05,RGD组和紫杉醇组无统计学差异,*P>0.05。

表1 三组支架内膜增生病理组织学定量评价结果
RGD组与NIR组%AS差异也有了统计学意义,提示在第5到第12周内,相对于NIR组内膜的快速增长,RGD组内膜增生较缓慢。并且在两个观察点中,RGD组与携带了抗增殖药物的紫杉醇组%AS均未出现统计学差异,RGD组支架材料在前期已证明了无细胞毒性,其上内膜未显著增生应该是RGD有快速促内皮化的作用,尽早完成支架表面内皮化后降低了内膜增生的发生率,起到了与抗增殖药物相似的抗再狭窄效果。
3 讨论
第一代药物洗脱支架(Drug eluting stent ,DES)通过释放细胞毒性药物或细胞静止药物抑制平滑肌细胞增殖,从而减少了再狭窄的发生,但不可避免地对内皮细胞也产生了毒性作用,延缓内皮化,增加了支架内血栓尤其是晚期血栓的发生率,支架表面早期内皮化可以修复受损的血管内膜,减少支架内再狭窄和血栓的形成,于是加速内皮化进程成为支架术后研究的热点所在[1-3]。EPC的研究促使EPC捕获支架的诞生,可以通过捕获EPC促使其在支架处增殖、分化为成熟内皮细胞从而修复受损血管内膜,在之前的研究中人们发现了多种可以捕获EPC的物质并在支架上尝试,但至今仍未有令人们十分满意的结果,在捕获EPC促内皮化上因各种问题导致内皮化效果不佳[4,5-9]。本文选取了被很多研究者证明有确切地捕获EPC的作用,并且可以同时捕获内皮细胞,因此在促进内皮化上有巨大优势。EPC捕获支架通过加速内皮化减少支架内血栓及再狭窄的形成,因此本实验通过实验猪体内实验初步观察RGD支架与裸支架及紫杉醇支架对比,对支架上内皮化及再狭窄的影响。
本研究将该新型EPC捕获支架置入实验猪体内,对比观察与裸支架及紫杉醇支架对内皮化和再狭窄产生的影响。4周时观察到了紫杉醇组支架的内皮化不完全现象,这主要是紫杉醇毒性造成的;而NIR支架出现了轻度的过度内皮增殖;RGD组支架作用介于二者之间,能在4周内很好的形成内膜修复且没有产生内膜过度增殖,说明RGD通过捕获EPC及内皮细胞加速了内皮化进程,使受损内膜得到了及早修复。第12周时,NIR支架表面因内膜增生过度几乎造成再狭窄;紫杉醇组支架慢慢完成了内皮化,本实验中未观察到支架内血栓形成,但内皮化的延迟不可避免的会粘附、激活血小板;RGD组在8周时间内也在继续内膜增生,但并未过度增殖。在内膜增殖速度观察上,RGD组主要在前4周完成了早期内皮化,TAXUS组使内皮化延迟。但两组在抗再狭窄上未有明显差异。因此,PEG-PLA-PGL/RGD涂层支架可以通过加速内皮化完成血管内膜修复,并且未观察到再狭窄发生。虽然需要说明的是,本实验是对PEG-PLA-PGL/RGD涂层支架促进内皮化的初步研究,因此选取的动物例数较少,观察时间较短,因此结果有局限性,将来可加大样本量进一步研究。
作者简介:宋春莉,女,副教授,博士,主要从事新型血管支架的基础与临床研究。
参考文献:
[1]Dibra A,Kastrati A,Alfonso F,et al.Effectiveness of drug-eluting stents in patients with bare-metal in-stent restenosis:meta-analysis of randomized trials[J].J Am Coll Cardiol,2007,49(5):616.
[2]Tung R,Kaul S,Diamond GA,et al.Narrative review:drug-eluting stents for the management of restenosis:a critical appraisal of the evidence[J].Ann Intern Med,2006,144(12):913.
[3]Ong AT,Serruys PW.Technology Insight:an overview of research in drug-eluting stents.Nat Clin Pract Cardiovasc Med[J].Nature Reviews Cardiology,2005,2:647.
[4]Dzau VJ,Gnecchi M,Pachori AS,et al.Therapeutic potential of endothelial progenitor cells in cardiovascular diseases[J].Hypertension,2005,46:7.
[5]张基昌,李淑梅,宋春莉,等.内皮祖细胞CD34抗体包被冠脉支架对猪冠状动脉再狭窄影响的研究[J].中国老年学杂志,2009,4(29):394.
[6]Shihui Liu,Tao Liu,Junying Chen,et al.Influence of a layer-by-layer-assembled multilayer of anti-CD34 antibody,vascular endothelial growth factor,and heparin on the endothelialization and anticoagulation of titanium surface[J].Journal of Biomedical Materials Research,2013,101A(4),1144.
[7]Blindt R,Vogt F,Astafieva I,et al. A novel drug- eluting stent coated with an integrin- binding cyclic Arg- Gly- Asp peptide inhibits neointimal hyperplasia by recruiting endothelial progenitor cells[J].J Am Coll Cardiol,2006,47(9):1786.
[8]Aburakawa Y,Kawabe J,Okada M,et al.Prostacyclin stimulated integrin-dependent angiogenic effects of endothelial progenitor cells and mediated potent circulation recovery in ischemic hind limb model[J].E Pub Cent,2013,77(4):1053.
[9]C Deng,H Tian,P Zhang,et al.Synthesis and Characterization of RGD Peptide Grafted Poly(ethylene glycol)-b-Poly(L-lactide)-b-Poly(L-glutamic acid) Triblock Copolymer[J].Biomacromolecules 2006,7(2):590.
