上海市活动性类风湿关节炎患者医院感染的流行病学调查
2014-08-23谢伟林管剑龙
谢伟林,管剑龙
类风湿关节炎(rheumatoid arthritis,RA)是一种病因不明的慢性炎症性自身免疫性疾病。患者由于自身免疫调节失衡及应用糖皮质激素或其他免疫抑制剂治疗等因素,致使免疫功能进一步严重受损,与一般人群相比,RA患者显著增加医院感染的易感性[1]。有研究表明,RA患者的医院感染尤其是呼吸道及泌尿生殖道感染,导致病死率明显增高[2-3]。近年研究显示5%~10%RA 患者在住院治疗期间可能发生医院感染。在过去的数十年里,美国和其他一些国家与RA患者相关的医院感染率逐年增高[4]。RA患者医院感染的病原微生物多数为常见耐药菌,主要包括耐甲氧西林金葡菌(MRSA),耐药革兰阴性杆菌及近年来新出现的耐万古霉素肠球菌等[5]。
在上海地区有许多活动性RA患者反复住院治疗,了解RA患者医院感染流行病学及病原微生物病原学特征,对于改善RA患者预后具有重要意义。
本研究旨在调查活动性RA患者医院感染流行病学特征,确定病原微生物类型及其对常用抗菌药物的敏感性。
材料与方法
一、病例来源
对上海市长海、长征、仁济、华山、中山、光华、龙华、岳阳、市一、市中医、市六、宝钢12所医院的风湿免疫科于2009年1月至2011年2月收住的所有RA患者进行了前瞻性调查,同时描述患者的人口学及临床特征。RA诊断标准参见1982年美国风湿病学会修定的分类诊断标准[6]。纳入标准为明确诊断RA3个月以上且疾病活动评分>3.2(DAS28)[7]。所有患者均填写知情同意书,并且该试验计划书经第二军医大学医学伦理委员会批准。
二、调查项目
医院感染的诊断标准按卫生部颁发的《医院感染诊断标准》(试行)确定[8]。机会感染定义参照Von Graevenitz[9]提出的分类标准。临床上有发热、咳嗽、咯痰、尿频、尿急、尿痛、腹泻、关节肿痛、胸痛、头痛和局部脓肿等临床表现之一或以上者,伴有微生物学检查阳性者,列入感染组观察对象。少数临床表现即可确诊的患者,未进行病原学检查,如皮肤带状疱疹的观察对象。
对每例患者的姓名、性别、年龄、入院日期、起病到确诊时间、住院时间、系统损害(如肾脏、神经精神、血液、心脏、肺及胸膜、消化系统)、皮质激素剂量、免疫抑制剂治疗方案,血白细胞计数、淋巴细胞计数、红细胞沉降率(ESR)、C反应蛋白(CRP)、肝功能、生化、X线胸片,医院感染日期、感染部位、微生物培养等,结合临床症状、体征、检验结果及影像学资料等因素进行统一列表,并由指定医师按统一表格进行登记,每感染1次,填写1次,原发病按本次入院第1诊断统计。
三、病原菌鉴定培养及药敏试验
(一)细菌 2009年1月至2011年2月,上海12所医院微生物实验室共收集临床分离株886株。按统一方案行药敏试验,剔除相同部位分离的重复菌株。
(二)抗菌药物纸片和E试验条 抗菌药物纸片为美国BBL公司或英国OXOID公司产品。用于鉴定肺炎链球菌耐药性的青霉素E试验条为瑞士ABBIODESK公司产品。
(三)培养基 药敏试验用 MH琼脂培养基。肺炎链球菌及各组链球菌用5%脱纤维羊血的MH琼脂培养基。流感嗜血杆菌用嗜血杆菌属培养基(HTM)加SR158营养补充剂。上述试剂均为英国OXOID公司产品。
(四)药敏试验 采用CLSI 2009年版推荐的纸片扩散法(K-B)进行药敏试验,质控菌株为金葡菌ATCC25923、大肠埃希菌ATCC25922和铜绿假单胞菌ATCC27853。对肺炎链球菌及各组链球菌用肺炎链球菌ATCC49619,嗜血杆菌属用流感嗜血杆菌ATCC49247和ATCC49766。
(五)β内酰胺酶的检测 按CLSI 2009年版推荐的方法筛选和确证大肠埃希菌、肺炎克雷伯菌、产酸克雷伯菌和奇异变形杆菌中的产ESBLs菌株。
四、统计分析
应用 WHONET5.3软件进行数据处理和分析。计数资料采用方差χ2检验,以P<0.05为差异有统计学意义,应用SPSS 16.0软件进行描述性统计分析。
结 果
一、病原微生物分离及药敏试验
共有2 788例患者符合RA诊断标准,其中336例患者因病情活动度低或确认为院外感染等因素而被剔除,最终2 452例患者被列入本研究。纳入病例分为感染组503例,非感染组1 949例。计有503例患者(20.51%,18.32/1 000床日)共发生721例次医院感染。有关人口学特征和临床特点见表1。
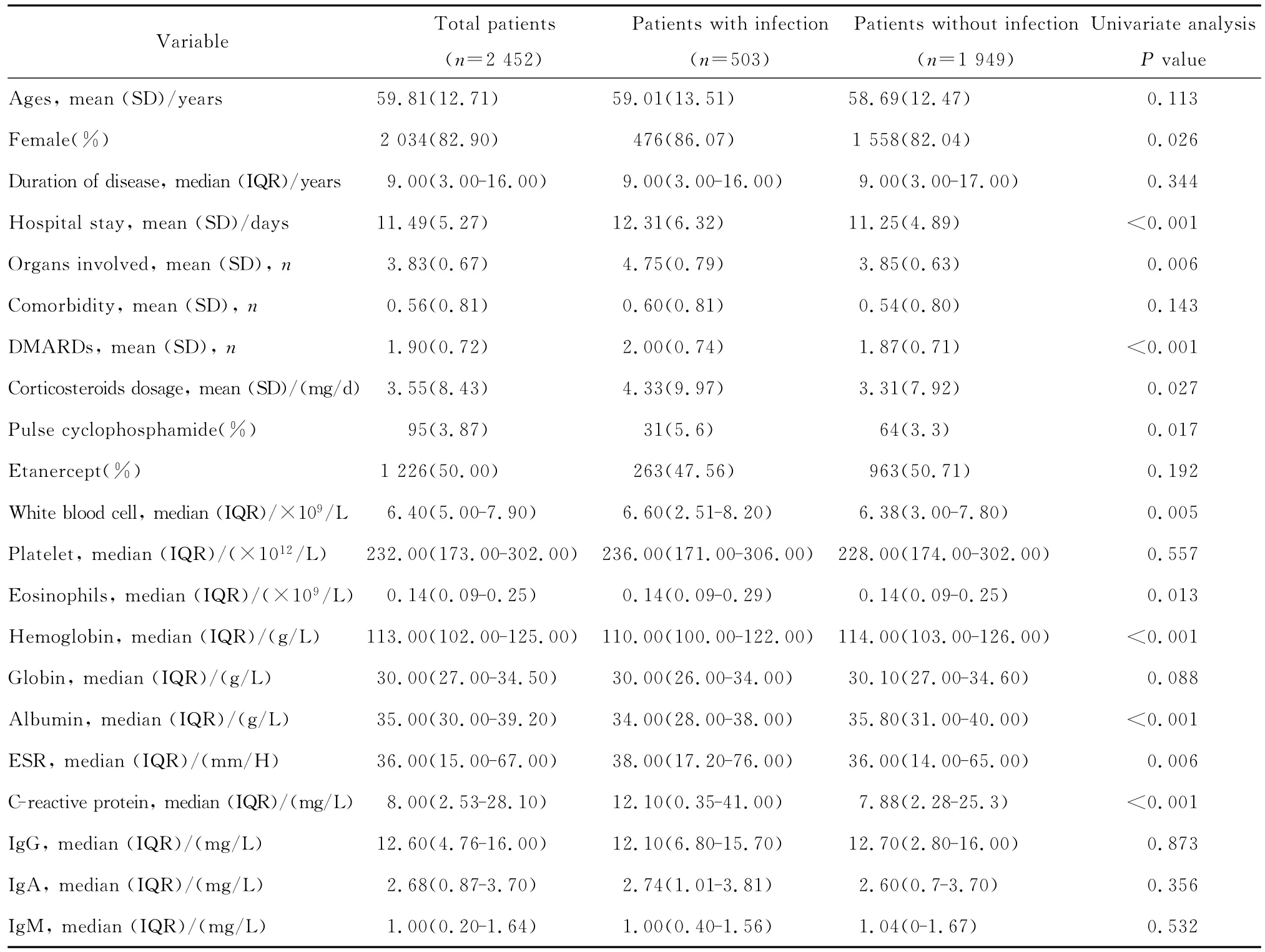
表1 活动性RA患者人口学及临床特征Table 1 Demographic and clinical characteristics of nosocomial infections in patients with active rheumatoid arthritis
调查结果表明,362例患者发生1次医院感染,141例发生2次以上感染。感染累及多个器官和系统,其中呼吸道感染(40.97%)、泌尿道感染(22.35%)、皮肤和软组织感染(8.58%)最为常见。经咽拭子、痰培养、痰涂片镜检、血培养、尿培养、粪便培养、脓液和分泌物培养、脑脊液镜检和培养,503例次感染中共分离病原微生物721株,其中623株常见细菌,74株真菌[其中3株(4.05%)白念珠菌分离自血液],8株结核分枝杆菌(7株经痰培养证实,1例经纤维支气管镜活检组织病理证实)和16株皮肤带状疱疹病毒,见表2。
在503例医院感染患者中共分离出革兰阳性菌241株(占细菌的38.68%,241/623)。包括凝固酶阴性葡萄球菌(CNS)44株(占细菌的7.06%,44/623),主要分离自血液(8株)、脑脊液(6株)和其他体液标本(30株);肠球菌144株(占细菌的23.11%,144/623),主要分离自尿液(55株)、胸腹水(41株)、伤口引流液(23株)、血液(3株)和其他体液标本(22株),见表2。病原菌对常用抗菌药物的药敏试验结果表明,多数革兰阳性菌株对青霉素、红霉素和庆大霉素耐药,但均对万古霉素敏感,见表3。金葡菌中 MRSA占28.3%,耐甲氧西林CNS(MRCNS)占15.9%,但未发现对万古霉素耐药的菌株。所有粪肠球菌对糖肽类抗菌药物(万古霉素)敏感,未发现耐药菌株,粪肠球菌对各种抗菌药物的敏感率高于屎肠球菌,粪肠球菌对氨苄西林、青霉素G敏感率达70.0%以上。屎肠球菌对万古霉素、利奈唑胺敏感率达90.0%以上,对四环素、呋喃妥因敏感率达50.0%以上,对其余抗菌药物的敏感率均在15.0%以下。

表2 RA患者医院感染类型和主要的致病菌Table 2 Types and main pathogens of nosocomial infections in rheumatoid arthritis patients

表3 RA患者医院感染革兰阳性菌对抗菌药物的敏感率(%)Table 3 Susceptibility of gram-positive bacterial isolates to antibiotics in the hospital infections of rheumatoid arthritis patients(%)
在503例医院感染患者中共分离出革兰阴性菌382株。病原菌对常用抗菌药物的药敏试验结果表明,大多数革兰阴性菌对氨苄西林、环丙沙星等耐药,对亚胺培南、美罗培南、头孢哌酮-舒巴坦和阿米卡星等敏感。调查中活动性RA患者医院感染中产ESBLs的大肠埃希菌占18.1%,对亚胺培南、美罗培南、氨基糖苷类(阿米卡星)、头孢哌酮-舒巴坦等敏感率>80.0%,但对头孢曲松、头孢唑林、氨苄西林、氟喹诺酮类(环丙沙星)敏感率<10.0%。本次调查肺炎克雷伯菌中未检出产ESBLs的菌株,该菌除对碳青霉烯类抗菌药物全部敏感外,对头孢他啶、头孢吡肟、阿米卡星的敏感率>70.0%,对其他抗菌药物的敏感率均<50.0%。铜绿假单胞菌除对阿米卡星、头孢哌酮-舒巴坦、头孢吡肟、亚胺培南、美罗培南敏感率>70.0%外,对其他抗菌药物的敏感率均<60.0%。鲍曼不动杆菌除对阿米卡星、环丙沙星、头孢哌酮-舒巴坦、美罗培南的敏感率>70.0%外,对其他抗菌药物的敏感率均<40.0%。见表4。
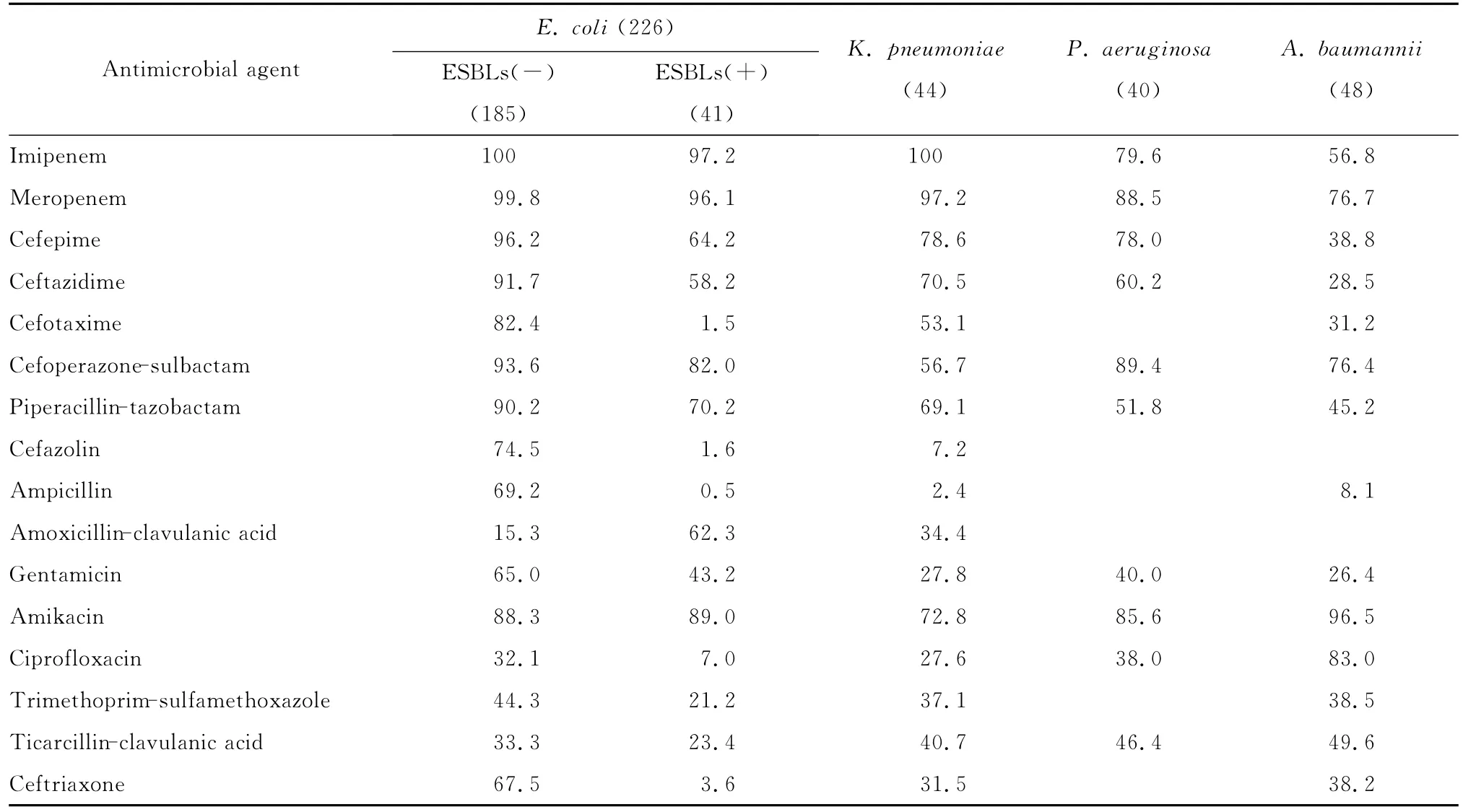
表4 RA患者医院感染革兰阴性菌对抗菌药物的敏感率(%)Table 4 Susceptibility of gram-negative bacterial isolates to antibiotics in the hospital infections of rheumatoid arthritis patients(%)
二、治疗和预后
非感染组1 949例患者中,因病情加重或出现严重并发症死亡5例。感染组503例患者中,492例病情缓解出院,11例因感染死亡。11例感染死亡患者中单一菌感染者2例,二重感染者9例,感染持续1个月以上者9例;由真菌直接引起死亡5例,细菌感染死亡6例。细菌感染是主要的死亡原因之一,其中肺部感染较重,脑膜炎次之。
讨 论
本研究中,我们调查了上海地区活动性RA患者医院感染患病率和流行病学特征,结果发现活动性 RA患者医院感染率为20.51%(18.32/1 000床日)。Doran等[10]在对609例RA患者进行病例对照研究中发现,经控制各种混杂因素后,RA患者与正常对照相比,明确的感染约增加70%,而需要进行住院治疗的感染增加85%。我们发现,大多数RA患者这些感染主要累及呼吸道、泌尿道和皮肤软组织,而此前类似研究结果表明,医院感染主要发生在下呼吸道、血液和泌尿道[11]。结果的不同可能缘于不同人群所处环境和遗传背景的差异。
RA患者医院感染病原学特征表明,大多数是细菌感染,也有部分为机会性感染,与此前报道相一致[12-14]。该结果可能反映了在临床上抗菌药物广泛应用,导致耐药性病原体不断出现。据报道,常见的医院感染耐药病原体主要为MRSA、产ESBLs革兰阴性杆菌和耐万古霉素肠球菌[5]。我们研究结果表明,RA患者医院感染的主要耐药革兰阴性杆菌,包括大肠埃希菌、铜绿假单胞菌、鲍曼不动杆菌和肺炎克雷伯菌,其中铜绿假单胞菌一直备受关注[15-16]。在本研究中,我们共分离出40株铜绿假单胞菌,其中多数对阿米卡星、头孢哌酮-舒巴坦和头孢吡肟敏感,但仍有35.3%菌株对常用抗菌药物耐药,甚至耐碳青霉烯类抗生素,提示治疗RA患者铜绿假单胞菌医院感染经验用药时,应更予关注。本组患者中,大肠埃希菌产ESBLs率明显低于其他人群。产ESBLs大肠埃希菌对头孢曲松和环丙沙星耐药率高,但对阿米卡星和头孢哌酮-舒巴坦等抗生素敏感性较好。因此,治疗RA患者医院感染时,应依据病原微生物分离及药敏试验结果,尽量避免经验用药。
我们发现RA患者革兰阳性菌所致医院感染,与其他研究报告略有不同[17-18]。MRSA和MRCNS是常见的医院感染病原菌,在RA患者中MRSA所占比例略低,并且未能分离出耐万古霉素菌株。我们在本研究中也未能分离出耐万古霉素肠球菌[17-18]。据报道,结核分枝杆菌所致的医院感染在RA患者中较为常见[19-20],但本研究只分离出8株结核分枝杆菌,并且所有患者均未经异烟肼预防治疗。皮肤带状疱疹病毒是医院感染中最常见病毒种类,RA患者带状疱疹的发病率为9.96例/1 000患者年,是一般人群的2至5倍,原因可能与免疫抑制治疗有关[21]。据报道,除甲氨蝶呤外,环磷酰胺、硫唑嘌呤、泼尼松、来氟米特和部分非甾体类抗炎药物,是诱发带状疱疹感染的危险因素[22]。本研究中8例带状疱疹感染患者,此前均接受过环磷酰胺冲击治疗。
此前有研究表明,RA患者医院感染风险是年龄和性别均匹配的健康对照者的2倍左右[23],其原因可能与RA患者自身的遗传缺陷、免疫功能混乱和治疗药物有关。首先,有研究发现RA患者白细胞衰老加速,特别是T细胞[24],该异常可以解释RA患者医院感染易感性增高,甚至于开始免疫抑制治疗前。其次,由于原发病的活动,在治疗过程中应用大剂量激素及免疫抑制剂等因素也增加RA患者医院感染发病率。另外,患者老龄化、部分肺部疾病和糖尿病等慢性基础病的存在,也是RA患者易发医院感染的独立危险因素[25]。
RA患者由于疾病本身的遗传缺陷、免疫混乱等增加了医院感染的发生率,特别是机会性感染多较严重且致命,尤其是对于那些应用大剂量激素及免疫抑制剂治疗的RA患者。本研究描述了活动性RA患者医院感染发病率、常见感染类型及病原学特征,使我们易于与其他风湿性疾病患者医院感染进行比较,为进一步研究提供参考依据。
[1] Greenberg JD,Reed G,Kremer JM,et al.Association of methotrexate and tumour necrosis factor antagonists with risk of infectious outcomes including opportunistic infections in the CORRONA registry[J].Ann Rheum Dis,2010,69(2):380-386.
[2] Simon TA,Askling J,Lacaille D,et al.Infections requiring hospitalization in the abatacept clinical development program:an epidemiological assessment[J].Arthritis Res Ther,2010,12(2):R67.
[3] Smitten AL,Choi HK,Hochberg MC,et al.The risk of hospitalized infection in patients with rheumatoid arthritis[J].J Rheumatol,2008,35(3):387-393.
[4] Hacek DM,Suriano T,Noskin GA,et al.Medical and economic benefit of a comprehensive infection control program that includes routine determination of microbial clonality[J].Am J Clin Pathol,1999,111(5):647-654.
[5] Spelman DW.Hospital-acquired infections[J].Med J Aust,2002,176(6):286-291.
[6] Arnett FC,Edworthy SM,Bloch DA,et al.The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis[J].Arthritis Rheum,1988,31(3):315-324.
[7] Prevoo ML,van’t Hof MA,Kuper HH,et al.Modified disease activity scores that include twenty-eight-joint counts.Development and validation in a prospective longitudinal study of patients with rheumatoid arthritis[J].Arthritis Rheum,1995,38(1):44-48.
[8] 中华人民共和国卫生部.医院感染诊断标准(试行)[J].中华医学杂志,2001,81(5):314-320.
[9] Von Graevenitz A.The role of opportunistic bacteria in human disease[J].Rev Microbiol,1997,31:447-471.
[10] Doran MF,Crowson CS,Pond GR,et al.Frequency of infection in patients with rheumatoid arthritis compared with controls:apopulation-based study[J].Arthritis Rheum,2002,46(19):2287-2293.
[11] Díaz-Lagares C,Pérez-Alvarez R,García-Hernández FJ,et al.Rates of,and risk factors for,severe infections in patients with systemic autoimmune diseases receiving biological agents off-label[J].Arthritis Res Ther,2011,13(4):R112.
[12] Geri G,Dadoun S,Bui T,et al.Risk of infections in bronchiectasis during disease-modifying treatment and biologics for rheumatic diseases[J].BMC Infect Dis,2011,11:304.
[13] Olson TC,Bongartz T,Crowson CS,et al.Histoplasmosis infection in patients with rheumatoid arthritis,1998-2009[J].BMC Infect Dis,2011,11:145.
[14] Salmon-Ceron D,Tubach F,Lortholary O,et al.Drug-specific risk of non-tuberculosis opportunistic infections in patients receiving anti-TNF therapy reported to the 3-year prospective French RATIO registry[J].Ann Rheum Dis,2011,70(4):616-623.
[15] Hani A,Masaadeh,Adnan S,et al.Incident of pseudomonas aeruginosa in post-operative wound infection[J].Am J Infect Dis,2009,5(1):1-6.
[16] Andreasen JJ,Korsager B,Alstrup P,et al.Postoperative wound infection:indicator of clinical quality?[J].Dan Med Bull,2002,49(3):242-244.
[17] Zhu DM,Zhang YY,Wang F,et al.Surveillance of bacterial resistance from hospitals in Shanghai in 2008[J].Chin J Infect Chemother,2009,9(6):401-410.
[18] Wen XM,Ren N,Wu AH,et al.Antimicrobial resistance of bacteria and changing trend in China Nosocomial Infection Surveillance System[J].Chin J Infect Control,2009,8(6):389-396.
[19] Tubach F,Salmon D,Ravaud P,et al.Risk of tuberculosis is higher with anti-tumor necrosis factor monoclonal antibody therapy than with soluble tumor necrosis factor receptor therapy:The three-year prospective French Research Axed on Tolerance of Biotherapies registry[J].Arthritis Rheum,2009,60(7):1884-1894.
[20] Dixon WG,Hyrich KL,Watson KD,et al.Drug-specific risk of tuberculosis in patients with rheumatoid arthritis treated with anti-TNF therapy:results from the British Society for Rheumatology Biologics Register (BSRBR)[J].AnnRheum Dis,2010,69(3):522-528.
[21] Kim SY,Solomon DH.Tumor necrosis factor blockade and the risk of viral infection[J].Nat Rev Rheumatol,2010,6(3):165-174.
[22] McDonald JR,Zeringue AL,Caplan L,et al.Herpes zoster risk factors in a national cohort of veterans with rheumatoid arthritis[J].Clin Infect Dis,2009,48(10):1364-1371.
[23] Doran MF,Crowson CS,Pond GR,et al.Frequency of infection in patients with rheumatoid arthritis compared with controls:apopulation-based study[J].Arthritis Rheum,2002,46(9):2287-2293.
[24] Goronzy JJ,Weyand CM.Rheumatoid arthritis[J].Immunol Rev,2005,204:55-73.
[25] Curtis JR,Patkar N,Xie A,et al.Risk of serious bacterial infections among rheumatoid arthritis patients exposed to tumor necrosis factor alpha antagonists[J].Arthritis Rheum,2007,56(4):1125-1133.
