夏枯草乙醇提取物体外诱导肺癌细胞A549凋亡的研究
2014-08-20朱劲华贾晓斌江苏建康职业学院南京009江苏省中医药研究院南京0097
朱劲华,贾晓斌,张 威*(.江苏建康职业学院,南京 009;.江苏省中医药研究院,南京 0097)
随着环境污染的日益严重,肺癌的发生率和死亡率也急剧上升,成为人类健康的头号杀手。目前,对肺癌最常用的保守治疗方式还是放、化疗,由于存在严重的耐药性和机体损伤,疗效甚微。而抗肿瘤中药不易产生耐药性,对机体的损伤较小。因此,从传统中药中寻找高效、低毒的抗肿瘤药物具有非常重要的意义。
夏枯草为唇形科植物夏枯草(PrunellavulgarisL.)的干燥果穗,含有多种药理活性成分,主要包括萜类及其皂苷类、黄酮类、香豆素类、有机酸类、苯丙素类、挥发油、糖类等成分,具有清火、明目、散结、消肿之功效[1-2]。现代临床和药理研究表明,夏枯草具有广泛的抗肿瘤作用[3],能抑制淋巴瘤[4-5]、结肠癌[6]、胰腺癌[7]、膀胱癌[8]、肺癌[9]等多种肿瘤细胞的增殖。但关于夏枯草是如何诱发肺癌细胞凋亡的,能否抑制肺癌细胞的迁移,作者未见有相关报道。本研究选用江苏地产夏枯草的干燥果穗为实验材料,制备其乙醇提取物,以人肺癌细胞系A549为靶细胞,研究夏枯草乙醇提取物对肺癌细胞体外生长、迁移、细胞周期及凋亡的影响,旨在探讨江苏地产夏枯草乙醇提取物在肺癌临床治疗中的药物价值,并为进一步研究其作用机制提供依据。
1 仪器与材料
1.1仪器 索氏提取仪(上海启前电子科技有限公司);BUCHI Rotavapor R-220旋转蒸发仪(瑞士);DZF-6051型真空干燥箱(上海精宏实验设备有限公司);倒置显微镜(Olympus,日本);酶标仪(Bio-TEK,美国); FACScaliber流式细胞仪(BD Biosciences, 美国)。
1.2材料 江苏地产夏枯草(Spicaprunellae,购于山农,经鉴定);人类肺癌细胞株A549源自ATCC (美国模式培养物集存库),由本实验室保存和培养;细胞培养基为DMEM培养基(Hyclone, 美国);胎牛血清(Hyclone, 美国);Annexin-V FITC和PI双染试剂盒(Invitrogen,美国)。
2 方法
2.1夏枯草乙醇提取物的制备 取夏枯草500 g,分批加10倍量的乙醇回流提取2次,每次2 h,过滤;残渣再用10倍量的体积分数60%的乙醇回流提取2次,每次2 h,过滤;合并滤液并浓缩成浸膏, 60 ℃减压干燥,并制成冻干粉。将药物粉末溶于无水乙醇中,配成母液质量浓度为5 g·L-1,并于4 ℃冰箱中避光保存。使用时,按照梯度稀释法用相应的完全培养基稀释成所需质量浓度,现配现用。
2.2肿瘤细胞的培养 A549肿瘤细胞生长的培养基为DMEM(含体积分数10%的胎牛血清,100 mg·L-1链霉素,100 u·mL-1青霉素),置于体积分数5%的CO2、37 ℃、饱和湿度的培养箱中培养至对数生长期。
2.3MTT法检测肿瘤细胞的存活率 取对数生长期的肺癌A549细胞(稀释为8×103个·mL-1),按每孔100 μL接种到96孔培养板中,设置空白组、对照组和9组含不同质量浓度的夏枯草的实验组(夏枯草的终质量浓度分别为1.0,1.5,2.0,2.5,3.0,3.5,4.0,4.5和5.0 mg·L-1),每组设5个复孔。培养12,24和48 h,分别用MTT法检测每孔的吸光度(A值)。按下式计算细胞在不同夏枯草质量浓度作用下的存活率。
细胞存活率=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%
2.4细胞克隆形成实验 将不同质量浓度夏枯草(终质量浓度分别为1.0,2.0和4.0 mg·L-1)处理24 h的贴壁细胞计数后,分别接种至60 mm培养皿中,每组设3个平行样,并继续培养2~3周。待培养皿中出现肉眼可见的小克隆点时终止培养,弃上清,用PBS洗涤2次,加入甲醇3 mL,固定30 min,去固定液,加入3 mL Giemsa染色应用液染色30 min,洗去染色液,空气干燥。在显微镜下计数大于或等于50个细胞的克隆数,计算各剂量组的克隆形成率(克隆形成率=克隆数/接种细胞数×100%)以及存活率。
细胞存活率=(某剂量的克隆形成率/该剂量下种植的细胞数×对照组克隆形成率)×100%。
2.5倒置显微镜观察A549细胞形态的变化 取对数生长期的A549细胞(8×103个·mL-1)100 μL接种到96孔培养板中,设空白对照组(加100 μL培养液)和不同质量浓度的夏枯草实验组(终质量浓度分别为1.5,3.0和4.0 mg·L-1)。细胞培养24 h时,利用倒置显微镜观察并拍照。
2.6细胞划痕实验观察A549细胞迁移能力的变化 将细胞密度为5×105个·mL-1的A549细胞铺于24孔板(每孔500 μL)上,加入含体积分数10%的胎牛血清的培养液培养,使形成单层细胞。用10 μL移液枪枪头在单层细胞上呈“一”字划痕,用PBS清洗3次,设空白对照组(加100 μLPBS)和夏枯草不同质量浓度的实验组(终质量浓度分别为0.5和1.0 mg·L-1),孵育24 h,换成含体积分数10%的胎牛血清的培养液,孵育24和48 h,用PBS清洗3次,在倒置显微镜下观察并拍照。
2.7流式细胞分析法检测细胞周期的变化 将对数生长期细胞以每孔2×105个的密度接种至6孔板中,每孔2 mL,培养24 h后,实验组用不同质量浓度的夏枯草乙醇提取物(终质量浓度分别为0.5,1.0和1.5 mg·L-1)处理24 h,对照组不加药。离心收集悬浮细胞,用体积分数70%的乙醇固定4 h,PBS洗涤2次。将细胞重悬于500 μL含300 μg·mL-1RNA酶的溴化丙啶(PI,10 μg·mL-1)溶液中,于冰上放置30 min,过滤,用FACSCaliber流式细胞仪和ModFit LTTM软件对每份样品的10 000个细胞的细胞周期分布进行计算。
2.8夏枯草诱导细胞凋亡分析 使用Annexin-V FITC和PI双染试剂盒分析夏枯草诱导细胞凋亡的作用。使用不同质量浓度的夏枯草乙醇提取物(终质量浓度分别为0,25和50 mg·L-1)孵育A549细胞48 h,用含有EDTA的胰蛋白酶消化细胞获得单细胞悬液。再用预冷的PBS洗涤后,每管加入1×binding buffer重悬细胞。用多聚甲醛固定,每管加入5 μL Annexin-V FITC和500 μL PI,混匀,避光孵育15 min。以400 μL 1×binding buffer重悬细胞,流式细胞仪(BD Biosciences,美国)检测。
3 结果
3.1夏枯草乙醇提取物对肺癌A549细胞的生长抑制作用 见图1。结果表明,夏枯草乙醇提取物对A549细胞生长抑制作用明显,不同质量浓度的夏枯草乙醇提取物对人肺癌A549细胞均有抑制作用,并随着药物剂量的增加,其抑制作用越明显;同时,夏枯草乙醇提取物处理的时间越长,其细胞抑制作用也越明显。夏枯草乙醇提取物抑制A549细胞生长的半数致死质量浓度,即IC50,分别约为4.3(12 h),3.6(24 h)和3.0 mg·L-1(48 h)。
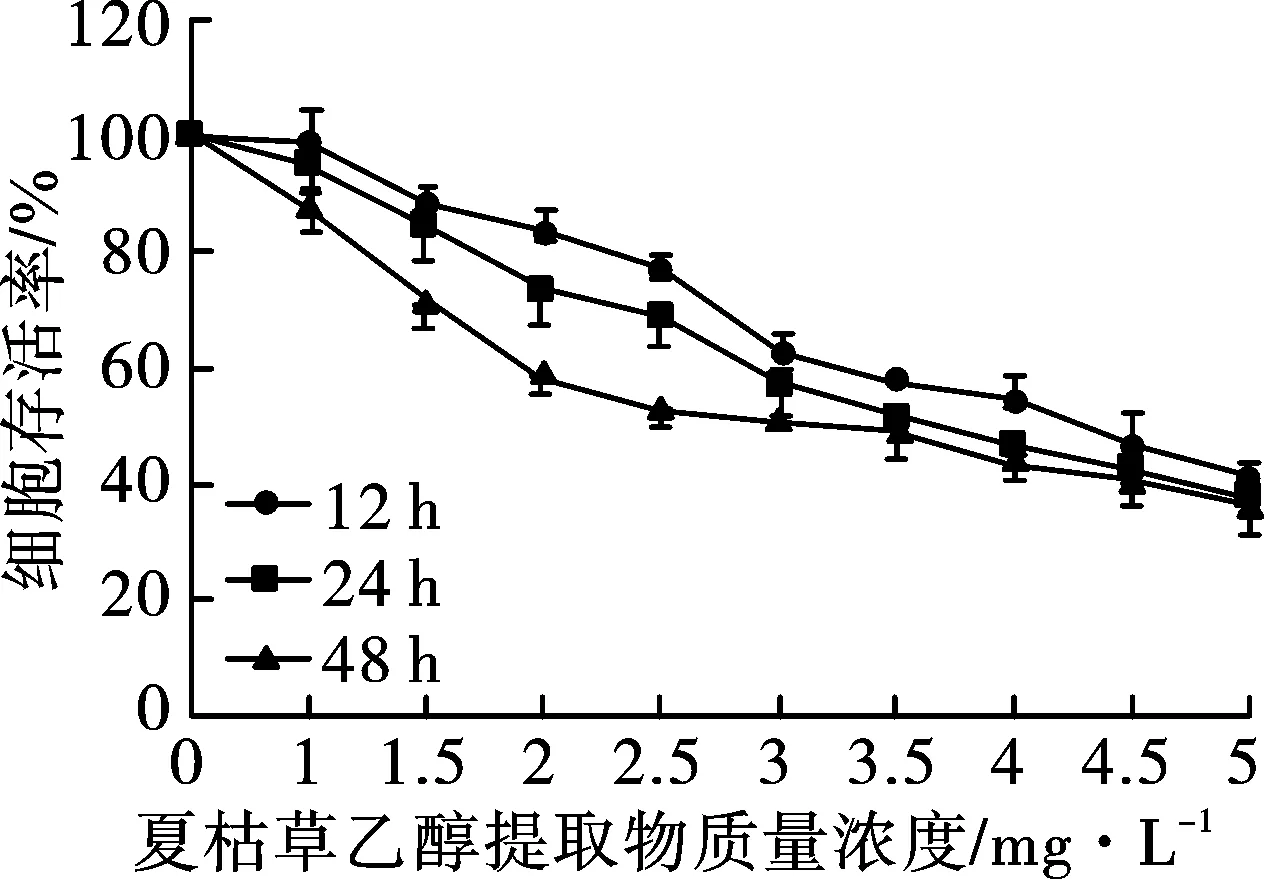
图1 MTT法检测的夏枯草乙醇提取物对肺癌A549细胞的抑制作用
细胞克隆形成实验结果亦证实:一定质量浓度的夏枯草乙醇提取物能显著抑制肺癌细胞的增殖能力,且1.0,2.0和4.0 mg·L-1夏枯草乙醇提取物处理组的细胞存活率分别为66.37%±1.30%,1.49%±0.03%和0。
由以上实验结果可知,夏枯草乙醇提取物具有明显的体外抗肿瘤作用,可明显抑制肺癌细胞的生长和增殖,且有显著的量效和时效关系。
3.2夏枯草乙醇提取物对肺癌A549细胞形态和生长密度的影响 见图2。由图2可知,与对照组相比,夏枯草乙醇提取物作用24 h后,A549的生长受到明显的抑制,且随着质量浓度的增加,抑制作用愈明显。具体表现为:终质量浓度为1.5,3.0和4.0 mg·L-1的夏枯草乙醇提取物对A549的生长有明显的抑制作用,终质量浓度为1.5 mg·L-1夏枯草乙醇提取物作用24 h后,与对照组相比,细胞密度明显减小,形态变化不明显;终质量度为3.0 mg·L-1夏枯草乙醇提取物作用24 h后,与对照组相比,细胞密度减小得更加明显,从形态上看大部分细胞变圆。终质量浓度为4.0 mg·L-1夏枯草乙醇提取物作用24 h后,与对照组相比,细胞密度减小得最为明显,从形态上看绝大部分细胞变圆。

图2 不同质量浓度的夏枯草乙醇提取物对肺癌A549细胞形态和生长密度的影响
3.3夏枯草乙醇提取物对肺癌A549细胞体外迁移能力的影响 细胞划痕实验结果如图3显示,0.5和1.0 mg·L-12种质量浓度的夏枯草乙醇提取物都能抑制肺癌A549细胞的体外迁移能力,且时间越长,抑制作用越明显。

图3 不同质量浓度夏枯草乙醇提取物对肺癌A549细胞体外迁移能力的影响
3.4夏枯草乙醇提取物对肺癌A549细胞周期的影响 为了进一步了解夏枯草乙醇提取物抑制肺癌细胞A549生长的作用机制,本实验还通过流式细胞仪对细胞周期进行检测,以观察不同质量浓度夏枯草乙醇提取物对肺癌细胞A549细胞周期的影响。
如表1结果所示,0.5 mg·L-1夏枯草乙醇提取物处理A549细胞24 h后,其G0/G1期细胞比例相比对照组有所增加,且这种改变经t检验分析,P<0.05,差异有统计学意义;而G2/M期及S期细胞比例虽较对照组,均有所下降,但经t检验分析后,P>0.05,差异无统计学意义。1.5 mg·L-1夏枯草处理组,与对照组和1 mg·L-1夏枯草处理组相比,其G0/G1期细胞比例明显上升,G2/M期细胞比例亦上升,同时伴随着S期细胞比例明显下降。以上结果表明,夏枯草乙醇提取物可诱导A549细胞发生G0/G1期或G2/M期细胞周期阻滞,其中低质量浓度(0.5 mg·L-1)表现为G0/G1期阻滞,中、高质量浓度(1和1.5 mg·L-1)时,随着夏枯草质量浓度的增高,其G0/G1期和G2/M期细胞阻滞愈明显。
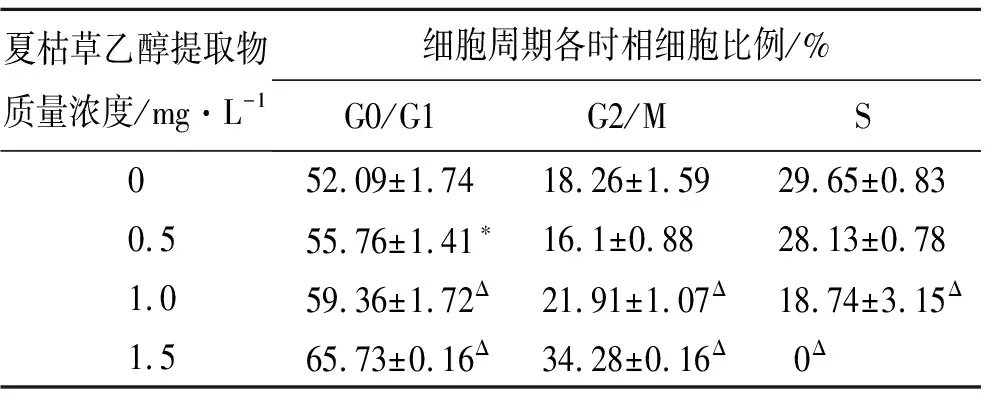
表1 不同质量浓度夏枯草乙醇提取物作用于肺癌A549细胞24 h后细胞周期的变化
周期阻滞的同时,随着夏枯草质量浓度的增高,其Sub G1峰比例亦呈明显上升趋势。如表2所示,0.5,1和1.5 mg·L-1夏枯草处理组的Sub G1峰比例分别为4.49%±0.13%,19.12%±1.78%和70.44%±3.14%,明显高于对照组(1.60%±0.55%),且各组间经统计,P<0.05,表明差异有统计学意义,呈现质量浓度依赖关系。
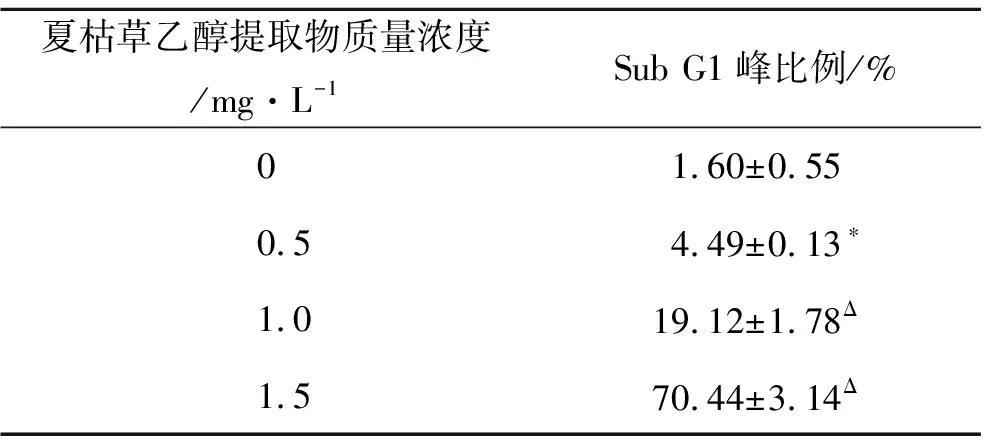
表2 不同质量浓度夏枯草乙醇提取物作用于肺癌A549细胞Sub G1峰比例的变化
3.5夏枯草乙醇提取物对肺癌A549细胞凋亡的影响 为进一步研究夏枯草乙醇提取物诱发的肺癌细胞凋亡过程,遂采用了磷脂酰丝氨酸外翻法进行细胞凋亡分析。Annexin V/PI双染法将细胞分成4种属性,其中Ⅰ象限(Annexin V-/PI+)为坏死细胞象限;Ⅱ象限(Annexin V+/PI+)为晚期凋亡细胞;Ⅲ象限(Annexin V-/PI-)为正常细胞象限;Ⅳ象限(Annexin V+/PI-)为早期凋亡象限。
通过检测发现,不同质量浓度夏枯草乙醇提取物(1.0,2.0和4.0 mg·L-1)作用A549细胞24 h,可诱导剂量依赖性地细胞凋亡,即随着药物剂量的增加,细胞发生凋亡的比例亦明显增加,且在低、中质量浓度(1.0和2.0 mg·L-1)时以晚期凋亡为主,高质量浓度(4.0 mg·L-1)时以早期凋亡为主。如表3所示,1.0,2.0和4.0 mg·L-1夏枯草处理组的凋亡率分别为12.08%±2.72%,51.88%±4.98%和77.62%±0.94%,明显高于对照组1.67%±0.21%,且各组间经统计,P<0.05,呈现显著质量浓度效应依赖关系。
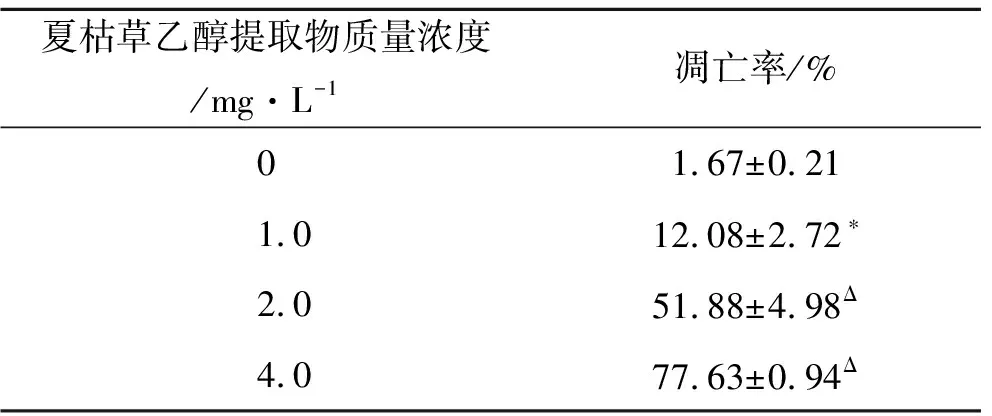
表3 不同质量浓度夏枯草乙醇提取物作用于肺癌A549细胞24 h后凋亡率的变化
4 讨论
肺癌是一种恶性程度很高的肿瘤,其特点是生长迅速,早期容易全身转移,发生率和死亡率已占据常见肿瘤的首位。目前,临床上多采用化疗加放疗相结合的方法进行治疗,但用此法治疗毒副作用大,患者难以坚持。因此,寻找疗效好而毒副作用低的药物是目前肿瘤治疗的主要方向之一。
本实验所用夏枯草干燥果穗来自江苏老山,且采取了优化的乙醇提取工艺,对体外肿瘤细胞的半数致死质量浓度远远低于国内外有关文献的报道[3-8],可见其乙醇提取物中的生物活性物质含量较高。已有文献报道,夏枯草中的槲皮素能诱导肝癌、鼻咽癌细胞的凋亡[10-11],本实验中抑制肺癌细胞A549增殖,诱导其凋亡的活性物质,还有待于进一步确定。
本实验结果还显示,低质量浓度(0.5 mg·L-1)的江苏夏枯草乙醇提取物对肺癌A549细胞就有非常明显的生长抑制作用,且能诱导A549细胞发生剂量依赖性地细胞周期阻滞,此外,随着夏枯草质量浓度的增高,其Sub G1峰比例呈明显上升趋势,表明夏枯草乙醇提取物可诱导A549细胞发生细胞凋亡。随着药物剂量的增加,细胞发生凋亡的比例亦明显增加,且在低、中质量浓度(1.0和2.0 mg·L-1)时以晚期凋亡为主,高质量浓度(4.0 mg·L-1)时主要发生早期凋亡。体外细胞划痕实验观察结果显示,低质量浓度(0.5 mg·L-1)的江苏夏枯草乙醇提取物对肺癌A549细胞的迁移能力也有明显的抑制作用,但由于实验经费的限制,未能使用Transwell法进行精确定量。
综上所述,本研究结果显示,江苏夏枯草乙醇提取物在体外可以抑制肺癌细胞A549的增殖和迁移作用,并诱导肿瘤细胞发生细胞周期阻滞,从而使细胞周期失控,导致细胞增殖停止,发生细胞凋亡,且具有明显的量效和时效关系。有文献报道,夏枯草诱导肿瘤细胞凋亡的信号通路可能是通过下调Bc1-2蛋白、上调Bax蛋白的表达实现的[12-13]。江苏夏枯草乙醇提取物诱导人肺癌细胞凋亡的信号通路,以及其能否抑制肺癌细胞体内侵袭转移,还有待于进一步研究。
参考文献:
[1] 顾晓洁,李友宾,李萍,等.夏枯草花穗化学成分研究[J].中国中药杂志,2007,32(10): 923-926.
[2] Cheung H Y,Zhang Q F.Enhanced analysis of triterpenes, flavonoids and phenolic compounds inPrunellavulgarisL. by capillary zone electrophoresis with the addition of running buffer modifiers[J]. J Chromatogr A, 2008, 12(13): 231-238.
[3] 孟歌,张可杰,张明智.夏枯草的化学成分和抗癌活性研究[J].西北药学杂志, 2007,22(4): 211-213.
[4] Harput U S, Saracoglu I, Ogihara Y. Effects of twoPrunellaspecies on lymphocyte roliferation and nitric oxide production[J]. Phytother Res,2006,20(1): 157-159.
[5] 付晓瑞,孙振昌,张明智.夏枯草提取物诱导B、T淋巴瘤细胞凋亡的实验研究[J].中药材,2012,35(3): 433-438.
[6] 陈畅辉,付强,雷彦刚.中药夏枯草对结肠癌细胞FasL基因表达和侵袭能力的影响[J]. 现代肿瘤医学,2009,17(6): 1034-1037.
[7] 宋玮,张炳太,万云杰,等.夏枯草注射液对胰腺癌细胞PANC-1凋亡的影响及机制研究[J].中外医疗,2012,24(3): 26-28.
[8] 张静,黄晶,张婧,等.中药夏枯草对人膀胱癌细胞FasL基因表达和侵袭能力的影响[J].现代生物医学进展,2010,10(14): 2628-2631.
[9] 裴慧,钱士辉.夏枯草中2个三萜类化合物的体外抗肿瘤活性研究[J].海峡药学,2011,23(3): 43-45.
[10]李安强,郭天康,李荣范,等.反义抑制Survivin表达对槲皮素诱导肝癌SSMC-7721细胞凋亡的影响[J].第四军医大学学报,2008,29(3): 227-230.
[11]张峰,崔永华,曹平.槲皮素对人鼻咽癌HEN1细胞系增殖抑制和诱导凋亡作用的研究[J].临床耳鼻咽喉头颈外科杂志,2007,21(24): 1136-1139.
[12]郑学芝,郑学海,李佳,等.夏枯草提取物对人食管癌Eca-109细胞增殖和凋亡的影响[J].中国食物与营养, 2012,18(9): 74-76.
[13]宋玮,张炳太,万云杰,等.夏枯草注射液对胰腺癌细胞PANC-1凋亡的影响及机制研究[J].中外医疗, 2012,24(7): 26-28.
