靶向抗肿瘤药物传递系统的制备与表征
2014-08-16单玲玲高贵珍曹稳根陈红玲
单玲玲,高贵珍,曹稳根,吴 超,陈红玲
宿州学院生物与食品工程学院,药物生物技术研究所,安徽宿州,234000
靶向抗肿瘤药物传递系统的制备与表征
单玲玲,高贵珍,曹稳根,吴 超,陈红玲
宿州学院生物与食品工程学院,药物生物技术研究所,安徽宿州,234000
紫杉醇作为抗恶性肿瘤临床药物具有较好的疗效,但由于紫杉醇具有结构复杂、难溶于水、生物利用度差等缺点,限制了其在临床上的应用。本实验将多种肿瘤细胞表面高表达受体的转铁蛋白作为药物传递系统“导向基团”,以精氨酸为连接转铁蛋白与紫杉醇药物的Linker,并用荧光染料FITC标记紫杉醇前药, 制备荧光标记的转铁蛋白-精氨酸-紫杉醇靶向传递系统(Tf-FITC-Arg-PTX),采用TLC示踪,LC-MS分子量鉴定,紫外分光光度法及SDS电泳进行表征,并用LPSA对制备的药物传递系统进行粒径大小的考察,实验结果证明已成功制备荧光标记的靶向抗肿瘤药物传递系统,且转铁蛋白在修饰前后其粒径大小没有明显的变化。
转铁蛋白;紫杉醇;荧光标记;表征
恶性肿瘤严重威胁着人类的生命健康,肿瘤的早期诊断与有效治疗是当前亟待解决的问题。临床一线抗癌化学药多数为细胞毒性药物,存在药物剂量-疗效依赖性,以增加剂量达到较好的药物疗效,这样加重了药物毒性反应,也限制药物的临床应用[1]。因此,如何利用靶向性药物传递系统提高抗肿瘤化学药物的局部浓度,减小全身毒副作用,一直是研究者的热门话题。
转铁蛋白(Transferrin, Tf)是一种结合铁的β-球蛋白,存在于脊椎动物体液及细胞中,包括血清转铁蛋白、卵转铁蛋白和乳转铁蛋白三种类型,其中血清所含转铁蛋白含量最多。血清转铁蛋白含有679个氨基酸残基,这为修饰蛋白表面提供众多的活性位点。转铁蛋白受体(Transferrin receptor,TfR)作为一种跨膜糖蛋白,在多种恶性肿瘤细胞表面(如乳腺癌、膀胱癌、肝癌、肺癌等细胞)都有高表达[2-3],且恶性肿瘤细胞表面转铁蛋白受体与配体的亲和力是正常细胞的10~100倍[4],因此,可利用转铁蛋白受体-配体的介导,将药物靶向传递到肿瘤部位,以提高药物局部浓度,降低药物的毒性。如Yeh等采用Schiff碱将转铁蛋白与抗肿瘤药物阿霉素结合,实验结果证明此药物传递系统可靶向性杀死白血病肿瘤细胞而对正常血细胞无毒性[5]。还有一些研究者将转铁蛋白作为脂质体给药系统的“导向基团”,实验结果表明该系统能减少药物的副作用,延长药物在肿瘤部位的滞留时间[6]。
随着分子影像学在肿瘤临床医学上的快速发展,众多新型分子影像技术被研发出来,其中最引人注目的是利用荧光标记技术制备出不同探针应用于肿瘤的早期诊断[7],监测体内分子的行为,成像运用的范围从细胞、组织发展到全身水平。荧光染料的种类繁多,常用的荧光染料有异硫氰酸荧光素(FITC)、羟基荧光素(FAM)、四氯荧光素(TET)等,本实验选用FITC作为标记靶向抗肿瘤药物传递系统的荧光染料,为进一步研究药物传递系统在体内的代谢途径提供实验平台。
本实验以转铁蛋白配体作为药物传递系统“导向基团”,用精氨酸连接转铁蛋白与紫杉醇,并用荧光染料FITC标记紫杉醇前药,制备荧光标记的靶向抗肿瘤药物传递系统。采用TLC在反应过程中示踪,LC-MS分子量鉴定,用紫外分光光度法初步鉴定此药物传递系统的合成,用SDS电泳法证明其结构的组成,使用LPSA研究转铁蛋白修饰前与修饰后粒径大小的变化,为下一步的细胞和动物实验打下基础。
1 实验部分
1.1 试剂与仪器
血清转铁蛋白、紫杉醇、精氨酸、荧光染料FITC购买于sigma公司。ZS-紫外分析摄影仪器180(中国远明公司),Lambda 35型紫外分光光度仪(上海分析仪器厂),Zetasizer 3000HSA激光粒度仪(英国马尔文仪器有限公司)
1.2 精氨酸-紫杉醇(Arg-PTX)的合成
称取100 mg(0.117 mmol)PTX溶于15 mL的DCM,同时加入113.9 mg (0.140 4 mmol)Fmoc-Arg(pbf)-OH和14.29 mg DMAP(0.117mmol),将44.85 mg(0.234 mmol,2 eqv)EDC溶于10mL DCM中,在冰浴条件下,将10 mL的EDC溶液缓慢滴入PTX反应体系中,大约25 min滴加完毕,除去冰浴,室温下搅拌22 h。待反应完后,用同体积的DCM稀释,然后用同体积的蒸馏水洗2次,加入无水硫酸镁干燥,真空旋蒸后得晶状体产物精氨酸-紫杉醇,其结构用LC-MS进行分子量鉴定。
1.3 FITC-精氨酸-紫杉醇(FITC-Arg-PTX)的制备
将精氨酸-紫杉醇溶于DMF中,加入0.01 mmol FITC, -4℃搅拌3h,将反应液经G25纯化,得到纯化的FITC-精氨酸-紫杉醇,用TLC鉴定。
1.4 转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统(Tf-FITC-Arg-PTX)的制备
先活化FITC-精氨酸-紫杉醇的羧基,加入DCC和NHS(摩尔比 FA∶DCC∶NHS = 1∶1.2∶2),避光50℃搅拌6 h,反应结束,反应液减压滤过副产物DCU。取上清液,用4倍的丙酮萃取活化的FITC-精氨酸-紫杉醇。然后将活化后的FITC-精氨酸-紫杉醇溶于2mL Tris缓冲液(10 mM,pH8.0),并加入1 mL含24 mg Tf的Tris溶液,-4℃搅拌6 h,将反应液经G15纯化,去除没有共价偶联的Tf和FITC-精氨酸-紫杉醇片段,得到纯化的转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统,-20℃储存备用。
1.5 转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统(Tf-FITC-Arg-PTX)的表征
1.5.1 转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统(Tf-FITC-Arg-PTX)的紫外吸收光谱分析
用紫外吸收光谱对合成的转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统进行初步表征, Tf、FITC、Arg和PTX的紫外吸收峰分别在260、347、220和227 nm处。用SDS-PAGE进一步考察转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统共价偶联的结构特征。
1.5.2 转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统(Tf-FITC-Arg-PTX)粒径大小的测定
转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统的粒径及分布情况,可通过马尔文粒度仪来测定,仪器测定的光源为He激光,检测波长为633 nm,检测角度为90°,粒径测定范围为2 nm~3 μm。
2 结果与讨论
2.1 精氨酸-紫杉醇前药(Arg-PTX)结构鉴定
纯化后的-NH2-Arg(pbf)-PTX用LC-MS分析,其质谱鉴定的结果与NH2-Arg(pbf)-PTX的理论分子完全一致,-NH2-Arg(pbf)-PTX:MS (ESI,m/z):1285.4([M+Na]+),如图1。证明已成功合成精氨酸-紫杉醇前药。
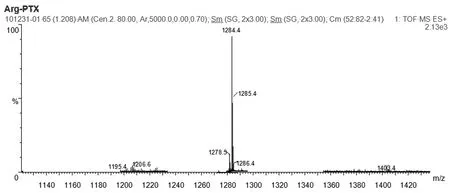
图1 精氨酸-紫杉醇前药用LC-MS的结构鉴定
2.2 FITC-精氨酸-紫杉醇(FITC-Arg-PTX)结构鉴定
图2显示,无论是在日光下还在荧光下,Arg-PTX和FITC-Arg-PTX在展开剂乙酸乙酯石∶油醚=3∶1时,所跑出点位置有明显的区别,这是由于Arg-PTX的-NH2与FITC-Arg-PTX结构中酰胺键极性不同所致,由此可证明FITC-Arg-PTX前药已成功的合成。在荧光下可以清晰地看到FITC-Arg-PTX前药中由标记物FITC发出的荧光,证明Arg-PTX已成功标记FITC。
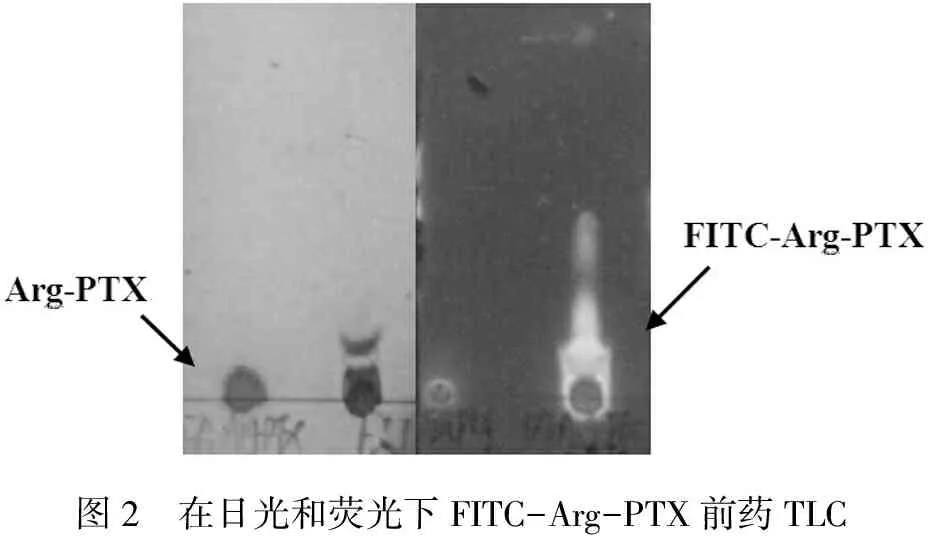
图2 在日光和荧光下FITC-Arg-PTX前药TLC
2.3 转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统(Tf-FITC-Arg-PTX)的紫外光谱和电泳图
纯化后Tf-FITC-Arg-PTX药物传递系统的结构用紫外吸收光谱进行初步鉴定。将纯化的Tf-FITC-Arg-PTX分别取一定的量溶于Tris buffer pH 8.0中,并用Tris buffer pH 8.0作为空白校正基线,从Tf-FITC-Arg-PTX化合物的紫外吸收光谱可以看到相应Tf、Arg、FITC和PTX的紫外吸收峰值分别在260、220、347和227 nm处,如图3(A)所示,实验结果表明成功地制备Tf-FITC-Arg-PTX药物传递系统。用纯化后的Tf-FITC-Arg-PTX化合物进行SDS-PAGE,以Tf作为Marker,跑出的Tf和Tf-FITC-Arg-PTX两个电泳条带在同一条直线上,说明用FITC-Arg-PTX修饰Tf,并没有影响Tf的分子量,这是因为Tf的分子量有76.5kD,FITC-Arg-PTX的分子量与其相比可以忽略不计。将SDS-PAGE电泳条带放在荧光下,可以看到FITC的荧光,进一步地证明FITC-Arg-PTX与Tf成功地共价偶联,如图3(B)所示。
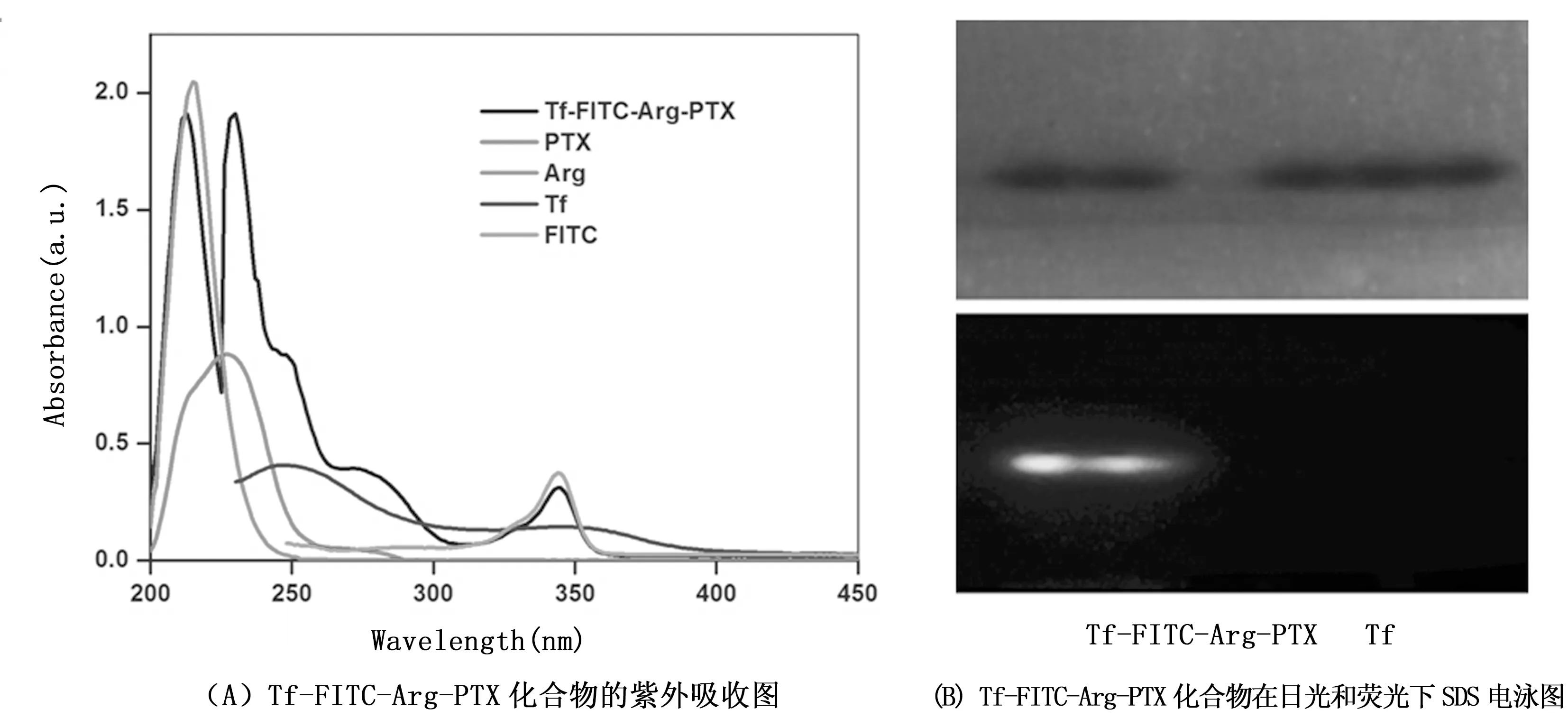
图3 表征Tf-FITC-Arg-PTX化合物
2.4 转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统(Tf-FITC-Arg-PTX)粒径的特征
对转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统修饰之后粒径变化的考察,主要是通过LPSA来衡量。Tf和Tf-FITC-Arg-PTX化合物的粒径分布经马尔文粒度仪测定,分别是(4.3±1.7)nm和(4.2±1.3)nm,表明两种蛋白颗粒的粒径没有差异,说明化学修饰法对Tf蛋白粒径大小没有影响。
3 结 论
本实验制备转铁蛋白-FITC-精氨酸-紫杉醇药物传递系统,并用荧光染料FITC标记紫杉醇药物传递系统,为下一步细胞和动物实验提供实验平台。实验结果显示已成功地合成紫杉醇靶向药物传递系统。
[1]Ten Tije AJ, Verweij J, Loos WJ, et al. Pharmacological effects of formulation vehicles:implications for cancer chemotherapy[J]. Clin Pharmacokinet,2013,42:665-685
[2]Sahoo SK,labhasetwar V.Enhanced Antiproliferative Activity of Transferrin-Conjugated Paclitaxel-Loaded Nanoparticles Is Mediated via Sustained Intracellular Drug Retention[J]. Mol Pharm, 2012,6:373-383
[3]Bicamumpaka C, PagéIn M. In vitro cytotoxicity of paclitaxel-transferrin conjugate on H69 cells[J].Oncol Rep,1998,5:1381-1384
[4]张莉,徐维平,苏育德,等.转铁蛋白-转铁蛋白受体在肿瘤主动靶向治疗中的应用[J].中国药业,2012(5):56-58
[5]Yeh C-JG, Faulk WP. Killing of human tumor cells in culture with adriamycin conjugates of human transferring[J]. Clin Immunol Immunopathol, 1984, 32:1-11
[6]Lin Wu,Jinhui Wu,Yuanyuan Zhou,et al.Enhanced antitumor efficacy of cisplatin by tirapazamine-transferrin conjugate[J].Int J Pharm, 2012,15:2253-2268
[7]张琳华,何颖娜,马桂蕾.叶酸靶向紫杉醇聚合物纳米囊泡的制备及其抗肿瘤活性研究[J].中国药学杂志,2010,45(22):1742-1748
(责任编辑:汪材印)
2014-10-12
安徽省自然科学基金项目(1308085MH136);安徽省教育厅自然科学重点研究项目(KJ2014A249,KJ2013A242)
单玲玲(1971-),女,安徽宿州人,博士,副教授,主要研究方向:肿瘤靶向探针及药物的合成。
10.3969/j.issn.1673-2006.2014.12.025
R914.2
A
1673-2006(2014)12-0085-03
