单纯罗哌卡因用于第一产程潜伏期硬膜外分娩镇痛的临床观察
2014-08-15董有静
邱 鹏,刘 坤,董有静
0 引言
硬膜外麻醉作为目前公认的最为有效和安全的分娩镇痛方法已被广泛应用。同时,低浓度罗哌卡因产生的运动感觉阻滞分离的特点也使之迅速成为了硬膜外分娩镇痛的首选局部麻醉药。多数分娩镇痛的实施开始于第一产程活跃期(宫口>3 cm),而从产妇开始出现规律宫缩到宫口≥3 cm的时间段为第一产程的潜伏期,初产妇潜伏期平均为6~8 h。这一阶段的疼痛虽不及活跃期明显[1],但仍会对产妇心理和生理产生不良影响。因此,从潜伏期开始镇痛能够提高产妇的满意度,减少疼痛刺激对母婴产生的不良影响。但硬膜外分娩镇痛(尤其是潜伏期开始镇痛)是否延长产程和增加剖宫产率及器械助产率仍然存在争议。早期研究显示,硬膜外分娩镇痛可能增加剖宫产率、器械助产率及延长产程[2-3]。但越来越多的研究表明,硬膜外分娩镇痛,尤其是潜伏期镇痛并不会对上述情况产生明显影响[4-6]。这些研究中,镇痛方案多为罗哌卡因配伍芬太尼,但芬太尼用于产妇是否绝对安全尚不能确定[7]。因此,本研究拟对潜伏期和活跃期单纯使用罗哌卡因进行硬膜外分娩镇痛的效果进行观察比较,为潜伏期镇痛的实施提供可行性依据和理想方案。
1 资料与方法
1.1 一般资料 选择90例经阴道分娩的单胎头位初产妇,经本院伦理委员会批准并签署分娩镇痛书面知情同意书。产妇孕周>36周,ASAⅠ~Ⅱ级,年龄23~35岁。产前检查正常范围,排除产科阴式分娩及椎管内麻醉禁忌证。所有产妇均自愿接受分娩镇痛,根据分娩镇痛时机及给药方案不同将产妇随机分为3组,即潜伏期A组(LA组)、潜伏期B组(LB组)及活跃期组(A组),每组30例。潜伏期组均在宫口<3 cm时进行分娩镇痛,活跃期组在宫口≥3 cm时实施分娩镇痛。
1.2 镇痛方法 所有产妇实施镇痛前,均进行心电监护及胎心监护,无异常情况时方可实施镇痛。LA组:当产妇进入产程,宫口<3 cm要求镇痛时,选择L3、L4间隙进行硬膜外穿刺,穿刺成功后向产妇头侧置入硬膜外导管4~5 cm。注射器回抽确认无血液及脑脊液回流后,给予1%利多卡因3 mL作为实验剂量。患者取仰卧位,观察5 min,确认无局麻药毒性反应及全脊髓麻醉后,硬膜外腔给予0.125%盐酸罗哌卡因8 mL作为负荷剂量。15 min后连接硬膜外自控镇痛(PCEA)泵,药物:0.125%罗哌卡因,剂量:95 mL,背景剂量:8 mL/h,PCA剂量为2 mL,锁定时间为15 min。LB组:除PCEA药物浓度为0.1%罗哌卡因外,其余设置与LA组完全相同。A组:产妇在宫口≥3 cm时实施分娩镇痛,操作及给药方案与LA组完全相同。三组镇痛均持续到第一产程末,于分娩结束后拔除硬膜外导管。
1.3 观察指标 ①疼痛评分:记录镇痛后即刻、5 min、15 min、25 min及宫口开大3 cm、宫口开全时的VAS评分(视觉模拟评分)。评分标准(0~10分):0分:无痛;≤3分:轻微疼痛;4~6分:疼痛且影响睡眠,尚能忍受;7~10分:疼痛剧烈,无法忍受。②运动神经阻滞程度:使用改良Bromage分级评分。0级:无运动神经阻滞;1级:不能直腿抬起;2级:不能弯曲膝关节;3级:不能弯曲踝关节。③记录产程时间、催产素使用情况、分娩方式及局麻药用量。④记录新生儿娩出后1 min、5 min的Apgar评分。⑤记录产妇不良反应发生情况:下肢麻木、恶心呕吐、低血压(低于基础血压20%以上)。⑥分娩后24 h随访产妇的镇痛满意度(优、良、一般、差)。
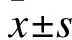
2 结果
2.1 三组产妇一般情况比较 三组产妇年龄、身高、体重、孕周比较差异无统计学意义(P>0.05),具有可比性。见表1。
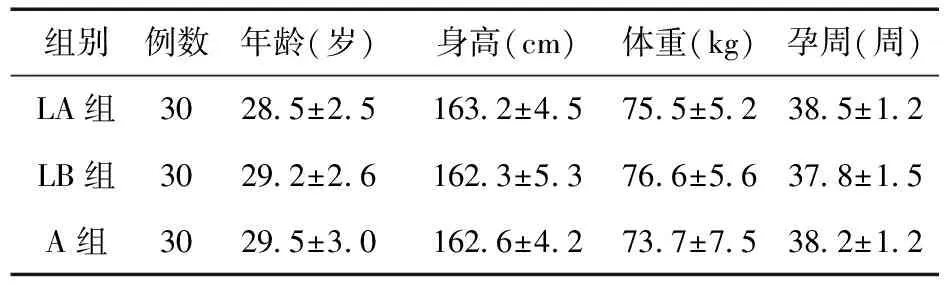
表1 三组一般情况比较
2.2 三组产妇VAS评分比较 三组VAS评分在镇痛后均降低,镇痛后5、15、25 min,三组VAS评分比较差异无统计学意义(P>0.05)。LA组、LB组在镇痛即刻及潜伏期(以宫口开大3 cm即刻)时VAS评分均低于A组(P<0.05)。宫口开全时,LA组、A组VAS评分均低于LB组(P<0.05),同时,此时间点LA组及A组VAS评分比较差异无统计学意义(P>0.05),见表2。
2.3 三组产程、缩宫素使用率、器械助产及剖宫产率比较 见表3。由表3可见,三组产程、缩宫素使用率、器械助产及剖宫产率比较差异无统计学意义(P>0.05)。
2.4 三组新生儿Apgar评分比较 三组新生儿1 min、5 min的Apgar评分比较差异无统计学意义(P>0.05),LB组镇痛满意度略低于其他两组(P<0.05),见表4。
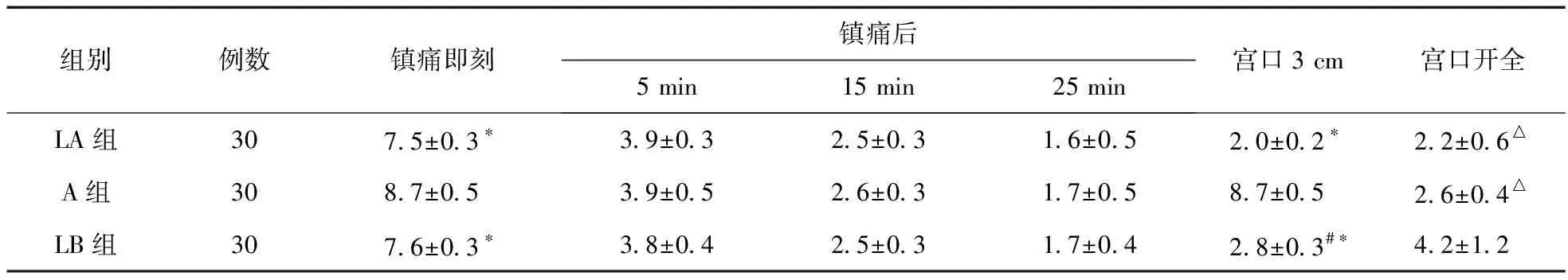
表2 三组各时点VAS评分比较
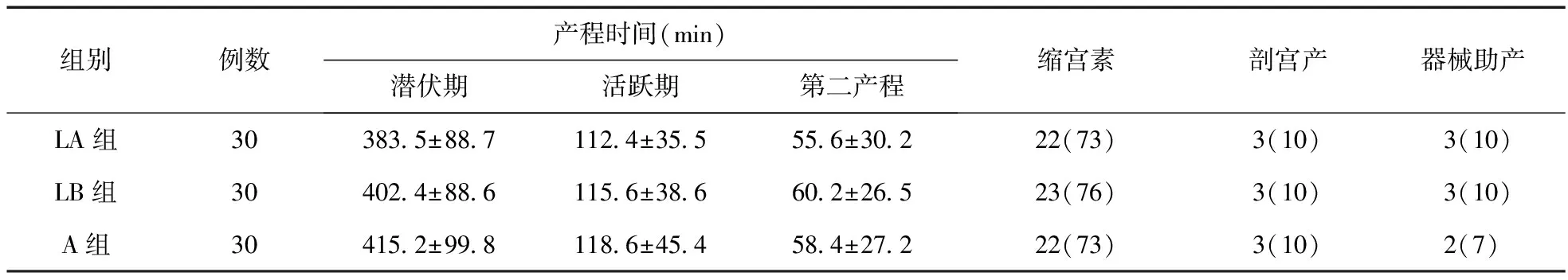
表3 三组产程、缩宫素使用、器械助产及剖宫产情况比较(例,%)
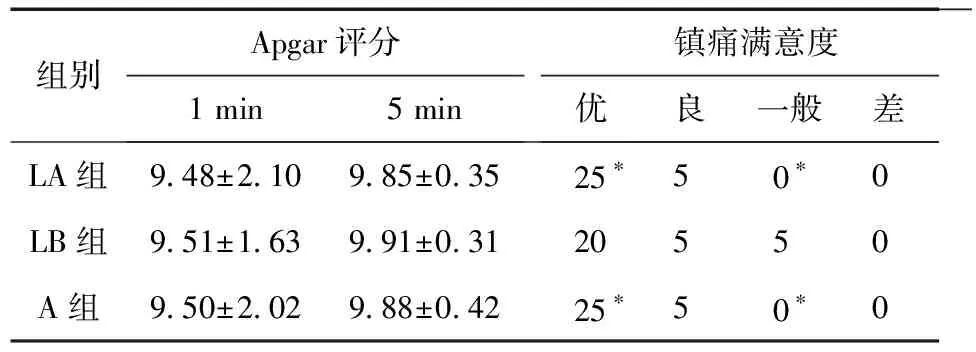
表4 三组新生儿Apagar评分及产后镇痛满意度比较
2.5 三组不良反应比较 三组产妇运动神经阻滞分级均为0级。LA组下肢麻木发生率高于其他两组(P<0.05),其他不良反应如低血压及恶心呕吐等三组比较差异无统计学意义(P>0.05)。
3 讨论
传统观点认为,分娩镇痛的最佳时机是在产妇第一产程活跃期(宫口≥3 cm)开始时,这样对产程的影响最小。初产妇第一产程一般为11~12 h,其中潜伏期平均为6~8 h。虽然有研究显示潜伏期疼痛强度弱于活跃期[1],但分娩疼痛对母婴产生的不良影响从产程一开始就已经出现,随着产程的延长,产妇应激反应更加明显。潜伏期不实施镇痛对母婴产生的不良损害将对整个分娩过程产生影响[8]。因此,潜伏期镇痛十分必要。2002年美国妇产科医师协会认为,应根据产妇意愿决定何时进行分娩镇痛[9]。
虽然有研究显示,硬膜外分娩镇痛可能增加剖宫产率、器械助产率及延长产程[2-3],但越来越多的研究表明,硬膜外分娩镇痛(尤其是潜伏期镇痛)并不会对上述情况产生明显影响[4-6,10]。Rogers等[11]比较了在宫口开大4 cm前后实施分娩镇痛后的结果,认为提早镇痛非但不会影响产程进展,甚至可以缩短总产程。这可能与实施镇痛后减轻了产妇的紧张情绪,减少了由于疼痛产生的应激,使宫缩更加规律有关。Hess等[12]认为,硬膜外镇痛会阻滞阴道、会阴神经,促使宫口扩张,便于胎先露下降,利于阴式分娩。本研究中,虽未观察到第一产程的缩短,但结果显示,潜伏期镇痛对产程、分娩方式、缩宫素使用率及器械助产率无明显影响,与很多国外研究结论一致。
Palm等[13]研究认为,硬膜外分娩镇痛时,罗哌卡因的最低有效浓度为0.13%,同时国内的一项回顾性研究显示,用浓度为0.1%的罗哌卡因进行PCEA分娩镇痛是有效的[14]。因此,在本研究中,罗哌卡因浓度设置为0.1%及0.125%。临床观察发现,硬膜外给予局麻药,尤其是给予负荷量后,子宫收缩会减少,这与局麻药的浓度、剂量及给药速度有关。因此,本研究采用低浓度罗哌卡因,同时,为了尽量减少局麻药用量,在潜伏期给药组中也通过降低药物浓度来减少其对子宫收缩的影响。结果表明,通过降低局麻药浓度(LB组)未能取得良好的镇痛满意度。LA组下肢麻木的主诉略高于LB组,可能与局麻药用量增多有关,但并不影响产妇的镇痛满意度。
硬膜外分娩镇痛的给药方案以低浓度局麻药配伍小剂量阿片类药物居多,阿片类药物的应用虽然能够加快分娩镇痛起效速度,降低局麻药最低有效浓度[12-17],但是其呼吸抑制、皮肤瘙痒等不良反应是否会对母婴产生不利影响尚无法确定。Moises等[7]报道,硬膜外应用芬太尼能很快转移到母体血液,并有90%迅速通过胎盘转运到胎儿,这就对胎儿产生了潜在的不利影响。因此,本研究单纯使用罗哌卡因作为硬膜外分娩镇痛的药物,规避了阿片类药物可能带来的不利影响,同时也取得了满意的镇痛效果。
综上所述,单独使用0.125%罗哌卡因以PCEA方式在潜伏期开始进行分娩镇痛不影响产程进展,不增加缩宫素使用、器械助产及剖宫产率,对新生儿Apgar评分无不良影响,减少了潜伏期疼痛刺激对母婴的不良影响,安全可靠,值得临床推广。
参考文献:
[1] Capogna G,Celleno D,Lyons G,et al.Minimum local analgesic concentration of extradural bupivacaine increases with progress of labour[J].Br J Anaesth,1998,80:11-13.
[2] Liu EH,Sia AT.Rates of caesarean section and instrumental vaginal delivery in nulliparous women after low concentration epidural infusions or opioid analgesia:systematic review[J].BMJ,2004,328(7453):1410.
[3] Marucci M,Cinnella G,Perchiazzi G,et al.Patient-requested neuraxial analgesia for labor:impact on rates of caesarean and instrumental vaginal delivery[J].Anethesiology,2007,106(5):1035-1045.
[4] Wang F,Shen X,Guo X,et al.Epidural analgesia in the latent phase of labor and the risk of cesarean delivery:a five-year randomized controlled trial[J].Anethesiology,2009,111(4):871-880.
[5] Wassen MM,Zuijlen J,Roumen FJ,et al.Eearly versus late epidural analgesia and risk of instrumental delivery in nulliparous women:a systematic review[J].BJOG,2011,118(6):655-661.
[6] Osuna-Zazueta MA,Jaime-Alejo FJ,Perez-Neri I.Early analgesia dose not block labor in first pregnancies[J].Gac Med Mex,2013,149(6):613-616.
[7] Moises EC,Barros DL,Carvalho CR,et al.Pharmacokinetics and transplacental distribution of fentanyl in epidural anesthesia for normal pregnant women [J].Euro J Clin Pharmaco,2005,61(7):517.
[8] Wong CA,Scavone BM,Peaceman AM,et al.The risk of casearen delivery with neuraxal analgesia given early versus late in labor[J].N Engl J Med,2005,352:665-667.
[9] ACOG Committee on Obstetric Practice.ACOG Committee opinion number 269 February 2002.Analgesia and cesarean delivery rates.American College of Obstetricians and Gynecologists[J].Obstet Gynecol,2002,99:369-370.
[10]易云飞.罗哌卡因联合舒芬太尼用于分娩镇痛的疗效观察[J].中国医药,2013,8(8):1157-1158.
[11]Rogers R,Gilson G,Kammerer Doak D.Epidrual analgesia and active management of labor:effects on length of labor and mode of delivery[J].Obstet Gynecol,1999,93:995-998.
[12]Hess PE,Pratt SD,Soni AK,et al.An association between severe labor pain and cesarean delivery[J].Anesth Analg,2000,90:881-886.
[13]Palm S,Gertzen W,Ledowski T,et al.Minimum local analgesic dose of plain ropivacaine vs.ropivacaine combined with sufentanil during epidural analgesia for labor[J].Anaesthesia,2001,56:526-529.
[14]Chen SY,Lin PL,Yang YM,et al.The effects of different epidural analgesia formulas on labor and mode of delivery in nulliparous women[J].Taiwan J Obstet Gynecol,2014,53(1):8-11.
[15]裴晓红,童成英.舒芬太尼联合罗哌卡因在硬膜外分娩镇痛中的应用及舒芬太尼适宜浓度探讨[J].实用医学杂志,2012,28(3):466-468.
[16]赵新.舒芬太尼联合罗哌卡因硬膜外麻醉在剖宫产术中的应用价值[J].中国医药,2013,8(8):1155-1156.
[17]Cherng CH,Yang CP,Wang CS.Epidrual fentanyl speeds the onset of sensory and motor blocks during epidural ropivacaine anesthesia[J].Anesth Analg,2005,101(6):1834.
