丹参酮ⅡA、苦参碱、川芎嗪对PC12细胞抗肿瘤活性的研究
2014-08-15胡增春胡慧敏吕慧怡程荔春何玉芳郝堂娜
马 辉,范 青*,胡增春,胡慧敏,吕慧怡,程荔春,何玉芳,张 策,郝堂娜
0 引言
PC12细胞是从大鼠肾上腺嗜铬细胞瘤克隆的细胞系,主要分泌产物为儿茶酚胺类递质,包括多巴胺、去甲肾上腺素等。因其具有可传代培养的特点,作为神经元细胞模型,广泛用于神经生理、病理及药理方面的研究,有助于阐明神经系统疾病的发病机制、药物疗效,探索新的药物与治疗手段[1]。
丹参酮ⅡA(Tanshinone ⅡA,TanⅡA)是丹参酮脂溶性成分的代表,药理作用极其广泛,包括抗氧化、抗炎、心肌保护、抗肿瘤等作用[2]。近年来,国内外学者对其抗肿瘤作用较为关注,发现TanⅡA对多种肿瘤细胞具有细胞毒性作用,能抑制肿瘤细胞增殖,可诱导肿瘤细胞分化和凋亡[3-4]。苦参碱(Matrine,Mat)作为一种传统的中药成分,在抗炎、抗心律失常方面有重要的应用价值。同时,苦参碱具有较广的抗瘤谱,对多种肿瘤细胞株及移植瘤有较高的抑制率[5-7]。川芎嗪(Ligustrazine,LZ)系从传统中药川芎中提取出来的有效生物碱成分,近年来,川芎嗪的抗肿瘤作用备受国内外研究者的关注,主要作用:逆转肿瘤细胞多药耐药(MDR)、免疫肿瘤、放疗增敏、化疗增效、抗肿瘤转移[8]。
大量文献表明,丹参酮ⅡA、苦参碱、川芎嗪均有抗肿瘤活性,并且具有逆转肿瘤细胞多药耐药的作用。其中,川芎嗪能抑制MDA-MB-231细胞的体外增殖,且抑制作用表现为时效和量效关系;并能通过阻滞细胞周期于G0/G1期,抑制乳腺癌细胞凋亡。苦参碱对人脑胶质瘤BT325细胞具有明显的增殖抑制和促进凋亡的作用[9]。丹参酮ⅡA 能够显著降低人胶质瘤细胞系U87迁移作用[10]。本试验主要研究丹参酮ⅡA、苦参碱、川芎嗪对于PC12细胞的抗肿瘤活性。
1 材料和方法
1.1 材料
1.1.1 细胞株 PC12细胞来源于大鼠肾上腺髓质嗜铬细胞瘤,由大连医科大学病理教研室提供,广泛用于神经系统疾病的体外研究。-80 ℃超低温冰箱中保存。
1.1.2 主要试剂 川芎嗪(南京泽朗医药科技有限公司)、丹参酮ⅡA(西安保赛天然产物科技有限公司)、苦参碱(西安保赛天然产物科技有限公司);胎牛血清(Hyclone公司)、PBS(北京中杉金桥公司)、DMEM(北京艾然生物科技有限公司)、MTT(北京索莱宝科技有限公司)、DMSO(Hyclone 公司)、NaHCO3(北京中杉金桥公司)、双抗(青霉素及链霉素溶液,Hyclone 公司)、胰酶(美国Sigma)。
1.1.3 主要仪器 CO2恒温培养箱(美国Thermo),台式高速冷冻离心机(美国Sigma),酶标仪(美国Sigma),电子天平(赛多利斯科学仪器北京有限公司),超净工作台(苏净集团安泰公司),倒置式生物显微镜(中国XD-101),自动涡旋混合器(天津药典标准仪器厂),溶剂过滤器(天津药典标准仪器厂),恒温水浴箱(江苏荣华仪器制造有限公司)。
1.2 方法
1.2.1 细胞复苏与培养 根据细胞的复苏“慢冻快融”的原则:取出冻存的PC12细胞株,迅速放入37 ℃恒温水浴箱内,将细胞面浸至水面以下不断摇动至融化,立即加入到配制好的DMEM培养基,置37 ℃、5%CO2培养箱中培养,24 h后换液1次,连续传代至对数生长期。
1.2.2 溶液的制备 丹参酮ⅡA溶液的制备:精密称取丹参酮ⅡA 50 mg溶于6 mL DMSO中,得8.33 mg/mL的母液,用DMEM培养液稀释得到浓度为20 μg/mL的溶液。置4 ℃冰箱中备用。苦参碱溶液的制备:精密称取苦参碱12.8 mg溶于4 mL DMEM培养液中,得到浓度为3.2 mg/mL的溶液,置4 ℃冰箱中备用。川芎嗪溶液的制备:精密称取川芎嗪12.8 mg溶于4 mL DMEM培养液中,超声使其溶解,得到浓度为3.2 mg/mL的溶液,置4 ℃冰箱中备用。MTT溶液的制备:精密称取MTT 40 mg,用8 mL PBS溶解,得到浓度为5 mg/mL的溶液,置4 ℃冰箱中避光保存。
1.2.3 细胞计数 ①盖好盖玻片:取一套血球计数板,将特制的盖玻片盖在血细胞计数槽上。②制备计数用的细胞悬液:用吸管吸取细胞悬液、锥虫蓝染液(0.4%)各1滴,吹均匀。③将细胞悬液滴入计数板:吸取少量吹匀的细胞悬液沿盖片边缘缓缓滴入,至盖玻片下充满悬液。④统计4个大格的细胞数:将血细胞计数板放于显微镜的低倍镜下,观察计数。⑤计算原细胞悬液的细胞数:按照下面公式计算细胞密度:细胞悬液的细胞数/mL=(4个大格子细胞数/4)×2×105。计算出细胞密度为9.28×106个/mL。
1.2.4 细胞铺板 取对数生长期细胞,用胰酶溶液(0.25%胰酶∶0.02%EDTA=1∶1,v/v)消化。将上述溶液用培养基稀释,使细胞悬液的细胞密度为9.28×106个/mL,分别取100 μL接种于96孔板中,孵箱中培养24 h。
1.2.5 MTT法测定[11]37 ℃培养后,弃上清液,加入待测药物,于37 ℃、5%CO2孵箱中培养24 h,弃上清液,加入含0.2 mg/mL MTT的无血清培养基后,继续培养4 h,弃上清,并加入20 μL DMSO溶解MTT甲臜沉淀,置摇床上低速振荡15 min,使结晶物充分溶解,混匀。在酶标仪492 nm处测量各孔的吸光度值A。抑制率=(A对照组-A给药组)/A对照组×100%。
1.2.6 体外药效学实验 用培养基将丹参酮ⅡA稀释至浓度分别为:67.95、33.98、16.99、8.49、4.25、2.12、1.06、0.53、0.27 nmol/mL。用培养基将苦参碱稀释至浓度分别为:12.89、6.44、3.22、1.61、0.81、0.40、0.20、0.10、0.05 μmol/mL。用培养基将川芎嗪稀释至浓度分别为:23.50、11.75、5.87、2.94、1.47、0.73、0.37、0.18、0.09 μmol/mL。
按照MTT法,测量各孔的吸光度值A,计算其抑制率,并用Origin软件计算IC50值。每个浓度3个样本,比较3种药物的IC50值,从而比较其抗肿瘤活性。
2 结果
2.1 细胞形态观察
2.1.1 丹参酮ⅡA对细胞形态的影响 PC12细胞经丹参酮ⅡA处理后,细胞凋亡情况见图1。如图1所示,与对照组相比,低浓度丹参酮ⅡA对细胞增殖有抑制作用。0.27 nmol/mL丹参酮ⅡA处理细胞后,胞体折光性好,突起明显;当用浓度为16.99 nmol/mL丹参酮ⅡA作用于PC12细胞时,显示典型的凋亡细胞形态学特征,核仁减少、固缩,折光性降低,核内异染色质明显增多,并沿核膜边沿聚集,胞质内充满大小不等的空泡;当丹参酮ⅡA浓度达67.95 nmol/mL时,细胞变圆离壁,突起减少,固缩,颗粒明显增多,部分细胞涨大破裂。
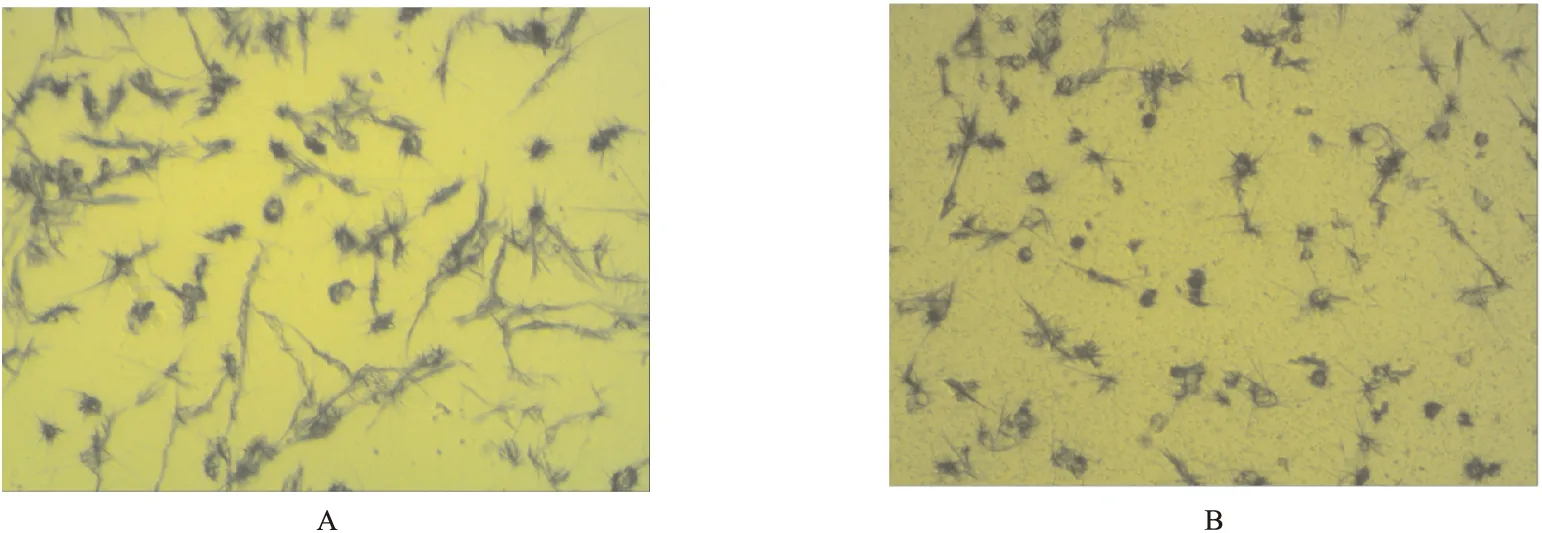
图1 丹参酮ⅡA对细胞形态的影响
2.1.2 苦参碱对细胞形态的影响 PC12细胞经苦参碱处理后,细胞凋亡情况见图2。由图2可见,与对照组相比,0.05 μmol/mL苦参碱处理细胞后,细胞形态好,胞体折光性好,突起明显;苦参碱浓度达3.22 μmol/mL时,细胞固缩,突起减少,胞浆内可见有颗粒,折光性减弱;当苦参碱浓度达12.89 μmol/mL时,细胞轮廓变模糊,变圆离壁,突起减少,变短,胞浆内颗粒明显增多。

图2 苦参碱对细胞形态的影响
2.1.3 川芎嗪对细胞形态的影响 PC12细胞经川芎嗪处理后,细胞凋亡情况见图3。如图3所示,与对照组相比,川芎嗪浓度<0.09 μmol/mL时,细胞形态无明显变化,轮廓清晰,胞体折光性好,细胞突起明显;11.75 μmol/mL川芎嗪作用于PC12细胞24 h后,即对其细胞增殖有抑制作用,细胞突起减少,细胞折光性减弱,胞浆内可见有颗粒;川芎嗪浓度达23.50 μmol/mL时,细胞轮廓变模糊,细胞变圆离壁,变短,部分细胞涨大破裂。
2.2 各给药组IC50值比较 各给药组IC50值结果见表1。细胞生长曲线见图4,由图4可知,这3种药物不同浓度时,都能有效抑制PC12细胞的增殖,且细胞生长率随着药物浓度的增加而增大。当丹参酮ⅡA的药物浓度≤0.27 nmol/mL时,药物对细胞的抑制作用不明显;随着药物浓度的增加其抑制作用增强,当药物浓度达23.21 nmol/mL时,其抑制率达50%。当苦参碱的药物浓度≤0.05 μmol/mL时,药物对于细胞的抑制作用不明显;当药物浓度达11.36 μmol/mL时,即能够将半数细胞杀死。当川芎嗪的药物浓度≤ 0.09 μmol/mL时,药物对细胞生长没有明显的抑制作用;当药物浓度达20.32 μmol/mL时,其抑制率达50%。通过这3种抗肿瘤药物的实验研究可知,丹参酮ⅡA与川芎嗪及苦参碱对比,具有显著的抗肿瘤活性。

表1 4种药物对PC12细胞株的抑制作用比较

图3 川芎嗪对细胞形态的影响
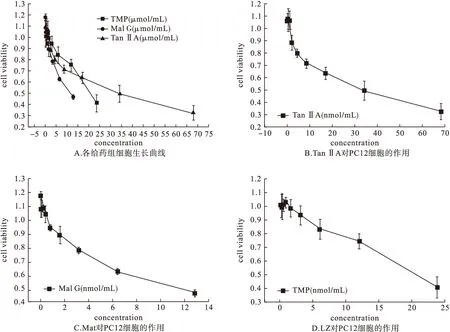
图4 细胞生长曲线
3 讨论
目前,恶性肿瘤的治疗方法仍然是以手术、化疗、放疗为主的综合治疗。临床常用的化疗药物主要是通过细胞毒作用杀伤肿瘤细胞,但由于大多数化疗药物毒性大,许多患者难以承受[12]。另一方面,某些肿瘤细胞因对化疗药物或放射线不敏感而导致治疗效果不理想。因此,临床急需开发毒性小、治疗效果好的抗肿瘤药物,可以降低患者死亡率及减小化疗药物的毒副作用,并提高其生活质量。近年来,许多中药单体具有非常好的抗肿瘤活性,而且毒副作用较小,其抗肿瘤作用机制除直接杀死肿瘤细胞之外,还与逆转肿瘤细胞多药耐药有关。
本试验应用MTT比色法观察丹参酮ⅡA、苦参碱、川芎嗪对PC12细胞生长的影响,通过丹参酮ⅡA与苦参碱及川芎嗪进行比较,三者的抗肿瘤活性比较差异有统计学意义(P<0.05),3种抗肿瘤药物的IC50值分别为23.21 nmol/mL、11.36 μmol/mL、20.32 μmol/mL,表明3种药物对PC12细胞都具有抗肿瘤作用,但由于川芎嗪和苦参碱只有在浓度很高时才能发挥明显的抑制作用,所以其毒性较大,安全范围小。丹参酮ⅡA主要用于冠心病、痤疮、痛经、失眠及抗菌消炎等非肿瘤疾病的治疗,近年研究发现,丹参酮ⅡA还具有很强的抗肿瘤活性,可能成为一种很有潜力的抗癌新药。丹参酮ⅡA在浓度很低时,即对肿瘤细胞的生长增殖具有较强的抑制作用,促进细胞凋亡,其浓度与抑制率呈明显的剂量依赖效应,随着浓度的增加其抑制作用增强。研究表明,丹参酮ⅡA的抗肿瘤作用主要表现在以下几个方面:细胞毒作用,对肿瘤细胞的诱导分化作用,诱导细胞凋亡的作用[13-14]。结合进一步的体内试验,包括血脑屏障试验、间质内疗法等,可为丹参酮ⅡA最终用于交感神经系统肿瘤患者提供充分的实验依据。
参考文献:
[1] Mouri K,Sako Y.Optimality conditions for cell-fate heterogeneity that maximize the effects of growth factors in PC12 cells[J].PLoS Comput Biol,2013,9(11):e1003320.
[2] 陈妹,张静,吴艳峰,等.丹参酮ⅡA磺酸钠的临床应用研究进展[J].中国医药,2012,7(2):253-254.
[3] Jung JH,Kwon TR,Jeong SJ,et al.Apoptosis induced by tanshinone IIA and cryptotanshinone is mediated by distinct JAK/STAT3/5 and SHP1/2 signaling in chronic myeloid leukemia K562 cells[J].Evid Based Complement Alternat Med,2013:805639.
[4] Su CC.Tanshinone IIA potentiates the efficacy of 5-FU in Colo205 colon cancer cells in vivo through downregulation of P-gp and LC3-II[J].Exp Ther Med,2012,3(3):555-559.
[5] 任莉莉,王晓稼.苦参碱抗肿瘤作用及其机制研究进展[J].中国医师杂志,2012,14(2):281-283.
[6] Zhou H,Xu M,Gao Y,et al.Matrine induces caspase-independent program cell death in hepatocellular carcinoma through bid-mediated nuclear translocation of apoptosis inducing factor[J].Mol Cancer,2014,13(1):59.
[7] Chang C,Liu SP,Fang CH,et al.Effects of matrine on the proliferation of HT29 human colon cancer cells and its antitumor mechanism[J].Oncol Lett,2013,6(3):699-704.
[8] Shao ZK,Li JW,Zhao ZH,et al.Effects of tetramethylpyrazine on nitric oxide/cGMP signaling after cerebral vasospasm in rabbits[J].Brain Reserch,2010,1361:67-75.
[9] 程光,章翔,费舟,等.苦参碱对BT325胶质瘤细胞的增殖抑制和诱导凋亡作用[J].第四军医大学学报,2002,23(23):2152-2154.
[10]Lu DY,Leung YM,Cheung CW,et al.Glial cell line-derived neurotrophic factor induces cell migration and matrix metalloproteinase-13 expression in glioma cells[J].Biochem Pharmacol,2010,80(8):1201-1209.
[11]Bao R,Shu Y,Wu X.Oridonin induces apoptosis and cell cycle arrest of gallbladder cancer cells via the mitochondrial pathway[J].BMC Cancer,2014,14(1):217.
[12]Zhang HT,Luo H,Wu J,et al.Galangin induces apoptosis of hepatocellular carcinoma cells via the mitochondrial pathway [J].World J Gastroenterol,2010,16:3377-3384.
[13]吴庆庆.丹参酮ⅡA对肺腺癌NCI-H460细胞增殖和凋亡的影响[J].实用医学杂志,2012,28(6):877-879.
[14]Hui Ma,Qing Fan,Jia Yu,et al.Novel microemulsion of tanshinone IIA,isolated from Salvia miltiorrhiza Bunge,exerts anticancer activity through inducing apoptosis in hepatoma cells[J].Am J Chin Med,2013,41(1):197-210.
