前列腺素E1的工艺优化
2014-08-15陈玉威张月辉董慧明
陈玉威,张月辉,董慧明
0 引言
前列腺素(PG)在体内由不饱和脂肪酸合成,结构为一个五环和两条侧链构成的20碳化合物。按其结构,前列腺素分为A、B、C、D、E、F、G、H、I等类型,而前列腺素E1是这个大家族的一员。前列腺素E1的化学名称为(11Α,13E,15S)-11,15-二羟基-9-氧代前列腺-13-烯-1-酸,PGE1为白色或淡黄色针状结晶,Mp115~116 ℃,比旋度为-61.6°(c=0.56,THF)。易溶于乙醚(ethyl)。现有技术中的前列腺素E1产品收率低,使用受到限制。为使更多患者能充分利用前列腺素E1所研制的各种品种,我们对前列腺素E1的提取工艺进行研究及优化的选择。
1 仪器与试剂
1.1 仪器 JJ-2(2003-61)组织捣碎匀浆机;JY98-ⅢDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);H-1850R台式高速冷冻离心机(长沙湘仪离心机仪器有限公司);pHSJ-2F型实验室pH计(上海精密科学仪器有限公司);旋转蒸发器RE-2000E(巩义予华仪器有限责任公司);BP211D型电子分析天平(北京赛多利斯仪器系统有限公司);日本岛津LC2010高效液相色谱仪;色谱柱:Diamonsil-C18柱(200 mm×4.6 mm,5 μm)。
1.2 试剂 氯化钾、枸橼酸、磷酸氢二钾、磷酸二氢钾、EDTA-2Na、氢氧化钾、氢醌、谷胱甘肽、丙酮、乙醚、石油醚(30~60 ℃)、盐酸、二氯甲烷、无水硫酸钠等,以上试剂均为分析纯。乙腈等试剂为色谱纯。二高-γ-亚麻酸(通河医药有限公司,纯度90%)、 绵羊精囊(黑龙江)。
2 制备方法研究
2.1 制备流程 羊精囊→(KCl,EDTA-Na2,pH8)→酶的混悬液→孵育(氢醌,谷胱甘肽,二高-γ-亚麻酸)→反应液→提取(丙酮,乙醚,二氯甲烷)→前列腺素粗品 →前列腺素E粗品(分离,硅胶柱)。
2.2 样品溶液的制备 酶的制备过程:取冷藏的羊精囊(-30 ℃)200 g,去除结缔组织和脂肪,加入0.154 mol/L氯化钾液200 mL,匀浆后,在10 000 r/min下离心10 min,取上清液,以双层纱布过滤,得清液。残渣再加氯化钾液,捣匀浆,离心过滤后,合并2次上清液。以2 mol/L枸橼酸调pH 5±0.2,于10 000转/min下离心15 min,弃除清液,用磷酸盐缓冲液(0.2 mol/L,pH=8)洗下沉淀,再加等量的 EDTA-2Na(6.25 μmol/L)溶液搅匀,以氢氧化钾(2 mol/L)调节pH 8±0.1,作为酶的混悬液。全部操作一定要在低温下进行。
孵育过程:取上述混悬液,加入氢醌8 mg和谷胱甘肽100 mg,首先用少量的水溶解氢醌和谷胱甘肽,再加入酶的混悬液中,再加入0.2 g二高-γ-亚麻酸,通氧搅拌,升温至37 ℃,并保温38 ℃孵育1 h,反应终止得反应液95 mL。按二高-γ-亚麻酸纯品质量计,酶促转化率为60%。
提取:将上述反应液加入300 mL丙酮搅拌提取1 h,过滤,滤渣用少量丙酮提取1次,合并滤液,进行旋转蒸发浓缩,除去丙酮。用盐酸(4 mol/L)调节浓缩液至pH 3,以40 mL乙醚分3次振摇提取,弃水层,取醚层,再用30 mL磷酸盐缓冲液 (0.2 mol/L)分3次振摇提取,每次10 mL,弃醚层取水层。用20 mL石油醚(30~60 ℃)分3次(10、5、5 mL)振摇脱脂,弃醚层取水层。再用盐酸(4 mol/L)调pH 3,用20 mL二氯甲烷分3次(10、5、5 mL)振摇提取,加少量无水硫酸钠脱水,密塞置冰箱内过夜,滤除硫酸钠后,在40 ℃以下减压浓缩得黄色油状物,得PGS粗品。
2.3 前列腺素E分离 每1 g PGS粗品需用15 g 100~160目的活化硅胶,混悬于三氯甲烷中,湿法装柱。将PGS溶解于少量三氯甲烷,上柱色谱分离,依次以三氯甲烷、V(三氯甲烷)∶V(甲醇)=98∶2、V(三氯甲烷):V(甲醇)=96:4的混合液洗脱,硅胶薄层色谱鉴定追踪,分别收集PGA和PGE部分。在35 ℃以下减压浓缩,除尽三氯甲烷、甲醇,得PGE粗品。
2.4 前列腺素E提取工艺 采用均匀设计法,选择影响酶转化的4个主要因素:孵育温度(A)、pH值(B)、提取时间(C)、通氧纯度(D)为考察指标,见表1。
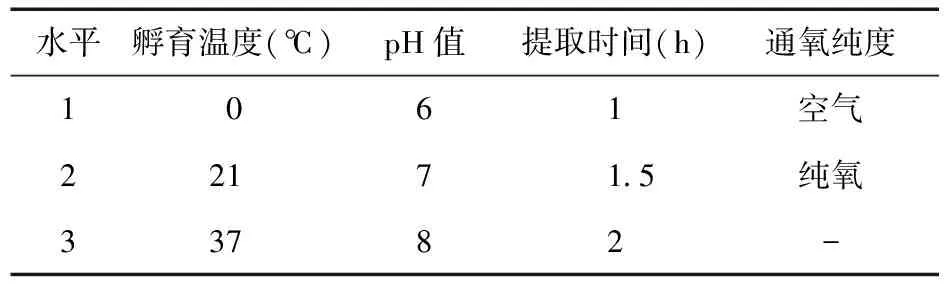
表1 试验因素水平表
3 薄层层析法初步定性分析
前列腺素E的初步定性分析可以使用薄层层析的方法。硅胶G板自然风干后,活化2 h,样品溶液用 20 μL的毛细管点板,并利用标准品作对照,在展开槽内直立上行展开,平行试验6组。待展开自然风干后,喷5%磷钼酸乙醇溶液显色剂显色,放烘箱中烘数分钟观察斑点特点,计算比移值Rf。
4 前列腺素E1的含量测定
4.1 色谱条件 检测波长:214 nm;流速:1.0 mL/min;流动相:乙腈:0.02 mol/L磷酸二氢钾(pH=4.9±0.5)=30∶70;色谱柱:迪马C18(200 mm×4.6 mm,5 μm);进样量:10 μL;理论塔板数:以前列腺素E1峰计算应不低于2 000。
4.2 对照品溶液制备 精密称取PGE1对照品0.5 mg,精密加入25%乙醇溶液5 mL,制成0.1 mg/mLPGE1溶液。精密吸取0.5 mL至5 mL容量瓶中,加25%乙醇溶液定溶至刻度,过0.22 μm 微孔滤膜,即得。
4.3 供试品溶液制备 精密称取自制PGE粗品0.1 mg,精密加入无水乙醇溶液1 mL,过0.22 μm 微孔滤膜,即得。
4.4 含量测定方法 精密量取供试品溶液10 μL,注入液相色谱仪中,按“4.4.1”项下条件操作,测定前列腺素E1吸收峰的峰面积积分值,计算前列腺素E1含量。 C样=A样×C对/A对
5 试验结果
5.1 展开剂的优选 实验选择不同种类及配比的溶剂体系作为展开剂,同时对样品和标准品进行展开,前列腺素E初步分析结果如表2所示。
通过表中可以看出,5号V(氯仿)∶V(甲醇)∶V(乙酸) =90∶5∶5是比较合适的展开剂,PGE1Rf值适中,单向一次薄层层析即能分离出4个以上颜色较深、集中而清晰可见的斑点,分离效果较理想。如图1。

表2 硅胶G板不同展开剂的薄层层析结果

图1 前列腺素E1初步分析薄层图
表3硅胶G板Rf值平行试验结果

第1组第2组第3组第4组第5组第6组平均值Rf0.470.450.470.460.450.450.45
5.2 正交试验结果 不同孵育温度、pH值、提取时间、通氧纯度的正交试验结果见表4。
直观分析:从表4可以直观看出,孵育温度、pH值、提取时间、通氧纯度对PGE1含量得率都有影响。PGE1提取条件的最优组合为:A3B3C2D2,即孵育温度37 ℃、pH值8、提取时间1 h、通氧纯度为纯氧。
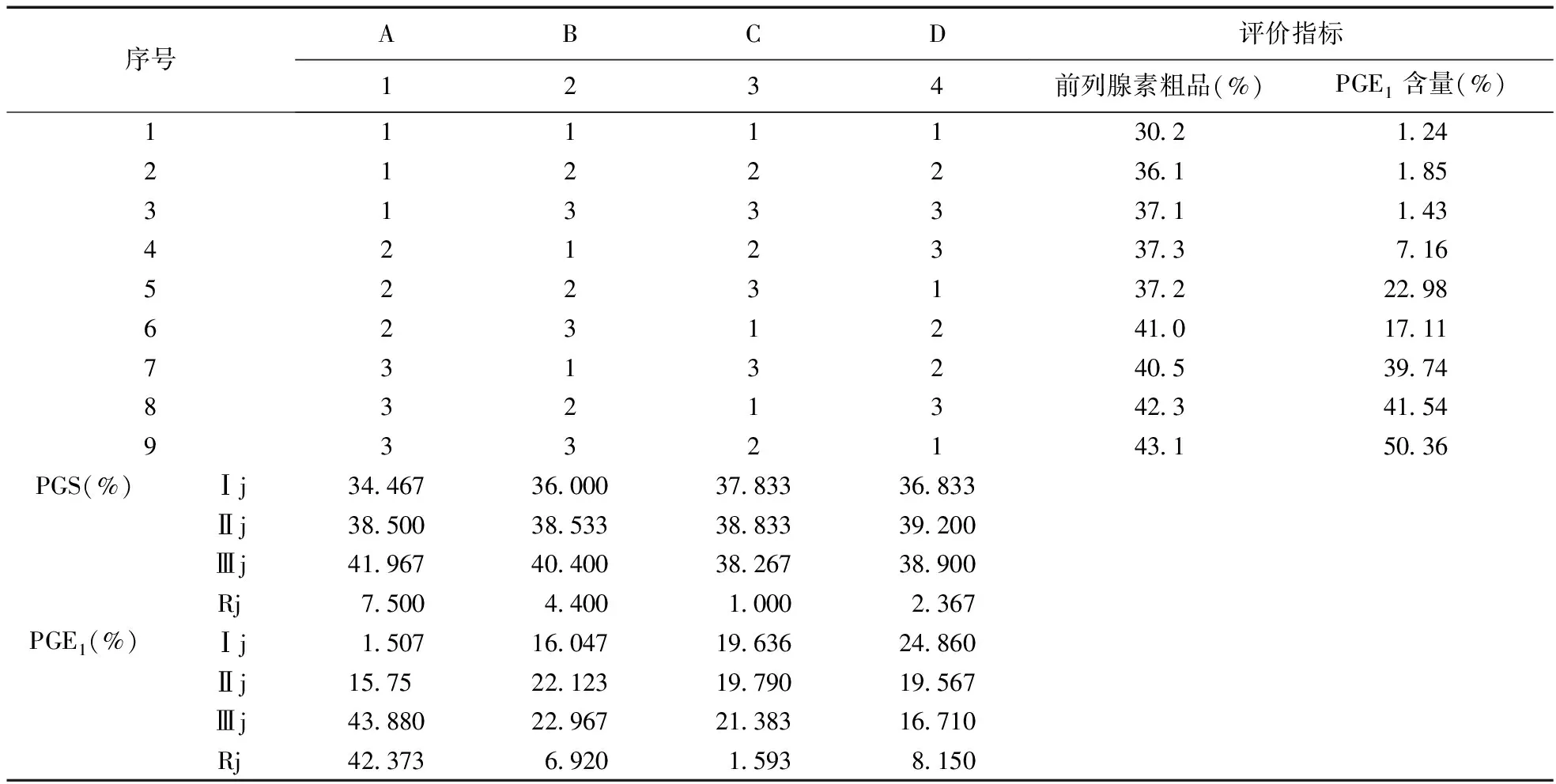
表4 L9(34)正交试验设计及结果分析表
方差分析:结果见表5和表6。表5 方差分析的结果表明,孵育温度有极显著性影响(P<0.05)。

表5 前列腺素粗品方差分析表
以前列腺素粗品为考察指标,表中极差R值大小显示,各因素主次为A>B>D>C;方差分析结果表明,A因素的影响具有极显著意义(P<0.01),B因素具有显著意义(P>0.05),D因素接近显著值,C因素的影响无显著意义,表明本实验设计较有意义。结合R水平,得出最佳提取工艺为A3B3C1D1最为合适。
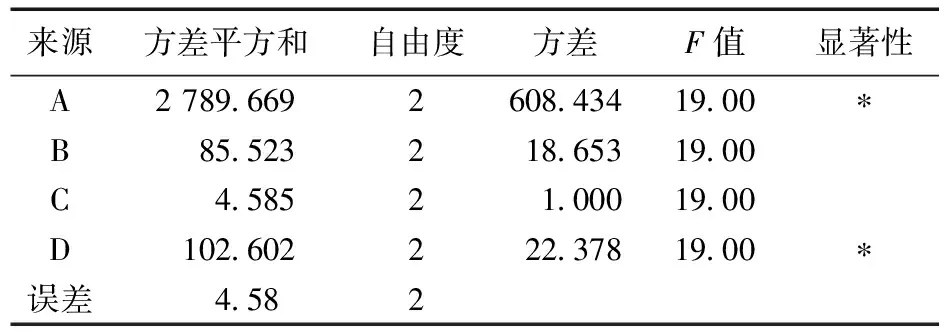
表6 PGE1含量方差分析表
以PGE1含量为考察指标,表中极差R值大小显示,各因素主次为A>D>B>C;方差分析结果表明,A因素的影响具有极显著意义(P<0.01),D因素的影响具有显著意义(P<0.05),B因素接近显著值,C因素无显著意义(P>0.05),表明本实验设计较有意义。结合R水平,得出最佳提取工艺为A3B3C1D1最为合适。
综合以上分析,C因素在两种考察指标中均无显著影响。参考实际工作需要,故确定A3B3C1D1为最终选择提取条件,即孵育温度37 ℃、pH值8、提取时间1 h、通氧纯度为纯氧。
5.3 验证试验 称取绵羊精囊5份,每份1 kg,以上述前列腺素E1最佳提取工艺进行提取。测得PGS粗品及PGE1含量,结果见表7。

表7 前列腺素粗品三批试验结果
前列腺素粗品平均值4.13 g,RSD=4.45%;前列腺素E1含量平均值为49.21%,RSD=4.22%,验证结果说明符合正交试验设计,该工艺稳定可行。
6 讨论
6.1 合成酶的选择及处理 前列腺素合成酶在动物组织中以绵羊精囊的含量最高,底物转化率达75%,兔肾髓质含41%,羊睾丸含18%。绵羊精囊易择取,好收集,速冷保存于-30 ℃~-20 ℃,放置半年不失其活力。由于前列腺素酶存在于细胞内质网膜微粒体中,需将精囊匀浆经离心后,得酶的制剂。
6.2 温度与pH选择 最适合温度37 ℃,绵阳精囊合成酶系最适pH 8。pH缓冲液以乙二胺四乙酸二钠(EDTA-2Na)为最佳,一般在10 min已趋于完成反应。
6.3 孵育条件的影响 孵育条件对PG的产生影响很大,孵育液中加入谷胱甘肽能显著地增加PGE1的产率,同时对PGF的形成起抑制作用。其他含硫基化合物如半胱氨酸、高半胱氨酸、苯硫酚、硫基乙酸和血清白蛋白等都比谷胱甘肽差。
6.4 硝酸银硅胶薄层色谱 应用硝酸银硅胶板可分离出多种已知的前列腺素,普通硅胶板只能检出PGA、PGE、PGF,不能检出仅差一个双键的PGE1和PGE2。硝酸银硅胶板的制备:取10 g硅胶G(220目)与1 g硝酸银,溶于60 mL蒸馏水的水溶液中混合,调成浆状,铺在已除油渍的玻璃板上,待固化后,置105 ℃活化0.5 h后,收藏于棕色干燥器中备用。
6.5 获得天然PG的方法有生物合成法、化学合成法和半合成法 采用花生四烯酸为前体,从羊精囊提取前列腺素合成酶,并加入谷胱甘肽、氢醌等辅助刺激剂,在充分给氧的条件下,使花生四烯酸转化成PG,最后分离、提纯即得PGE1。其工艺特点是原料丰富、操作简便、成本较低。
6.6 有关PGE1提取工艺的研究报道较多,本试验不仅在提取方面做了优化,主要在分离及精致过程中做了重点考察,通过对PGS粗品的上柱分离,并对其进行硅胶薄层色谱鉴定追踪,得到PGE粗品。在精致的过程中,同样通过硝酸银硅胶G薄层鉴定追踪,PGE1的峰区集中于Rf值为0.44~0.46得到PGE1结晶,熔点115~116 ℃。
参考文献:
[1] 李良涛,李明晔.现代生化药物[M].哈尔滨:黑龙江科学技术出版社,2008,4:218-221.
[2] 袁昕蓉,邱志斌,王东凯.HPLC柱后衍生化法测定前列腺素E1脂肪乳的含量[J].药物分析杂志,2009,29(11):1801-1803.
[3] 时念秋,张大同,王东凯,等.前列腺素E1冻干隐形脂体包封率的测定[J].食品与药品,2009,11(1):42-44.
[4] 王立民,李刚.前列腺素E1在临床中的应用[J].中国医药指南,2009,7(2):68-69.
[5] 孙海华,柯开富.前列腺素E1在血管病中的临床应用[J].南通医学院学报,2009,29(1):71-74.
[6] 国家药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010:448.
[7] 丁存刚,葛庆华,周臻,等.LC-MS/MS测定Beagle犬血浆中前列腺素E1[J].药物分析杂志,2010,30(4):600-603.
[8] 周丽芹.正交试验筛选前列腺素E1提取工艺的研究[J].中华中医药学刊,2010,28(11);2449-2450.
[9] 李淑斌,魏晓莹,刘丹,等.前列腺素E1微乳的制备及体外经皮渗透性评价[J].中国新药杂志,2010,2819(21);2001-2004.
[10]金戈,明海霞,董晓丽,等.前列腺素及异前列腺素的临床应用研究进展[J].甘肃中医学院学报,2011,28(5):65-68.
[11]吴秀荣,林焕泽,李桃,等.RP-HPLC法检测注射用前列地尔的有关物质[J].中国临床药学杂志,2011,20(4):234-236.
[12]葛渊源,蔡正艳,周伟澄.前列腺素类药物全合成的研究进展[J].中国医药工业杂志,2013,44(7):720-721.
[13]李瑜,刘云洁,张林,等.前列腺素E1对原位肝移植病人肺动脉高压的影响[J].青岛大学医学院学报,2013,49(2);506-508.
[14]孙薇,王晶,郭颖,等.慢性肾功能不全患者前列腺素E1的治疗效果[J].中国卫生产业,2013(49)25;110-111.
[15]罗晓强.前列腺素E1治疗肝硬化的疗效观察[J].吉林医学,2013,34(21):4290.
