胆汁淤积性肝硬化大鼠模型的改良
2014-08-14田耀洲胡春萍蔡雪婷
宣 佶,田耀洲,曹 鹏,胡春萍,蔡雪婷,张 伟
(1.南京中医药大学,江苏 南京 210046;2.解放军81医院,江苏 南京 210002;3.江苏省中医药研究院,江苏 南京 210002;4.南京中医药大学附属中西医结合医院,江苏 南京 210002;5. 中国中医科学院江苏分院,江苏 南京 210002)
肝纤维化是多种慢性肝病发展为肝硬化的必经阶段,阻断肝纤维化是慢性肝病治疗中的关键问题[1]。为了更好地研究肝纤维化的发生机制以及药物对该病的疗效和治疗途径,需要建立稳定、高效、可靠的肝纤维化动物模型[2,3]。国内文献对胆总管结扎模型建立的手术操作过程描述过于简单,不利于模型的复制,同时关于其造模成功率仅做了短期内的统计和评价,无法反映动物模型的远期可靠及稳定性[3-5,7],为此,笔者在研究胆汁淤积性肝硬化的药物治疗中,曾先后两次建立胆汁淤积性肝硬化大鼠模型,本文拟报告造模过程,并探讨一种方法简便、成功率高、存活时间长、切实可行的造模方法。
1 胆总管结扎法
1.1 材料
清洁级SD大鼠40只由上海斯莱克实验动物有限公司提供,合格证号SCXK(沪)2007-0005;使用证号SYXK(苏)2011-0017,雄性,体重(180±20)g,购于南京青龙山动物繁殖场。
1.2 方法
SD雄性成熟大鼠40只,随机分为胆总管模型组(n=30)和假手术组(n=10),禁食禁水24 h。进行称重,用10%的水合氯醛(0.3 mL/100 g),腹腔注射麻醉,仰位固定于固定板上,消毒切口,沿腹部正中线大鼠剑突以下约1.5~2 cm之间切口,打开腹腔,找到胃幽门部,翻转十二指肠,在十二指肠周围有淡粉色类似脂肪的就是胰腺;将胰腺展开后在胰腺中仔细寻找透明的管状物,该导管是从肝脏发出最后走行进入十二指肠,内有淡黄色液体,即为胆管。胆总管模型组暴露胆总管,于胆总管中段双重结扎,查腹腔内无活动性出血后,常规关腹(图1)。假手术组仅暴露胆总管,不予结扎,常规关腹。术后连续3 d注射青霉素40万U/只,禁水12 h,禁食24 h后正常喂养。术后1周眼眶取血检测血清学指标谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、总胆红素(TBIL)、直接胆红素(DBIL)、γ-谷氨酰转肽酶(GGT)、白蛋白/球蛋白(A/G),术后4周取胆总管结扎和假手术小鼠肝组织块常规石腊切片,进行HE染色,光镜观察;取肝组织块经SP法免疫组织化学染色。石腊切片经梯度乙醇脱水,甲醇过氧化氢封闭后,分别用抗α-SMA mAb和抗CK-19 mAb 37℃孵育1 h,辣根过氧化物酶偶联的抗小鼠的二抗,37℃孵育0.5 h,二氨基联苯胺显色。用PBS代替一抗做为阴性对照。计算机扫描分析蛋白的阳性数目、灰度值和相对光密度。
1.3 结果
胆总管模型组大鼠术后尿黄,大便呈陶土色,但正常喂养后,胆总管模型组大鼠逐渐出现精神萎靡,腹胀腹水明显,术后14 d随机其中5只大鼠,抽取腹水以AMS酶法测定腹水淀粉酶,提示腹水淀粉酶明显升高(表1),假手术组大鼠术后无精神萎靡,无腹水,毛发有光泽,进食进水正常,大小便正常,体重逐日增加。一周眼眶取血行血清学指标 (AST、ALT、ALP、TBIL、DBIL、GGT) 检测,对比假手术组模型组大鼠血清胆红素明显增高,肝功能异常(表2),提示梗阻性黄疸模型成功,但是术后模型组相继出现死亡,1月内累计死亡20只,死亡率达66.7%,剖检尸体发现胰腺坏死,大量腹水,肠道胀气明显。术后4周进行组织形态学观察,胆总管模型组病理提示散在炎性细胞浸润,汇管区小胆管明显增生,纤维结缔组织增生将肝小叶分割成假小叶结构。免疫组化染色显示,模型组肝脏汇管区小胆管周围可见CK-19阳性的棕褐色细胞明显增生,肝组织α-SMA阳性的棕褐色细胞明显增多,成纤维细胞大量增生(图2,见封三),胆总管模型组CK-19、α-SMA蛋白的阳性数目、灰度值和相对光密度表达水平升高(表3)。
2 肝门部肝总管缝扎法
2.1 材料
清洁级SD大鼠40只,雄性,体重(180±20)g,由上海斯莱克实验动物有限公司提供,购于南京青龙山动物繁殖场,合格证号:SCXK(沪)2007-005;使用证号SYXK(苏)2011-0017。
2.2 方法
SD雄性成熟大鼠40只,随机分为肝总管模型组(n=30)和假手术组(n=10),禁食禁水24 h。进行称重,用10%的水合氯醛(0.3 mL/100 g),腹腔注射麻醉,仰位固定于固定板上,消毒切口,沿腹部正中线大鼠剑突以下约1.5~2 cm之间切口,打开腹腔,暴露胆总管,沿胆总管向上找到肝门部,见此处无胰腺组织,拉钩充分暴露术野,于肝总管近肝门部以5-0丝线单纯缝扎,查腹腔内无活动性出血后,常规关腹(图1)。假手术组仅暴露肝总管,不予结扎,常规关腹。术后连续3 d注射青霉素40万U/只,禁水24 h,禁食48 h后正常喂水,少量喂食,1周后正常喂养。术后1周眼眶取血行血清学指标(AST、ALT、ALP、TBIL、DBIL、GGT、A/G)检测,术后4周取胆总管结扎和假手术小鼠肝组织块常规石腊切片,进行HE染色,光镜观察;取肝组织块经SP法免疫组织化学染色,方法同上。
2.3 结果
肝总管模型组大鼠术后尿黄,大便呈陶土色,正常喂养后,无精神萎靡,一般情况良好,近期并无腹水腹胀等情况,假手术组大鼠术后无精神萎靡,毛发有光泽,进食进水正常,大小便正常,体重逐日增加。术后一周眼眶取血行血清学指标(AST、ALT、ALP、TBIL、DBIL、GGT)检测,对比假手术组模型组大鼠血清胆红素明显增高,肝功能异常,提示梗阻性黄疸模型成功,14 d后部分大鼠出现少量腹水,查腹水淀粉酶未见异常(表1),1月内累计死亡8只,死亡率达26.7%。术后4周进行组织形态学观察,肝总管模型组病理提示散在炎性细胞浸润,汇管区小胆管明显增生,纤维结缔组织增生将肝小叶分割成假小叶结构。免疫组化染色显示,模型组肝脏汇管区小胆管周围可见CK-19阳性的棕褐色细胞明显增生,肝组织α-SMA阳性的棕褐色细胞明显增多,成纤维细胞大量增生(图2见封三),肝总管模型组CK-19、α-SMA蛋白的阳性数目、灰度值和相对光密度表达水平升高(表3)。
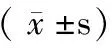
表1 腹水淀粉酶测定
表2肝功能生化指标
Tab.2Biochemical indices of liver function

注:与假手术组比,* P<0.05;与胆总管模型组相比,# P > 0.05
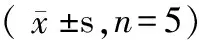
表3 各组大鼠肝组织CK-19、α-SMA免疫组化染色的表达水平
3 讨论
肝纤维化动物模型在肝纤维化的发生机制以及药物研究中应用广泛,方法多样,胆总管结扎术是其中一种经典造模方法,该模型的原理与发生在人体的继发性胆源性肝硬化的机制相吻合,形成人为的肝外胆道梗阻,从而引起梗阻部位以上胆管扩张、胆汁淤积、胆道内压力增高,并可引发肝内胆小管扩张破裂[5,6],国内文献报道该模型短期内存活率在75%~83.3%之间[3-5,7],但笔者发现该经典方法造模后模型动物1月内死亡率仍然偏高,很难满足实验药物疗效观察。
笔者第一次造模,采用经典的结扎胆总管法,死亡率较高,成本较大。观察发现模型大鼠术后当天一般情况可,并无死亡,术后第二天进食进水后,逐渐出现精神萎靡、腹部膨隆等情况,并且逐日加重,3 d后陆续出现死亡,期间抽取腹水查淀粉酶提示明显增高,剖检死亡大鼠发现腹腔内大量腹水,胰腺液化坏死,肠道明显胀气。结合大鼠体征、血液及腹水生化及剖检结果,分析大鼠死亡原因考虑为急性胰腺炎可能性较大,进而导致腹水淀粉酶明显升高,剖检时发现肠道胀气也与胰腺炎引起的麻痹性肠梗阻有关。通过仔细研究大鼠胆道解剖及胰腺分布,发现大鼠胆总管于胰腺内走行,且管腔十分纤细,不易寻找和暴露,术中对胰腺中胆管的牵拉、分离解剖、结扎都不可避免的造成一定的胰腺损伤,加之术后过早喂食,促进胰腺分泌,进一步加重胰腺坏死,最终造成模型动物死亡。因此,笔者对第一次造模死亡率偏高主要原因总结为术中胰腺损伤和术后过早喂食刺激并加重胰腺坏死有关。
经过仔细研究大鼠解剖结构,笔者发现大鼠的肝总管位于左右肝管汇合部远心端,位置固定,易于寻找及暴露,且无胰腺组织包裹,于此处结扎胆道既可以有效阻断胆道又可以减少损伤胰腺风险。因此第二次以肝门部肝总管缝扎法进行造模,以眼科针穿5-0丝线(尽量减少周围组织损伤)进行单纯缝扎,术中小心操作,最大限度的减少分离、结扎胆管造成的牵拉,避免损伤胰腺组织,造模后适当推迟给水喂食时间,推迟并减少胰腺分泌。术后发现肝总管模型组的大鼠给食后无精神萎靡,一般情况良好,1周内并无腹部膨隆饱胀等情况,术后第二周部分大鼠出现少量腹水,查腹水淀粉酶未见异常,考虑与肝硬化后影响蛋白合成有关造成的腹水有关。
本实验中, 各组大鼠血液生化提示两个模型组大鼠较假手术组胆红素、转氨酶等指标明显升高并伴有蛋白合成障碍;HE染色结果显示散在炎性细胞浸润,汇管区小胆管明显增生,纤维结缔组织增生将肝小叶分割成假小叶结构,同时我们利用胆管上皮细胞特异性标志-细胞角蛋白19 (CK-19)免疫组化染色提示,胆管上皮细胞明显增生。以上结果均反映出两组模型组大鼠肝脏功能受损、细胞炎性反应、小胆管细胞增生明显等一系列病理表现。另外,肝纤维化的显著特征是细胞外基质(extracellular matrix, ECM)的增加和成分的改变,而肝星状细胞(hepatic stellate cells,HSCs)的活化和增殖是其关键和中心环节[8-10]。α-平滑肌肌动蛋白(α-SMA)是肝星状细胞活化的特征性标志物,免疫组化显示两组模型组大鼠肝脏α-SMA阳性细胞明显增加,提示成纤维细胞大量增生,进一步证实胆道结扎后大鼠肝脏纤维化的病理改变。
因此本研究表明对于以上两种造模方法均可以有效制造胆汁淤积性肝硬化动物模型,但是前者死亡率较高,因此往往需要多次补做模型,时间和经费成本相对较大,而肝门部肝总管缝扎法,具有解剖位置固定、易于寻找和暴露、术后并发胰腺炎可能性小、成模率高、存活时间长等优点,是一种切实、方便、可行的造模方法。笔者通过实验成功建立了胆汁淤积性肝硬化大鼠模型,对经典的胆总管结扎造模方法进行适当改进,降低了造模的死亡率,提高了肝纤维化模型质量和实验效率。
参考文献:
[1] Iredale JP.Models of liver fibrosis:exploirng the dynamic nature of inflammation and repair in a solid organ [J].J Clin Invest, 2007, 117(3):539-548.
[2] Weiler-Normann C,herkel J,Lohse AW.Mouse models of liver fibrosis [J].Z Gastroentero1, 2007, 45(1):43-50.
[3] 秦冬梅, 赵文惠, 胡利萍, 等. 胆总管结扎术造大鼠肝纤维化模型的研究 [J]. 时珍国医国药, 2012, (04):27-29.
[4] 邵文武, 张辉. 胆总管结扎术诱导大鼠肝纤维化模型的建立 [J]. 黑龙江医药科学. 2010, 33(4):102.
[5] 林冬静, 金政. 常用肝纤维化动物模型的研究及评价 [J]. 时珍国医国药, 2006, (03):189-190.
[6] Marques TG, Chaib E, Fonseca JH, et al. Review of experimental models for inducing hepatic cirrhosis by bile duct ligation and carbon tetrachloride injection [J]. Acta Cir Bras, 2012, 27(8):589-594.
[7] 元海成, 秦鸣放, 邹富胜,等. 大鼠胆总管结扎后不同时间点的生化指标变化 [J]. 中国中西医结合外科杂志, 2011, 17(6):583-585.
[8] Lee UE, Scott L. Friedman SL. Mechanisms of hepatic fibrogenesis [J]. Best Pract Res Clin Gastroenterol, 2011, 25(2):195-206.
[9] Kisseleva T, Brenner DA. Mechanisms of fibrogenesis [J]. Exp Biol Med, 2008, 233(2):109-22.
[10] Henderson NC, Iredale JP. Liver fibrosis: cellular mechanisms of progression and resolution [J]. Clin Sci, 2007, 112:265-80.
