白细胞介素4调节人脐带间充质干细胞的增殖和造血支持能力*
2014-08-13杨舟鑫韩之波贾兵兵王国付
杨舟鑫, 韩之波, 贾兵兵△, 王国付
(1浙江医院,浙江省老年医学重点实验室,浙江 杭州 310013; 2中国医学科学院,北京协和医学院血液学研究所,血液病医院,实验血液学国家重点实验室, 天津 300020)
间充质干细胞(mesenchymal stem cells, MSC)最早分离于骨髓,它可以黏附在塑料培养瓶中快速增殖,并具有向脂肪、骨髓和软骨分化的能力,因此可以作为细胞替代治疗的种子细胞。不过,骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSC)来源有一定的局限,限制了其在临床上的应用。随着研究的逐渐深入,现在几乎已经可以从身体的各个组织得到MSC[1]。其中,围产期来源的MSC如来源于胎盘、脐带和脐带血的MSC的获得较为方便且受伦理学限制少,因而围产期干细胞可能会具有更好的临床应用前景。脐带间充质干细胞(umbilical cord mesenchymal stem cells, UC-MSC)可以从脐带中扩增获得,它具有BM-MSC的绝大部分生物学功能,可以向骨、脂肪、软骨、神经和内皮等分化,有和BM-MSC相似的免疫调节功能,主要通过前列腺素E2(prostaglandin E2,PGE2)来抑制外周血单个核细胞的增殖和IFN-γ的分泌,同时,它在增殖能力和胚胎干细胞标记的表达要明显高于BM-MSC[2-3]。研究表明MSC在移植物抗宿主病和多种自身免疫性疾病等多种难治性疾病中都有良好的应用[4-6]。
MSC的功能会受到炎症因子的调节,IFN-γ、IL-1β和TNF-α可以调节MSC的各种性质[7-8],但是针对Th2型的炎症因子白细胞介素4(interleukin -4, IL-4对MSC的作用的研究相对较少,本研究本主要探讨IL-4刺激后UC-MSC的生物学特性如免疫表型、增殖、分化能力和造血支持能力等的变化。
材 料 和 方 法
1 主要试剂及仪器
DMEM/F12和IMDM干粉培养基、胰蛋白酶和2-巯基乙醇均为Gibco产品;胎牛血清为HyClone产品;人脐血CD34阳性分选试剂盒为STEMCELL产品;小鼠抗人CD11b、 CD19、 CD34、 CD45、 CD73、 CD90、 CD105、人类白细胞抗原(human leukocyte antigen,HLA)-DR和HLA-ABC抗体以及同型对照抗体均为BD产品;地塞米松、IBMX、吲哚美辛、抗坏血酸磷酸盐和β-甘油磷酸为Sigma产品;胰岛素和IL-4为Peprotech产品;BrdU-ELISA试剂盒为Roche产品;倒置相差显微镜购自Olympus;流式细胞仪购自BD。
2 细胞的分离和培养
脐带来源于正常足月剖宫或顺产产妇,在获得知情同意的情况下,由天津昂赛细胞基因工程有限公司采集。用D-Hanks缓冲液充分冲洗脐带,将脐带剪碎成小组织块,再将组织块用胶原酶和胰酶消化,然后混合液体经200目滤网过滤后,分别接种于细胞培养瓶中,用含10%胎牛血清的DMEM/F12培养液于37 ℃、5% CO2、饱和湿度的培养箱中培养,待细胞生长至80%融合时,胰酶消化细胞,按1∶3传代。
3 主要实验方法
3.1细胞表型的测定 分对照组和IL-4刺激组。IL-4刺激组在细胞50%融合时用IL-4(20 μg/L)刺激24 h后消化离心,将UC-MSC消化下来后,按每管2×105个细胞分管,使用抗体标记后,用PBS重悬至400 μL,在流式细胞分析仪上检测。
3.2MTT法检测细胞活力 将UC-MSC 以2×103cells/well的密度种于96孔板中,IL-4刺激组在种细胞时加入IL-4 (20 μg/L)。利用MTT法分别于IL-4刺激的24 h、96 h和120 h后在酶标仪上检测A490值。
3.3BrdU法测定细胞增殖 将UC-MSC 以2×103cells/well的密度种于96孔板中,IL-4刺激组在种细胞时加入IL-4(20 μg/L)。使用培养箱中培养60 h后加入BrdU,再培养12 h后弃上清。用固定液固定细胞,然后弃上清加入辣根过氧化物酶标记的检测抗体,室温避光孵育1 h。弃上清,用洗涤液洗板5次,加入显色底物,室温避光孵育15 min后,加入终止液终止反应,最后在酶标仪上检测A450值。
3.4细胞分化潜能的检测 将UC-MSC以2×103cells/well的密度种于96孔板中。48 h后细胞贴壁完全,将细胞培养液更换为成脂和成骨培养基(成骨诱导培养基:IMDM培养基、10% FBS、100 U青/链霉素、2 mmol/L左旋谷氨酰胺、0.1 μmol/L地塞米松、0.2 μmol/L Vit C、10 μmol/L β-磷酸甘油;成脂诱导培养基:IMDM培养基、10% FBS、100 U青/链霉素、2 mmol/L左旋谷氨酰胺、1 μmol/L地塞米松、0.5 μmol/L IBMX、10 mg/L insulin、100 μmol/L吲哚美辛)。分对照组和IL-4(20 μg/L)刺激组。在诱导培养10 d后,成脂分化用油红O染色,成骨分化用茜素红S染色,显微镜下观察。成骨分化定量是向成骨分化染色完成后的96孔板中加入含20%甲醇和10%乙酸的水溶液,室温孵育15 min后在酶标仪上检测A450值。成脂分化定量是向成脂分化染色完成后的孔板加入100%的异丙醇,室温孵育10 min后在酶标仪上检测A409值。
3.5实时荧光定量 PCR方法检测基因的表达 IL-4(20 μg/L)刺激UC-MSC 24 h后收集细胞,并以平行培养的未刺激的UC-MSC作为对照,用E.Z.N.A. Total RNA Kit 1(Omega)抽提细胞总RNA,并按照MLV RT kit(Invitrogen)的逆转录体系合成cDNA。实时定量PCR采用GoTaqr qPCR Master Mix(Promega)的反应体系。使用ABI 7300 实时定量PCR扩增仪进行 PCR扩增,反应条件为:95 ℃ 2 min,95 ℃变性15 s、60 ℃退火30 s,共 45个循环。以次黄嘌呤磷酸核糖基转移酶 1 (hypoxanthine phosphoribosyltransferase 1,HPRT1)为内参照,分析目的基因的相对表达量。扩增产物的特异性通过绘制熔解曲线来进行验证。用于实时荧光定量PCR的引物序列见表1。
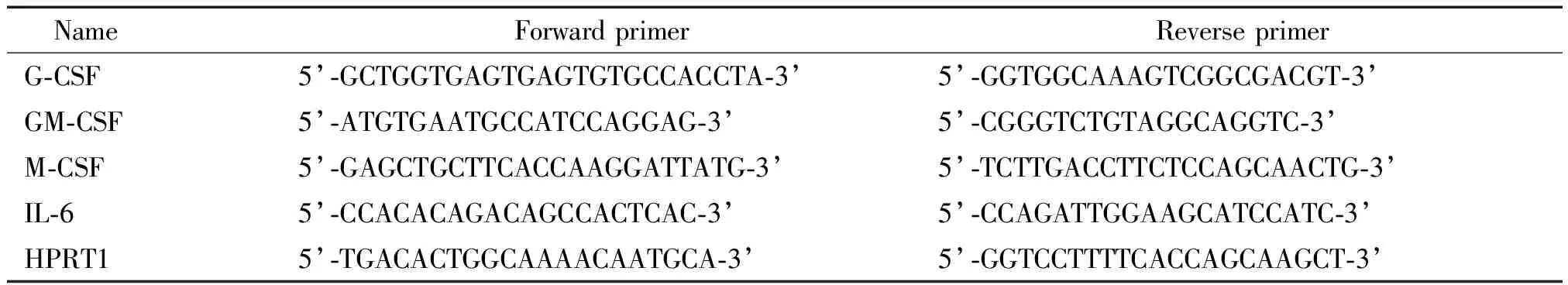
表1 用于实时荧光定量PCR的引物
3.6UC-MSC条件培养液收集 取2×106UC-MSC,用10 mL含10% FBS的DMEM/F12培养基(刺激组加入IL-4,终浓度为20 μg/L),接种于75 cm2培养瓶中,置于恒温箱中培养。培养24 h时后收集UC-MSC的培养上清,用0.22 μm的滤膜过滤上清,分装、冻存于-80 ℃备用。
3.7分离纯化脐血CD34+细胞 收集足月妊娠的脐血标本,均获得知情同意。PBS按1∶2的比例稀释脐血。将稀释的脐血以2∶1的比例沿管壁转移至离心管内的人淋巴细胞分离液上,使用较慢的加速度和减速度,600×g离心20 min,小心抽取中间的白膜层,PBS溶液洗2次。用人脐血CD34阳性细胞分选试剂盒,分选CD34+细胞。DMEM/F12培养基重悬CD34+细胞,细胞浓度调整为1×107/L。
3.8造血祖细胞集落培养 将IL-4刺激或未刺激UC-MSC条件培养液400 μL与1.6 mL不完全甲基纤维素培养基MethoCultTMH4230混合,分别加入200 μL CD34+细胞悬液,接种于6孔板;于37 ℃、5% CO2的饱和湿度孵箱中培养。在第14 天分别观察集落形成单位的形态和种类,记录≥50个细胞组成的集落形成单位的数量。
4 统计学处理
采用GraphPad Prism软件进行统计处理,计量资料以均数±标准误(mean±SEM)表示。组间均数比较采用t检验,P<0.05为差异有统计学意义。
结 果
1 IL-4刺激对UC-MSC形态表型的影响
UC-MSC贴壁后,可以在体外迅速扩增,细胞呈梭形。加入IL-4刺激,MSC形态无明显变化,仍保持其原有形态。MSC表达CD73、CD90、CD105和HLA-ABC,不表达CD11b、CD19、CD34、CD45和HLA-DR。这些MSC的基本特征在IL-4刺激后并没有明显的变化,说明IL-4并不能改变UC-MSC的基本免疫表型,见图1。

Figure 1. The phonotypes of UC-MSC with or without IL-4 stimulation assayed by flow cytometry.
2 IL-4刺激对UC-MSC增殖能力的影响
在体外贴壁并能迅速扩增是UC-MSC的基本特征。MTT和BrdUELISA的检测结果都表明,72 h后IL-4能轻微地削弱UC-MSC的增殖能力,差异具有统计学意义(P<0.05),见图2。

Figure 2. Effect of IL-4 on proliferation of UC-MSC. A: MTT test of UC-MSC with/without IL-4 stimulation; B: Brdu ELISA test of UC-MSC with/without IL-4 stimulation. Mean±SEM. n=3. *P<0.05 vs control.
3 IL-4刺激对UC-MSC分化潜能的影响
IL-4刺激后,UC-MSC仍然具有体外向脂肪细胞和骨细胞分化的能力,镜下观察UC-MSC脂滴形成和钙沉积数量并不能观察到明显的变化,对成脂和成骨分化的定量检测也没有检测到明显的差异,见图3。这说明在我们的实验条件下,IL-4对UC-MSC成脂和成骨分化能力的影响并不大。
4 IL-4刺激对UC-MSC造血支持相关基因的影响
实时荧光定量PCR结果显示,在经过IL-4刺激之后,UC-MSC表达的粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)、巨噬细胞集落刺激因子(M-CSF)和粒细胞-巨噬细胞集落刺激因子(GM-CSF)这几个造血相关基因均未检测到明显的变化,但是IL-6却出现了明显上调(P<0.01)。
5 IL-4刺激对UC-MSC造血支持功能的影响
在不加入UC-MSC培养上清的情况下,仅加入含血清的DMEM/F12培养基或加入含IL-4和血清的DMEM/F12培养基,均不足以促进CD34+细胞集落形成。UC-MSC的培养上清作用于CD34+细胞时,则可以促进CD34+细胞的集落形成。IL-4刺激组和未刺激对照组均可见粒系集落形成单位(colony forming unit-granulocyte, CFU-G)、巨噬系集落形成单位(colony forming unit-macrophage, CFU-M)和粒-巨噬集落形成单位(colony forming unit-granulocyte and macrophage, CFU-GM),但是没有观察到观察到红系相关集落形成单位。CFU-GM占据其中的大多数。IL-4 刺激组的总集落形成单位要显著高于未刺激组(P<0.05)。其中,IL-4刺激组中的CFU-GM的数量要显著高于未刺激组(P<0.01),但是CFU-G和CFU-M的差距则不显著(P>0.05),说明IL-4刺激组的上清相对于未刺激组上清主要增加了CFU-GM的数量,见图5。

Figure 5. Numbers of CFU formed by umbilical cord blood-derived CD34+ cells in control and IL-4 stimulation group. Mean±SEM. n=3. *P<0.05, ** P<0.01 vs control.
讨 论
本研究中,我们检测了IL-4刺激对UC-MSC的表型、增殖、分化等基本生物学特性和造血支持功能的影响,并探究了IL-4刺激对UC-MSC造血相关基因表达的改变。IL-4刺激UC-MSC并没有改变UC-MSC的干细胞基本性质。IL-4刺激后的MSC仍然符合国际细胞治疗协会(ISCT)对于MSC的标准,仍然可以黏附于培养瓶大量增殖,表达CD73、CD90和CD105,不表达造血细胞标志CD11b、CD19、CD34和CD45,并且可以成脂成骨分化。但IL-4刺激后UC-MSC还是有一些其它改变。首先MSC的增殖被削弱;其次MSC的造血支持功能也发生了变化。这说明IL-4刺激之后的UC-MSC具有了新的特征,具有新的不同的性质。
造血支持作用是MSC重要的功能,UC-MSC的上清含有G-CSF、M-CSF、GM-CSF、IL-6等因子,可以促进CD34+细胞生成集落[9]。我们的实验表明,UC-MSC在 IL-4存在的情况下其上清具有更强的促进人脐血CD34+细胞体外集落生成的能力。通过实时定量PCR我们发现G-CSF、M-CF、GM-CSF并没有明显变化;但是IL-6却发生了明显上调。IL-6能够在多种免疫细胞、内皮细胞以及成纤维细胞中表达。研究表明间充质干细胞也可以表达IL-6。IL-6是一种重要的造血促进因子,能够促进造血发生,促进干细胞分化,形成更多的血液系统细胞,促进小鼠骨髓移植后免疫功能的重建[10]。本实验中MSC造血支持能力的增强可能与IL-6的作用相关。此外,IL-4自身在这一体系中的作用仍有待进一步研究。尽管在没有MSC分泌的细胞因子的情况下,IL-4并不能诱导集落的产生,但IL-4是否与MSC分泌的细胞因子的协同作用仍不明确。
IFN-γ已经被证明可以直接作用于UC-MSC,改变UC-MSC的各项功能[8]。IFN-γ与IL-4对UC-MSC的作用并不一致。IFN-γ被证明可以增强UC-MSC的分化,并诱导IDO1来促进MSC的免疫调节功能,但是没有发现IL-4的促分化能力增强。而IL-4可以明显削弱UC-MSC的增殖能力,但是相同时间内的IFN-γ并没有明显改变UC-MSC的增殖。因此,可以推测IFN-γ和IL-4在对MSC的作用上并不一致。在特异性免疫反应中,IFN-γ与IL-4分别被认为是Th1型和Th2型免疫反应的标志性因子。UC-MSC对IFN-γ与IL-4的不同反应可能体现了其在Th1型和Th2型免疫反应下的不同状态,说明其在特异性免疫反应时的有不同反应。
TNF-α被认为可以增强UC-MSC的G-CSF、GM-CSF和IL-6的表达,从而增强其造血支持能力[11]。其上清诱导CFU-M和CFU-GM的能力均有所增加。IL-4也有增强CFU-GM的能力,但是IL-4处理不能明显上调UC-MSC的G-CSF和GM-CSF,仅仅有IL-6的上调,因此TNF-α和IL-4在调节UC-MSC的造血支持上也有不同的作用。
总之,IL-4能够削弱UC-MSC的增殖能力,并增强其对造血的支持能力。这为脐带间充质干细胞如何在Th2型免疫疾病的患者中使用提供了一些基础资料,为完善脐带间充质干细胞用于多种疾病的治疗提供了理论依据。
[参 考 文 献]
[1] da Silva Meirelles L, Chagastelles PC, Nardi NB. Mesenchymal stem cells reside in virtually all post-natal organs and tissues[J]. J Cell Sci, 2006, 119(Pt 11):2204-2213.
[2] Lu LL, Liu YJ, Yang SG, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91(8):1017-1026.
[3] Chen K, Wang D, Du WT, et al. Human umbilical cord mesenchymal stem cells hUC-MSCs exert immunosuppressive activities through a PGE2-dependent mechanism[J]. Clin Immunol, 2010, 135(3):448-458.
[4] Le Blanc K, Rasmusson I, Sundberg B, et al. Treatment of severe acute graft-versus-host disease with third party haploidentical mesenchymal stem cells[J]. Lancet, 2004, 363(9419):1439-1441.
[5] Zappia E, Casazza S, Pedemonte E, et al. Mesenchymal stem cells ameliorate experimental autoimmune encephalomyelitis inducing T-cell anergy[J]. Blood, 2005, 106(5):1755-1761.
[6] Liang L, Dong C, Chen X, et al. Human umbilical cord mesenchymal stem cells ameliorate mice trinitrobenzene sulfonic acid (TNBS)-induced colitis[J]. Cell Transplant, 2011, 20(9):1395-1408.
[7] Wang D, Chen K, Du WT, et al. CD14+monocytes promote the immunosuppressive effect of human umbilical cord matrix stem cells[J]. Exp Cell Res, 2010, 316(15):2414-2423.
[8] 戎丽娟,池 颖,杨少光,等. 干扰素γ 对人脐带间充质干细胞生物学特性及免疫调节功能的影响[J]. 中国实验血液学杂志, 2012, 20(2):421-426.
[9] 李丽娜,韩之波,王有为, 等. 人脐带间充质干细胞条件培养基体外支持造血的功能[J]. 中国实验血液学杂志, 2012, 20(4):975-980.
[10]Ulich TR, del Castillo J, Guo KZ.Invivohematologic effects of recombinant interleukin-6 on hematopoiesis and circulating numbers of RBCs and WBCs[J]. Blood, 1989, 73(1):108-110.
[11]胡彩东, 韩之波, 杨舟鑫,等. TNF-α增强人脐带间充质干细胞条件培养基的体外造血支持功能[J]. 中国病理生理杂志, 2013, 29(9):1679-1684.
