CTRP3下调炎症因子表达改善胰岛素抵抗的3T3-L1脂肪细胞胰岛素敏感性*
2014-08-13吴玉文孙苏欣孙家忠
李 新, 姜 黎, 杨 杪, 吴玉文, 孙苏欣, 孙家忠
(武汉大学中南医院1内分泌科, 2综合科, 湖北 武汉 430071)
现有研究表明,脂肪组织已经不仅仅是胰岛素作用的靶器官与能量储备组织,而是具有多种生物学功能的内分泌器官。脂肪细胞或脂肪组织分泌的活性分子被称为脂肪因子,参与体内糖脂代谢、炎症反应、动脉粥样硬化、胰岛素信号转导以及胰岛β细胞功能调控等多个病理生理过程,成为联系肥胖与2型糖尿病的重要因素。胰岛素抵抗是一个慢性亚临床炎症过程,肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6 等多种炎症因子可以降低机体对胰岛素的敏感性[1]。
C1q/TNF相关蛋白3(C1q/TNF-relatedprotein3,CTRP3)是新近发现的一种脂肪因子,与脂联素同属C1q/TNF超家族,具有降糖、抗炎、抑制肝糖异生、促进内皮细胞增殖与迁移等效应[2-5]。但是CTRP3对脂肪组织胰岛素敏感性的效应目前并不清楚。因此,本研究通过体外培养3T3-L1脂肪细胞,以软脂酸(palmicacid,PA)诱导胰岛素抵抗的3T3-LI脂肪细胞模型,观察CTRP3对胰岛素抵抗的脂肪细胞葡萄糖摄取率、TNF-α及IL-6表达、葡萄糖转运子4(glucosetransporter4,GLUT-4) 表达等的效应,探讨CTRP3对脂肪细胞胰岛素敏感性的调节效应及可能机制。
材 料 和 方 法
1 细胞与试剂
小鼠3T3-L1前脂肪细胞(来源于美国菌种保藏中心,购自中国科学院上海生命科学研究院);DMEM高糖培养基(Gibco);胎牛血清、牛血清白蛋白、0.25%胰蛋白酶、青/链霉素、异丁基-甲基-黄嘌呤(IBMX)和油红O(Sigma);地塞米松(dexmethasone,DEX)、KRP缓冲液(131.2mmol/L NaCl、4.71 mmol/L KCl、2.47 mmol/L CaCl2、2.48 mmol/L Na3PO4、1.24 mmol/L MgSO4,10 mmol/L HEPES,pH 7.4)、2-脱氧-[3H]-葡萄糖(武汉楷伦化学新材料有限公司);重组人胰岛素(诺和公司);重组CTRP3蛋白(BioVendor);小鼠TNF-α及IL-6 ELISA检测试剂盒(武汉中帜生物科技有限公司);葡萄糖试剂盒(北京北化康泰临床试剂有限公司);Trizol(Promega);荧光定量PCR试剂盒(Invitrogen);兔抗小鼠GLUT-4及β-actin抗体(Santa Cruz);辣根过氧化物酶标记的羊抗兔IgG抗体(北京中山公司);ECL试剂盒(Pierce)。
2 细胞培养及诱导分化
将3T3-L1前脂肪细胞接种于培养板,在37 ℃、5%CO2的条件下,以含10%胎牛血清的DMEM高糖培养液培养,待细胞融合48 h后,加入含有IBMX(0.5 mmol/L)、DEX(0.25 mmol/L)及人胰岛素(1 μmol/L)的培养液,48 h后换为含胰岛素(1 μmol/L)的培养液再培养48 h,随后以含有10%的胎牛血清DMEM高糖培养基继续培养,48 h换液1次,诱导分化8~12 d后90%以上3T3-L1细胞呈脂肪细胞表型时可用于实验。
3 构建 3T3-L1脂肪细胞胰岛素抵抗模型, 鉴定, 干预与分组
将诱导分化成熟的3T3-L1脂肪细胞,以含有0.2%无游离脂肪酸的BSA的高糖DMEM培养液培养过夜,再换为含有胰岛素(0.1 μmol/L)、1%无游离脂肪酸的BSA以及PA(1.0 mmol/L)的DMEM培养24 h,构建胰岛素抵抗的3T3-L1脂肪细胞模型。通过比较葡萄糖消耗量及葡萄糖摄取率来反映PA诱导后3T3-L1脂肪细胞胰岛素抵抗情况。
将上述细胞分为正常对照(normal control,NC)组、胰岛素抵抗(insulin resistance,IR)组及CTRP3干预(CTRP3 intervention,CI)组,CI组又分不同浓度(10、50、250、1 250 μg/L)重组CTRP3蛋白干预12 h及250 μg/L CTRP3干预不同时间(2、6、12、24 h)等亚组。分别以含有不同浓度重组CTRP3蛋白的DMEM高糖(25.0 mmol/L)培养液培养不同时间,用于进一步检测。
4 主要方法
4.1葡萄糖消耗量 收集上述培养细胞培养液,用葡萄糖氧化酶法测定葡萄糖浓度,计算其消耗量,公式为:干预前培养液中高糖浓度(25.0 mmol/L)-干预后各组葡萄糖浓度;每组重复实验3次,取其平均值。
4.2炎症因子分泌的检测 取上述细胞培养液,以酶联免疫吸附法(ELISA)检测上清中的TNF-α及IL-6含量,按照说明书进行操作。
4.3葡萄糖转运实验 将上述细胞以KRP缓冲液洗3次,再以含有胰岛素(10 nmol/L)的KRP缓冲液孵育30 min,加入含2-脱氧-[3H]-葡萄糖(1.85×104Bq/mL)的KRP缓冲液孵育10 min,然后以预冷的含10 mmol/L葡萄糖的PBS液快速洗涤3次终止反应,再加入1 mL NaOH(0.1 mmol/L),2 h后取0.2 mL细胞裂解液于闪烁液中避光放置12 h,用液体闪烁计数器进行计数。另设一组细胞加入细胞松弛素B(10 μmol/L)作为对照,所有数据减去该值,作为各组葡萄糖摄取率。
4.4实时荧光定量PCR检测炎症因子及GLUT-4mRNA的表达Trizol法提取总RNA,RT-PCR扩增目的基因。PCR引物由上海赛百盛公司合成,序列如下:IL-6正义链5’-AGTTGCCTTCTTGGGACTGA-3’,反义链5’-CAGAATTGCCATTGCACAAC-3’;TNF-α正义链 5’-ACGGCATGGATCTCAAAGAC-3’,反义链5’-CGGCAGAGACCACCTTGAACT-3’;GLUT-4:正义链 5’-CCCCGCTGGAATGAGGTTTTTGAGGTGAT-3’,反义链5’-CAGACAGGGGCCGAAGATTGGGAGACAGT-3’;β-actin正义链 5’-ACACCCGCCACCAGTTCGC-3’,反义链5’-TCTCCCCCTCATCACCCACAT-3’。反应参数:预变性95 ℃ 15s;三步法PCR:95 ℃ 15s, 58 ℃ 10s,扩增45个循环;72 ℃ 45s。
4.5Western blotting检测GLUT-4蛋白的表达 提取总蛋白,取15 μL样品经SDS聚丙烯酰胺凝胶电泳分离,转移到PVDF膜上,将转印后的PVDF膜用兔抗小鼠GLUT-4抗体(1∶1 000)和抗β-actin抗体(1∶1 000)孵育,4℃摇床上过夜;然后以0.2%吐温/PBS洗涤膜3次,每次10 min;再以辣根过氧化物酶标记的羊抗兔IgG抗体(Ⅱ抗)孵育膜,37 ℃摇床振荡1 h,用0.2%吐温/PBS洗涤膜3次,每次10 min;然后将膜浸于ECL中,将膜蛋白面朝下与此混合液充分接触,1 min后,将膜移至另一保鲜膜上,去尽残液,包好放入X光片夹中,在暗室中曝光、显影和定影。对胶片进行扫描,用凝胶图像处理系统分析目标带的灰度值,以GLUT-4条带与β-actin条带的灰度比值表示其蛋白相对表达量。
5 统计学处理
数据以均数±标准差 (mean±SD) 表示,采用SPSS 18.0软件包进行分析, 组间差异采用单因素方差分析,以P<0.05 为差异有统计学意义。
结 果
1 CTRP3 对3T3-L1脂肪细胞葡萄糖消耗量的影响
与NC组相比,IR组葡萄糖消耗量显著下降[(17.3±1.2) mmol/Lvs(8.6±0.7)mmol/L,P<0.01],提示其存在明显胰岛素抵抗;与IR组相比,CI组随干预浓度增加(10、50、250、1 250 μg/L),葡萄糖消耗量分别增加22.1%、42.9%、76.6%及80.5%(均P<0.01);10、50及250 μg/L干预组之间相比差异也有统计学意义(P<0.05),1 250 μg/L与250 μg/L干预组之间相比差异无统计学意义(P>0.05),见表1。
表1重组CTRP3蛋白对胰岛素抵抗的3T3-L1脂肪细胞葡萄糖消耗量的影响
Table 1. The impact of recombinant CTRP3 protein on the glucose consumption of insulin resistant 3T3-L1 adipocytes (Mean±SD.n=9)
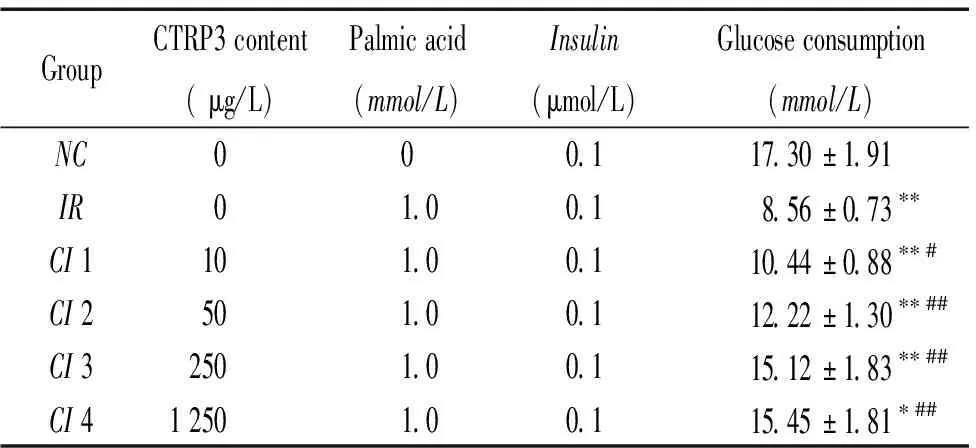
GroupCTRP3 content ( μg/L)Palmic acid(mmol/L)Insulin(μmol/L)Glucose consumption(mmol/L) NC000.117.30±1.91 IR01.00.18.56±0.73∗∗CI 1101.00.110.44±0.88∗∗#CI 2501.00.112.22±1.30∗∗##CI 32501.00.115.12±1.83∗∗##CI 41 2501.00.115.45±1.81∗##
NC:normalcontrol;IR:insulinresistance;CI:CTRP3intervention.*P<0.05,**P<0.01 vsNCgroup;#P<0.05,##P<0.01 vsIRgroup.
2 CTRP3对3T3-L1脂肪细胞葡萄糖摄取率的影响
2.1CTRP3对3T3-L1脂肪细胞葡萄糖摄取率的剂量-效应关系 将IR组葡萄糖摄取率设为1,较NC组下降了57.9%(P<0.01);与IR组相比,CI组不同浓度CTRP3(10、50、250、1 250 μg/L)干预12 h使胰岛素抵抗的3T3-L1脂肪细胞葡萄糖摄取率分别增加39.0%、68.0%、108.0%及111.0%(均P<0.01)。10、50及250 μg/L CTRP3干预组之间相比差异也有统计学意义(均P<0.01),1 250 μg/L与250 μg/L干预组之间相比差异无统计学意义(P>0.05),提示干预时间为12 h的条件下,250 μg/L CTRP3对脂肪细胞葡萄糖摄取率的作用接近最大化,见表2。
2.2CTRP3对3T3-L1脂肪细胞葡萄糖摄取率的时间-效应关系 以250μg/LCTRP3处理胰岛素抵抗的3T3-L1脂肪细胞,进一步观察其时间-效应关系。结果显示,CTRP3干预2、6、12、24h葡萄糖摄取率分别增加了23.0%、79.0%、109.0%及114.0%(均P<0.01);CTRP3干预2、6、12h葡萄糖摄取率均较前一时点明显增加(均P<0.01),干预24h与12h相比,葡萄糖摄取率差异无统计学意义(P>0.05),提示干预浓度为250μg/L的条件下,CTRP3干预12h对脂肪细胞葡萄糖摄取率的效应接近最大化,见表3。

表2 重组CTRP3蛋白对胰岛素抵抗的3T3-L1脂肪细胞葡萄糖摄取率的剂量-效应关系
**P<0.01vsCTRP3 content 0 μg/L group.

表3 重组CTRP3蛋白对胰岛素抵抗的3T3-L1脂肪细胞葡萄糖摄取率的时间-效应关系
**P<0.01vsCTRP3 content 0 h group.
3 CTRP3对胰岛素抵抗的3T3-L1脂肪细胞炎症因子表达的影响
与NC组相比,IR组上清中TNF-α及IL-6浓度分别增加了58.6%及51.8%(均P<0.01),其mRNA相对表达量分别增加了92.0%及62.0%(均P<0.01); 250 μg/L的CTRP3干预12 h,其上清中的TNF-α及IL-6浓度较IR组分别降低17.4%及17.1%(均P<0.01),其mRNA表达分别较对照组降低26.0%及18.9%(均P<0.01),见图1、2。
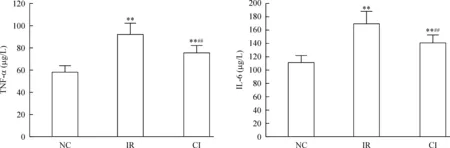
Figure 1. The impact of CTRP3 on the release of TNF-α and IL-6 in the insulin resistant 3T3-L1 adipocytes with different treatments.Mean±SD.n=9.**P<0.01 vs NC group;## P<0.01 vs IR group.
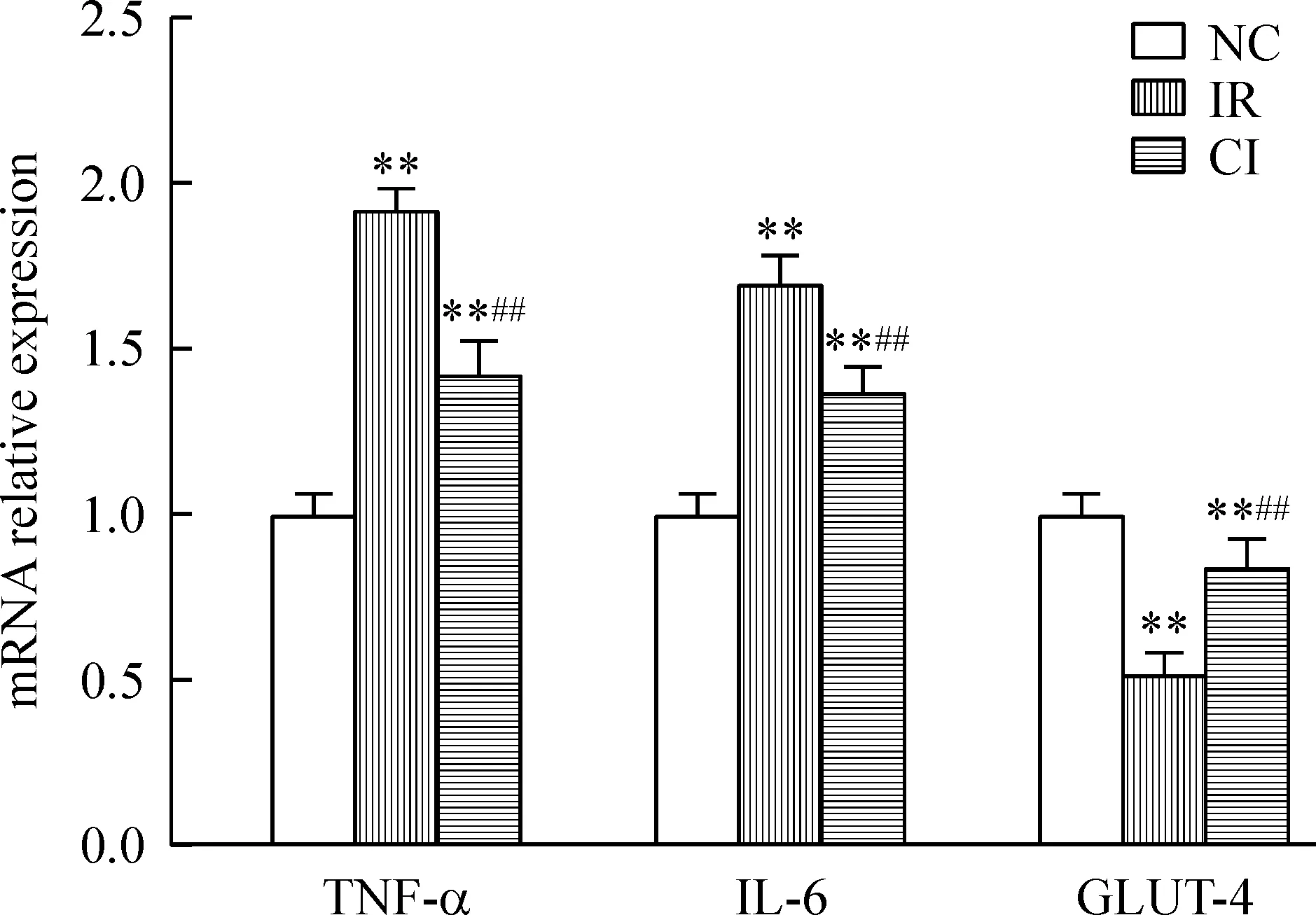
Figure 2. The relative mRNA expression of TNF-α, IL-6 and GLUT-4 in the 3T3-L1 adipocytes with different treatments.Mean±SD.n=9.** P<0.01 vs NC group; ##P<0.01 vs IR group.
4 CTRP3对胰岛素抵抗的3T3-L1脂肪细胞GLUT-4 mRNA及蛋白表达的影响
与NC组相比,IR组GLUT-4 mRNA及蛋白相对表达量分别降低了48.0%及46.0%(均P<0.01);250 μg/L CTRP3干预12 h,其GLUT-4 mRNA及蛋白表达水平较IR组分别增加61.5%及55.6%(均P<0.01),这可能是CTRP3干预导致葡萄糖摄取率增加的直接原因,见图2、3。
讨 论
脂肪组织及脂肪因子与胰岛素抵抗及2型糖尿病关系密切,脂肪组织既是胰岛素作用的重要靶器官,又通过分泌多种脂肪因子、细胞因子、炎症因子等调节胰岛素敏感性,成为连接肥胖与2型糖尿病的重要因素。目前已经发现了瘦素、脂联素、抵抗素、内脏脂肪素等多种脂肪因子,并且还不断有新的脂肪因子被报道。脂联素是目前研究最为广泛的脂肪因子之一,具有增加胰岛素敏感性、抗炎、抗动脉粥样硬化等作用,其血浆浓度与胰岛素抵抗及2型糖尿病密切相关。但令人意外的是敲除脂联素基因的动物模型仅仅表现出轻度代谢异常,提示体内可能还存在其它与脂联素功能重叠的代谢调节因子[6]。正是在探索上述因子的研究中发现了C1q/TNF-相关蛋白1-15(CTRP1-15),其中与糖脂代谢关系较为密切的是CTRP3。相关研究表明CTRP3具有改善整体血糖代谢的作用,其机制可能与抑制肝糖输出有关,但是CTRP3对胰岛素抵抗的作用并不清楚。因此,本研究通过构建脂肪细胞胰岛素抵抗模型,给予重组CTRP3蛋白干预,观察其对脂肪细胞葡萄糖摄取率的效应,并初步探讨炎症在其中的作用。
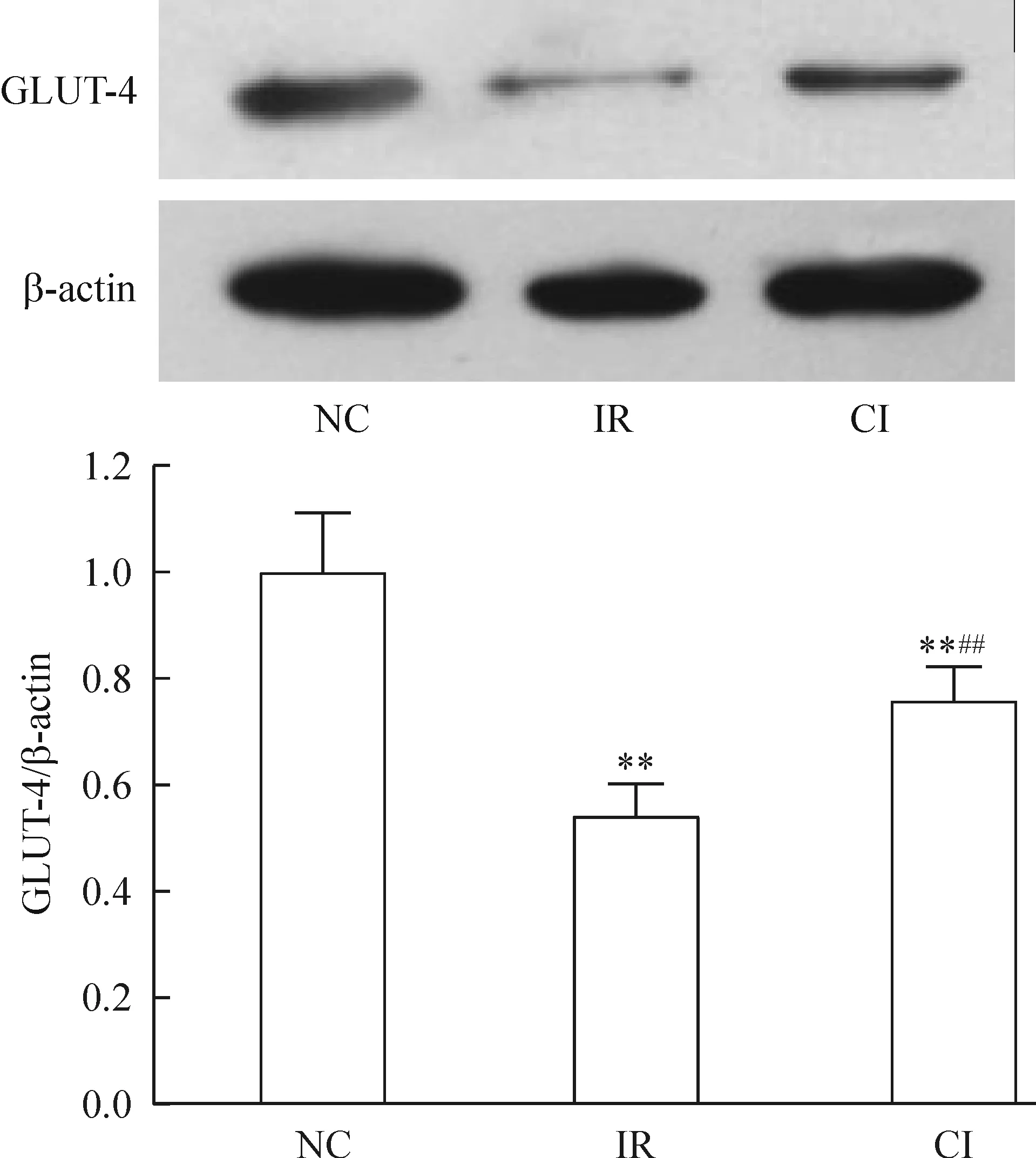
Figure 3. The relative protein expression of GLUT-4 in the insulin resistant 3T3-L1 adipocytes with different treatments.Mean±SD.n=9. ** P<0.01 vs NC group; ##P<0.01 vs IR group.
本研究通过软脂酸构建胰岛素抵抗的3T3-L1脂肪细胞模型,结果显示软脂酸培养后3T3-L1脂肪细胞葡萄糖摄取率及葡萄糖消耗量较对照组均显著降低,提示软脂酸培养的脂肪细胞存在明显胰岛素抵抗。以不同浓度(10、50、250、1 250 μg/L)重组CRTP3蛋白干预12 h,结果发现随CTRP3浓度增加,脂肪细胞葡萄糖消耗量及葡萄糖摄取率均显著增加,250 μg/L可能为其最佳作用浓度。进一步对CTRP3作用的时间-效应关系研究发现,随CTRP3作用时间(2、6、12、24 h)的增加,脂肪细胞葡萄糖消耗量及葡萄糖摄取率均明显增加,12 h时其作用已趋于最大。这些结果提示脂肪因子CTRP3在一定范围内具有时间、剂量依赖性地促进脂肪细胞利用葡萄糖,改善其胰岛素敏感性的效应。
为进一步探讨CTRP3改善胰岛素抵抗的脂肪细胞胰岛素敏感性的机制,本研究观察了250 μg/L重组CTRP3蛋白对脂肪细胞炎症因子TNF-α与IL-6 mRNA表达及分泌量的影响。结果显示CTRP3可以显著降低TNF-α、IL-6 mRNA表达水平及蛋白分泌量,提示CTRP3可能通过下调脂肪细胞炎症因子表达改善其胰岛素敏感性。Kopp等[3]的研究表明CTRP3可以抑制脂多糖(LPS)、游离脂肪酸(十二烷酸)以及Toll样受体配体等诱导的脂肪细胞及单核细胞炎症因子表达,与本研究结果类似;而下调CTRP3的表达则导致脂肪细胞单核细胞趋化蛋白-1表达增多、脂联素水平下降,以及脂肪细胞内脂滴体积及甘油三酯含量减少,即诱导成熟脂肪细胞转化为非成熟细胞,诱发炎症反应,提示CTRP3在调节脂肪细胞炎症反应中具有重要作用,但该研究并未观察CTRP3对脂肪细胞胰岛素敏感性的效应。
炎症因子可能通过多种机制损害胰岛素信号转导,导致胰岛素抵抗。炎症信号通路主要包括IκK/ NF-κB(核因子κB抑制物激酶/核因子κB)途径 、JNK(c-Jun氨基末端激酶)途径、SOCS(细胞因子信号抑制物)-3通路等。IκK是NF-κB炎症信号通路的关键成分,同时又是胰岛素受体和IRS(胰岛素受体底物) 的丝氨酸磷酸化激酶,可以催化IRS 307 位的丝氨酸磷酸化,导致正常的酪氨酸磷酸化减少,抑制胰岛素受体与IRS 的结合,损害胰岛素信号转导[7];JNK 属于促分裂原活化蛋白激酶中的一个途径, 也可通过磷酸化IRS 307 位的丝氨酸,损害胰岛素信号转导[8];SOCS-3是细胞因子激活途径的负反馈调节物,通过竞争性抑制IRS酪氨酸磷酸化,减少IRS与磷脂酰肌醇3-激酶的调节亚单位p85 的结合,以及通过泛素介导的IRS降解等机制损害胰岛素信号转导[9],最终引起葡萄糖转运子(glucose transporter,GLUT)表达下调,葡萄糖转运减少,导致葡萄糖利用率下降,出现胰岛素抵抗。本研究发现,CTRP3干预后,随炎症因子表达水平下降,脂肪细胞GLUT-4基因及蛋白表达水平均增加,这可能是脂肪细胞葡萄糖利用率增加的直接原因,也进一步提示CTRP3具有改善3T3-L1脂肪细胞胰岛素敏感性的作用。
总之,本研究表明新的脂肪因子CTRP3具有改善脂肪组织胰岛素敏感性的效应,其机制可能与下调脂肪细胞炎症因子表达,改善胰岛素信号转导,增加葡萄糖转运子表达等有关,提示CTRP3可能是胰岛素抵抗及2型糖尿病防治研究的新的分子靶点。但是,CTRP3下调脂肪细胞炎症因子表达的信号机制以及CTRP3对脂肪细胞胰岛素信号通路的直接效应本研究并未涉及,尚需要进一步研究。
[参 考 文 献]
[1]OdegaardJI,ChawlaA.Pleiotropicactionsofinsulinresistanceandinflammationinmetabolichomeostasis[J].Science, 2013, 339(6116):172-177.
[2] Peterson JM, Wei Z, Wong GW. C1q/TNF-related protein-3 (CTRP3), a novel adipokine that regulates hepatic glucose output[J]. J Biol Chem, 2010, 285(51): 39691-39701.
[3]KoppA,BalaM,BuechlerC,etal.C1q/TNF-relatedprotein-3representsanovelandendogenouslipopolysaccharideantagonistoftheadiposetissue[J].Endocrinology, 2010, 151(11):5267-5278.
[4] Kopp A, Bala M, Weigert J, et al. Effects of the new adiponectin paralogous protein CTRP-3 and of LPS on cytokine release from monocytes of patients with type 2 diabetes mellitus[J]. Cytokine, 2010, 49(1):51-57.
[5]YooHJ,HwangSY,HongHC,etal.ImplicationofprogranulinandC1q/TNF-relatedprotein-3 (CTRP3)oninflammationandatherosclerosisinsubjectswithorwithoutmetabolicsyndrome[J].PLoSOne, 2013, 8(2):e55744.
[6] Sahin-Efe A, Katsikeris F, Mantzoros CS. Advances in adipokines[J]. Metabolism, 2012, 61(12):1659-1665.
[7]SalvadóL,CollT,Gómez-FoixAM,etal.Oleatepreventssaturated-fatty-acid-inducedERstress,inflammationandinsulinresistanceinskeletalmusclecellsthroughanAMPK-dependentmechanism[J].Diabetologia, 2013,56(6):1372-1382.
[9]JorgensenSB,O’NeillHM,SylowL,etal.DeletionofskeletalmuscleSOCS3preventsinsulinresistanceinobesity[J].Diabetes, 2013, 62(1):56-64.
