利用慢病毒载体系统构建稳定表达癌基因PIN1的鼻咽上皮细胞株
2014-08-13李五一刘建国罗国炜
李五一 ,徐 萌,刘建国,罗国炜
(1.遵义医学院附属第五医院 口腔科,广东 珠海 519125;2.遵义医学院珠海校区 口腔系,广东 珠海 519041;3.遵义医学院 口腔学院,贵州 遵义 563099;4贵州省高等学校 口腔疾病研究特色重点实验室,贵州 遵义 563099;5.香港中文大学 病理解剖及细胞学系,威尔斯亲王医院,华南国家肿瘤重点实验室,香港 999077)
病毒载体(Viral vectors)是一种常使用于分子生物学的工具,利用病毒具有传送其基因组进入其他细胞,进行感染的原理,将遗传物质带入细胞, 主要应用于基础研究、基因疗法或疫苗。目前基因工程常用的病毒可分为逆转录病毒、慢病毒与腺病毒。与传统的脂质体转染相比较,慢病毒载体最大的优点就是可以感染分裂细胞和非分裂细胞,可转染难转染细胞,解决转染效率低的问题。正常的鼻咽上皮细胞,转染效率低且不稳定,后续实验效果差。本研究拟采用第3代慢病毒载体系统感染鼻咽上皮细胞构建稳定表达癌基因肽脯氨酰异构酶PIN1的鼻咽上皮细胞株,免疫荧光、RT-PCR、westernblot检测目的基因PIN1的表达,为下一步进行相关的功能学实验奠定基础。
1 材料与方法
1.1 材料 正常鼻咽上皮细胞株NP69、293TN细胞,由香港中文大学鼻咽癌研究室保存。角质形成细胞无血清培养基(Keratinocyto serm-free medium,KSFM)、牛脑垂体提取液(BPE)、重组表皮生长因子(rEGF)购自invitrogen。RPIM-1640培养液购自Sigma,10% 胎牛血清购自Gibico。Lipofectamine2000 脂质转染试剂,购自life technologies公司。Lenti Starter kit第3代慢病毒包装系统,购自system biosciences。RNA抽提试剂TRIZOL,购自invitrogen,RT-qPCR试剂盒,Westernblot 相关试剂购自life technologies。BCA蛋白含量测定试剂盒,购自Pierce。PIN1引物和Actin引物由life technologies公司合成。慢病毒载体pCDH-CMV-MCS-EF1-copGFP-PIN1(pCDH-PIN1)及pCDH-CMV-MCS-EF1-copGFP(pCDH)由香港大学Dr.RobertaPang 惠赠。
1.2 方法
1.2.1 PIN1过表达细胞株构建 将3×106293TN细胞接种到10 cm的细胞培养皿中,在含10%胎牛血清无抗生素的RPIM培养液中培养。待293TN细胞达到80%~90%融合时加入2 μg的pCDH-PIN1或pCDH、10 μg pACKH1-Plamid mix、及Lipofectamine2000进行共转染,48 h后收集含有PIN1病毒颗粒的培养液。按照1∶5的最终体积比加入PEG-it析出病毒颗粒。离心,收集病毒颗粒,PBS重悬,-80 ℃保存。
将NP69接种到T25培养瓶中,于含有BPE及rEGF的KSMF培养液中培养。待细胞达到50%~70%融合时,吸出原有培养液,换入含有PIN1病毒颗粒及TransDuxand混合物新培养液共培养。72 h后换入新的培养液常规培养。荧光显微镜下随机检测6个高倍视野,记录荧光显微镜下含有GFP细胞占总细胞数的百分比,确定NP69中PIN1的导入情况。
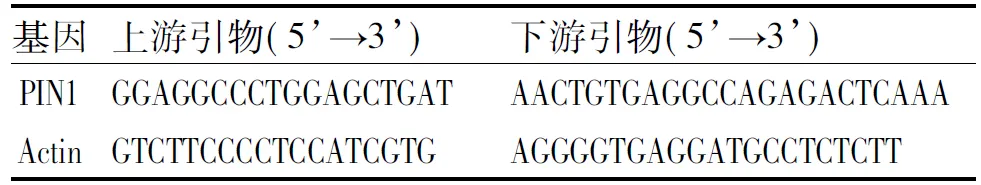
1.2.2 引物设计 采用Applied Biosysem系统设计PIN1引物和Actin引物(见表1)。
表1 PIN1及Actin的引物序列
1.2.3 提取RNA 收集NP69-PIN1细胞,加入1 mL TRIZOL,200 μL氯仿,混匀15 s,室温静置2~3 min。离心,取含有RNA的水相上清,转入干净新试管。加入异丙醇,离心,得到沉淀的RNA,75%酒精洗涤,干燥。测定RNA的浓度。
1.2.4 RT-qPCR测定目的基因mRNA含量 取适量RNA加入1 μL DNaseI,室温孵育15 min除去染色体DNA,加入1 μL EDTA,65 ℃10 min使DNaseI失活,将处理好的RNA用于cDNA合成。根据Taqman试剂盒说明,取适量RNA加入RT缓冲液、5.5 mm氯化镁、500 μm dNTP、2.5 μm Random Hexamer、0.4 U/μL RNase抑制剂、1.25 U/μL Multiscribe逆转录酶。25 ℃10 min,48 ℃30 min,95 ℃5 min,合成cDNA。
根据SYBR Green Master Mix 试剂盒指引,取适量cDNA,加入SYBR Green Master Mix、Actin及PIN1引物,采用7500 Fast real-time PCR system 进行扩增,计算CT值。
1.2.5 Westernblot 检测目的蛋白的表达 收集细胞,加入RIPA(含有1%NP40、0.5%脱氧胆酸钠和0.1%SDS的PBS)和蛋白酶抑制剂,冰上裂解蛋白20 min,离心取上清,BCA法测定蛋白浓度。取适当蛋白加入SDS上样buffer, 煮沸5 min,冰上冷却,SDS PAGE电泳,转膜,5%脱脂牛奶封闭,加入一抗、二抗,显影,照片,检测目的蛋白的表达情况。显影结果经Image J 软件进行半定量分析,计算净光密度值,结果以相对平均灰度值(Mean Gray Value MGV)×面积(mm2)表示。蛋白的相对含量=(目的蛋白条带MGV×mm2)/(β-actin条带MGV×mm2)

2 结果
2.1 荧光显微镜观察GFP表达情况 统计NP69-PIN1细胞株中PIN1的转染率,结果发现94%±2.09%的NP69细胞携带PIN1,采用第3代慢病毒载体系统感染鼻咽上皮细胞效果理想(见图1)。
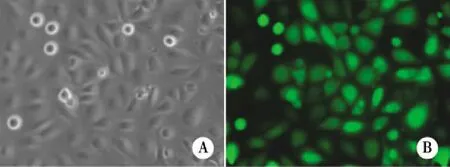
A:倒置显微镜下图像;B:荧光显微镜下图像。图1 PIN1在NP69中过表达
2.2 PIN1 mRNA的表达情况 采用RT-qPCR检测发现,经第3代慢病毒载体系统感染鼻咽上皮细胞的PIN1mRNA 表达水平是对照组的20~25倍,在转录水平上明显提高了PIN1的表达量,具有统计学意义。(见图2,具体相对CT比值的比较见表2)。
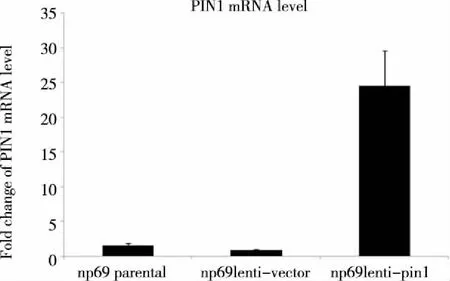
图2 RT-qPCR检测显示PIN1 mRNA在NP69中过表达
表2鼻咽上皮细胞的PIN1mRNA相对CT比值的比较

组别相对CT比值均数±标准差组别 相对CT比值均数±标准差NP69lenti-vector 1±0.002512NP69lenti-vector 1±0.002512NP69lenti-PIN124.551±3.2719NP69 parental 1.559±0.3797t-12.467t-2.551P 0.000P 0.125
2.3 PIN1蛋白的表达情况 Westernblot检测结果(见图3),分别在NP69parental、NP69-vector、NP69-PIN1组中检测到相关蛋白。18KD处检测到目的蛋白PIN1条带,43KD处检测到内参β-actin。结果显示经第3代慢病毒载体系统感染鼻咽上皮细胞的PIN1蛋白表达量明显高于对照和空白组,蛋白表达量分析(见表3)。
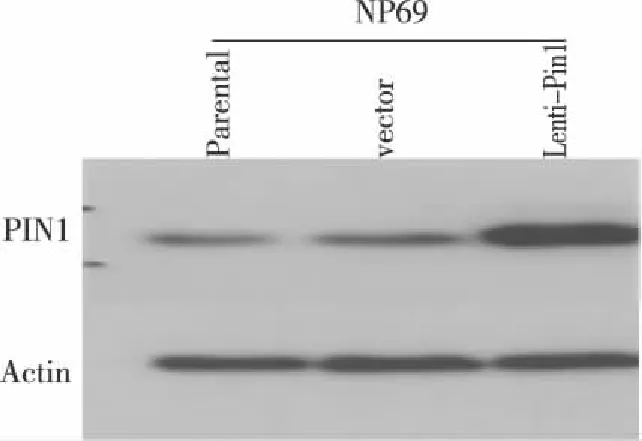
图3 Westernblot检测显示PIN1在NP69中过表达
表3鼻咽上皮细胞中PIN1的蛋白相对含量

组别蛋白的相对含量均数±标准差 组别 蛋白的相对含量均数±标准差NP69lenti-vector0.6224±0.07098NP69parental 0.3541±0.008642NP69lenti-PIN10.08528±0.00908NP69lenti-PIN10.08528±0.00908t6.548t-68.899P 0.003P 0.000
3 讨论
肽脯氨酰异构酶PIN1可特异性地催化蛋白质中磷酸化的Ser/Thr-Pro酰胺键的顺反异构,改变蛋白质的构象 ,调控蛋白质的活性,磷酸化状态,蛋白与蛋白的相互作用,蛋白的稳定及亚细胞定位,从而调节一系列与Serine-threonie相关的细胞信号通路,激活一系列肿瘤基因,生长因子;抑制抑癌基因和生长抑制因子,促进肿瘤的发生[1-3]。研究显示PIN1可以在前列腺癌,宫颈癌,恶性黑色素瘤等多种肿瘤中高表达, 且PIN1的高表达预示着较差的预后和较短时间的肿瘤复发[4]。
鼻咽癌(Nasopharyngeal carcinoma)是一种与艾巴氏病毒(Epstein-Barr virus, EBV)密切相关的上皮性恶性肿瘤,为我国南方地区最常见的恶性肿瘤之一[5]。EB病毒(EBV)感染、基因易感性和环境因素(饮食和非饮食)是鼻咽癌的三大诱因[6]。鼻咽癌放疗后5年生存率 I~II期在60%以上, III~IV期则只有20%~40%[7], 因此早期发现对提高鼻咽癌的生存率至关重要。研究鼻咽癌早期发生的分子机制,揭示调控肿瘤发生的关键信号分子,对改善鼻咽癌总体预后至关重要。课题组的前期免疫组化、Westernblot研究显示PIN1在鼻咽癌组织中高表达。为了进一步研究PIN1 在鼻咽癌中的潜在作用,课题组拟在鼻咽上皮细胞系 NP69 中建立了PIN1 过表达细胞克隆株。建立基因过表达细胞克隆株通常有两种常用的方法,一脂质体转染法,二病毒载体转染法,包括慢病毒、逆转录病毒和腺病毒[8]。慢病毒载体,以Ⅰ型HIV 为基础,高效感染分裂期及非分裂期细胞( 优于逆转录病毒) ,目的基因可整合至靶细胞基因组长期表达,同时具有较小的免疫反应( 优于腺病毒),是目前较理想的基因转移载体[9]。慢病毒载体的发展大致经过3个阶段:第1代慢病毒载体使用三质粒系统,在构建3种包装质粒时,为了降低产生有复制能力的病毒的可能性,尽可能减少3种质粒之间的同源序列,但包装质粒中仍然保留了HIV的附属基因。第2代慢病毒载体系统是在第1代基础上的改进,在包装质粒中删去了HIV的所有附属基因,增加了载体的安全性。第3代慢病毒载体系统又增加了2个安全特性:一是构建了自身失活的慢病毒载体,即删除了U3区的3’ LTR,使载体失去HIV-1增强子及启动子序列,即使存在所有的病毒蛋白也不能转录出RNA;二是去除了tat基因,代之以异源启动子序列,这样原始的HIV基因组中的9个基因在慢病毒载体中只保留了3个( gag、pol和rev)[10]。第3代慢病毒载体系统更加安全,因此课题组采用第3代慢病毒载体感染鼻咽上皮细胞,构建稳定表达癌基因PIN1的鼻咽上皮细胞株。
荧光显微镜观察慢病毒载体自带的GFP荧光颗粒,发现PIN1基因已整合到94%±2.09%的NP69细胞中,转染效率高。经过传代培养30代后,仍可观察到GFP荧光颗粒,转染效果稳定。RT-qPCR、Westernblot检测发现NP69-PIN1组中PIN1的mRNA和蛋白水平明显高于对照组和空白组。本研究成功在鼻咽上皮细胞系 NP69 中构建PIN1 过表达细胞克隆株NP69-PIN1,为进一步在细胞模型和动物模型中研究PIN1在鼻咽癌中的生物学功能奠定基础。
[参考文献]
[1] Lu K P,Hanes S D,Hunter T.A human peptidyl-prolyl isomerase essential for regulation of mitosis[J]. Nature,1996,380(6574):544-547.
[2] Liou Y C, Zhou X Z,Lu K P.Prolyl isomerase Pin1 as a molecular switch to determine the fate of phosphoproteins[J]. Trends Biochem Sci,2011,36(10):501-514.
[3] Lee T H, Pastorino L,Lu K P. Peptidyl-prolyl cis-trans isomerase Pin1 in ageing, cancer and Alzheimer disease [J]. Expert Rer Mol Med,2011,13:e21.
[4] Bao L,Kimzey A,Sauter G,et al.Prevalent overexpression of prolyl isomerase Pin1 in human cancers[J].Am J Pathol,2004,164(5):1727-1737.
[5] Parkin D M, Pisani P,Ferlay J. Estimates of the worldwide incidence of 25 major cancers in 1990[J].Tnt J Cancer,1999,80(6):827-841.
[6] 刘红刚,高岩.头颈部肿瘤病理学和遗传学 [M].北京:人民卫生出版社,2006:91-111.
[7] Baujat, B, Audry H, Bourhis J, et al. Chemotherapy in locally advanced nasopharyngeal carcinoma: an individual patient data meta-analysis of eight randomized trials and 1753 patients [J]. Tnt J Radiat Oncol Biol Phys,2006,64(1):47-56.
[8] Thorne B A, Takeya R K, Peluso R W.Manufacturing recombinant adeno-associated viral vectors from producer cell clones[J]. Hum Gene Ther,2009,20(7):707-714.
[9] Rothe M, Modlich U, Schambach A.Biosafety challenges for use of lentiviral vectors in gene therapy[J]. Curr Gene Ther,2013,13(6):453-468.
[10] Kurth R,Bannert N. Retroviruses: Molecular Biology, Genomics and Pathogenesis[M]. Caister Academic Press,2010:347-370.
