水凝胶型防龋基因疫苗pVAX1-gtfB/CAT经黏膜途径免疫兔的实验研究
2014-08-13管晓燕刘建国白国辉肖茜文张丁文董竞男
管晓燕,李 敏,刘建国,李 虎,白国辉,肖茜文,张丁文,董竞男
(1.遵义医学院 口腔学院,贵州 遵义 563099;2.贵州省高等学校口腔疾病研究特色重点实验室,贵州 遵义 563099)
龋病是由细菌引起的牙体硬组织的慢性感染性疾病,链球菌属的变异链球菌是重要的致龋菌,葡萄基转移酶(Glucosyltransferase, GTF)是其重要的毒力因子之一,也是主要的免疫抗原[1]。GTF的催化活性区(Catalytic, CAT)可以催化蔗糖水解酶的活性,使其产生葡聚糖,对变异链球菌在牙面的附着和龋病发生有着重要的作用。研究已经证实,以GTF和GTF/ CAT为抗原免疫动物能够有效地控制龋病发生。为了提高基因疫苗的免疫原性,增强免疫应答,更好地保护宿主,选择具有缓释功能的递送系统搭载基因疫苗已经成为研究热点,缓释系统能够保护疫苗本身的性质不受破坏,为疫苗发挥作用提供了有利环境。课题组前期已成功构建了防龋基因疫苗pVAX1-gtfB/CAT,制备了以温敏型生物降解水凝胶PLGA-PEG-PLGA作为缓释系统的水凝胶型防龋基因疫苗pVAX1-gtfB/CAT[2-3]。本实验将该水凝胶型防龋基因疫苗经口服和鼻腔黏膜滴注两种途径免疫新西兰大白兔,观察特异性抗体的动态变化及其在动物免疫部位的蛋白表达,分析水凝胶型防龋基因疫苗pVAX1-gtfB/CAT的免疫原性,为后续实验提供一定的实验依据。
1 材料与方法
1.1 实验动物 新西兰大白兔20只,雄性,普通级(购于第三军医大学野战外科研究所医学实验动物中心,许可证号:SCXK(渝)20070005)。
1.2 主要试剂及主要仪器 PLGA-PEG-PLGA(由电子科技大学微电子与固体电子学院郝建原教授提供);鼠抗GTF多克隆抗体(课题小组前期制备);辣根过氧化酶标记的羊抗兔IgG (美国Amresco公司);辣根过氧化酶标记的羊抗兔IgA(美国Genet公司);SP法免疫组化试剂盒(博士德公司);生物素标记的第二抗体(博奥生物公司);变异链球菌GTF(课题小组前期分离纯化);重组质粒pVAX1-gtfB/CAT(课题小组前期构建);空载体质粒pVAX1(美国Invitogen公司);酶联免疫检测仪(美国Instruments.Inc公司);光学显微镜(日本Olympus公司),柱式质粒(大量)纯化试剂盒(美国Omega公司)。
1.3 重组质粒pVAX1-gtfB/CAT和空载体质粒pVAX1的制备 采用柱式质粒(大量)纯化试剂盒按说明书制备重组质粒pVAX1-gtfB/CAT和空载体质粒pVAX1。
1.4 疫苗制备[3]分别准确称量200 μg重组质粒pVAX1-gtfB/CAT及空载质粒pVAX1与0.8 mL 20%水凝胶混合,恒温振荡器振荡过夜(100 r/min),备用。
1.5 动物分组与免疫 20只新西兰大白兔随机分为5组,每组4只。分别为:A组:pVAX1-gtfB/CAT口服组,B组: pVAX1-gtfB/CAT鼻腔黏膜滴注组,C组:空载体pVAX1质粒口服组,D组:空载体pVAX1+水凝胶口服组,G组:生理盐水鼻腔黏膜滴注组。每间隔1周免疫1次,共3次。每次免疫质粒剂量为200 μg/只。
1.6 样本采集 唾液样本的收集:将2%的硝酸毛果芸香碱按照0.2 mg/100g的比例,注射入动物颈部皮下,采集唾液,离心,收集上清液,备用。血液样本的收集:将兔子固定在固定器上,静脉采血,离心,收集血清,备用。于免疫前和免疫后第1、2、3、4、6、8、10、12、14、16周采集动物血液及唾液样本。组织切片制备:第3次免疫后每组处死1只动物,取小肠黏膜和鼻腔黏膜组织,常规石蜡包埋。
1.7 特异性抗体的检测 采用酶联免疫吸附实验(ELISA)检测特异性抗体水平。利用抗原包被缓冲液(PBS,pH9.6)将蛋白GTF稀释成2.5 μg/mL包被96孔板,每孔100 μL;用3%BSA封闭各反应孔,每孔200 μL,37 ℃湿盒孵育,2 h后弃去封闭液,分别将稀释后的唾液(1∶2)和血清(1∶80)加到酶标板的各反应孔中,每孔100 μL,用塑料保鲜膜封好微量酶标板,37 ℃湿盒孵育2 h;然后分别将辣根过氧化酶标记羊抗兔IgA(1∶1 250)和辣根过氧化酶标记羊抗兔IgG(1∶4 000)加到酶标板各反应孔中,每孔100 μL,用塑料保鲜膜封好,37 ℃湿盒孵育2 h向各反应孔中加入TMB底物使用液,每孔100 μL,用塑料保鲜膜封好后,37 ℃湿盒中避光显色25~30 min后,再向每孔加入50 μL终止液终止反应,利用酶标仪测定各反应孔OD450值。
1.8 目的蛋白表达的检测 采用免疫组织化学染色SP法检测目的蛋白的原位表达。将石蜡切片脱蜡;将载玻片放入盛有0.01M枸橼酸盐缓冲液的微波用塑料盒中放入微波炉中;洗片后每张切片加1滴3%过氧化氢去离子水,室温孵育10 min后,每张切片加1滴正常非免疫动物血清,室温放置15 min后,每张切片滴加(1∶50)的一抗(鼠抗GTF多克隆抗体:为本课题组前期制备)50 μL,4 ℃过夜;次日洗片后每张切片加1滴生物素标记的第二抗体,室温10 min;洗片后每张切片滴加1滴链霉素抗生物素-过氧化物酶溶液,每张切片滴加30 μL DAB显色,显微镜下控制染色,当组织或目标细胞阳性表达部位为深棕色或棕黄色时即可终止显色,将片子冲洗脱水后封片。
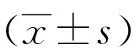
2 结果
2.1 唾液中SIgA型抗GTF抗体水平 实验组唾液中SIgA型抗GTF抗体水平在免疫后保持明显上升趋势,显著高于对照组,差异有统计学意义(P<0.05),第6周时达到最高峰,随后开始下降。口服组和鼻腔黏膜滴注组抗体水平变化趋势无明显差异,提示口服和鼻腔黏膜滴注免疫对SIgA型抗GTF抗体在唾液中的免疫效果基本相同(见图1)。
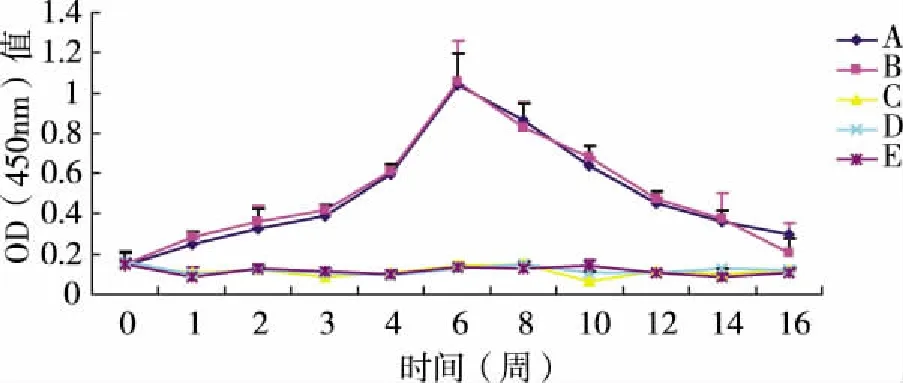
图1 唾液中SIgA型抗GTF抗体水平
2.2 血清中SIgA型抗GTF抗体水平 免疫后血清中SIgA型抗GTF抗体水平明显高于对照组,差异有统计学意义(P<0.05),在第3周至第12周保持相对较高水平。口服组和鼻腔黏膜滴注组抗体水平有少许差异,但变化趋势相似,提示口服和鼻腔黏膜滴注免疫对SIgA型抗GTF抗体在血清中的免疫效果基本相同(见图2)。

图2 血清中SIgA型抗GTF抗体水平
2.3 唾液中IgG型抗GTF抗体水平 免疫后各实验组唾液中IgG型抗GTF抗体明显高于对照组,差异有统计学意义(P<0.05)。第6周抗体水平最高,随后抗体水平开始缓慢下降。在第6、8、10周时,口服组和鼻腔黏膜滴注组抗体水平有一定差异,口服组高于鼻腔黏膜滴注组(见图3)。

图3 唾液中IgG型抗GTF抗体水平
2.4 血清中IgG型抗GTF抗体水平 免疫后实验组血清中IgG型抗GTF抗体水平明显高于对照组,差异有统计学意义(P<0.05)。在第6、8、12、14周时,抗体水平有差异,但无统计学意义,不影响整体的变化趋势。提示pVAX1-gtfB/CAT成功表达,使血清中IgG型抗GTF抗体水平变化明显,效果显著(见图4)。
2.5 注射部位目的蛋白的表达 免疫组织化学检测可见外源基因在口服组小肠黏膜的细胞胞浆内和鼻腔黏膜滴注组鼻黏膜上皮下方的固有层中表达(见图5)。

A :pVAX1-gtfB/CAT口服组目的蛋白在小肠黏膜上皮细胞胞浆中的阳性表达;B: pVAX1口服组(对照组)目的蛋白在小肠黏膜上皮细胞胞浆中的阴性表达;C:pVAX1-gtfB/CAT鼻腔黏膜滴注组目的蛋白在鼻腔黏膜固有层结缔组织成纤维细胞胞浆中的阳性表达;D:pVAX1鼻腔黏膜滴注组(对照组)目的蛋白在鼻腔黏膜固有层结缔组织成纤维细胞胞浆中的阴性表达。图5 目的蛋白的原位表达情况(SP法,×200)
3 讨论
水凝胶是在空间结构上呈三维网状结构的一类高分子材料,具有独特的吸水和良好的生物相容性、药物释放的可控性、生物粘附作用和可降解等新型递送系统所具备的优点,目前在基因疫苗、功能性材料、组织工程等领域得到了广泛的应用,尤其是在抗菌素、疫苗、避孕药和激素等传送药物方面[4]。
水凝胶的最新发展方向是智能型水凝胶,包括温度敏感型、pH 敏感型、温度和pH双重敏感型以及磁性响应型等[5]。温度敏感性水凝胶高分子材料对于温度的变化具有非常高的敏感度,该凝胶具有最低临界共溶温度,其溶胀与收缩性随温度变化并不是呈线性,而是在某一温度下水凝胶的体积表现为突然的收缩和膨胀。具体表现为在较低温度下溶胀度较高,在相对较高温度下溶胀度比较低。许多研究表明,将此类水凝胶作为药物的缓释系统,在机体不同温度进行可控性释放方面的研究具有非常重要意义。孙佳丽等[6]用化学方法得到了水溶性良好,同时在37 ℃时水凝胶溶胶向凝胶转变的时间小于10min的改性材料CS-PEG;经过体外释药实验,发现该CS-mPEG水凝胶控释作用较好,亲水能力强,有助于保护蛋白活性不被破坏。吉秋霞等[7]制备CS-HTCC/GP温敏水凝胶,通过检测对牙龈卟啉单胞菌、中间普氏菌和伴放线放线杆菌抑制作用,证实其不仅可作为药物载体参与局部缓释系统的组成, 同时可作为活性因子参与杀菌、抑菌,具有作为牙周局部用药的潜力。本实验所用的温敏型可生物降解PLGA-PEG-PLGA水凝胶是三段嵌合共聚物形成的网状体系,是利用材料空隙储存药物[4,8]。其在低于低临界溶液温度(Lower Critical Solution Temperature,LCST)时凝胶变为溶液相,高于该温度时又由液相变为凝胶状,可以在凝胶液相时同基因疫苗混匀形成一个稳定的缓释体系,发挥缓释作用,是比较理想的基因疫苗递送系统。
口腔中抵抗龋病的抗体成分主要来源于黏膜免疫系统,如何使防龋疫苗有效激活黏膜免疫系统,产生高滴度的特异性SIgA是研制防龋疫苗的关键[9]。由于黏膜免疫操作简单以及同时可诱导黏膜和系统免疫反应等优点[10],目前多数防龋疫苗采用鼻腔滴注、口服、灌胃、扁桃体喷雾等黏膜途径进行免疫[11]。田源等[12]将表达外源目的蛋白的转基因番茄经口服途径免疫兔后,有效地诱导了动物唾液和血液特异性抗体的产生。岳朝晖等[13]将防龋基因疫苗pcDNA3-PAc经鼻腔黏膜滴注途径免疫BALB/c小鼠,有效地诱导了黏膜免疫应答和系统免疫应答。课题组前期利用温敏性水凝胶搭载防龋基因疫苗pVAX1-gtfB/CAT免疫SD大鼠,发现疫苗在大鼠体内可以起到缓释作用,能够有效地诱导动物产生特异性抗体,并在一段时间内维持较高水平。龋齿记分分析表明,能够有效抑制SD大鼠龋齿的发生[3]。
本实验利用该水凝胶型防龋疫苗经口服和鼻腔黏膜滴注两种黏膜途径免疫新西兰大白兔,均有效地诱导动物产生特异性抗体,并且可以持续一段时间,提示该疫苗具有较好的免疫原性,能够诱导机体产生系统免疫和黏膜免疫应答,两种黏膜免疫途径都可能是该疫苗的有效免疫途径。
重组质粒pVAX1-gtfB/CAT经口服和鼻腔黏膜滴注2种途径免疫新西兰大白兔后,观察到免疫部位目的蛋白的表达,说明质粒被摄取并经转录、翻译等过程成功表达抗原蛋白分子。小肠黏膜的细胞胞浆中目的蛋白的表达可能与疫苗在M细胞中的定位吸收有关[14-15]。
水凝胶作为防龋疫苗的递送系统,拥有其独特的发展潜力,通过口服或者鼻腔黏膜滴注免疫,其缓释作用能够做到比较平稳的释放药物,达到一个长期的给药过程。同时由于其良好的生物相容性,能较好的保护疫苗不被降解,从而提高药物使用效率。但目前水凝胶的研究主要集中在制备工艺上,作为药物控释、传输的理论及应用研究还不够深入,同时因为水凝胶力学性能差等方面的限制,要将水凝胶实际运用临床还有待更加深入的研究,但作为口服防龋疫苗的搭载系统为龋病学者提供了新的研究方向。
[参考文献]
[1] Smith D J. Dental caries vaccines:Prospects and concerns[J]. Expert RevVaccines, 2010, 9(1):1-3.
[2] 曲云鹏,刘建国,杨德琴,等.变形链球菌葡糖基转移酶gtfB/CAT真核表达质粒的构建和表达[J].上海口腔医学,2008,17(3):289-292.
[3] 亓鹏.温敏型生物降解水凝胶载体防龋基因疫苗不同途径免疫SD大鼠的实验研究[D].遵义:遵义医学院,2011.
[4] 尹大伟,周英,刘玉婷,等.水凝胶的最新研究进展[J].化工新型材料,2012,40(2):21-23.
[5] 陆晨,查刘生.智能纳米水凝胶的刺激响应性研究进展[J].功能高分子学报,2012,25(2):211-220.
[6] 孙佳丽,蒋国强,丁富新.壳聚糖-mPEG温敏水凝胶载药系统的制备及释药行为[J].清华大学学报:自然科学版,2010,50(6):909-912.
[7] 吉秋霞,邓婧,于新波,等.壳聚糖基温敏水凝胶对牙周常见致病菌的抑制作用[J].上海口腔医学,2009,18(4):397-400.
[8] 李虎,亓鹏,刘建国,等.递送系统搭载防龋疫苗的研究现状[J].医学综述,2014,20(9):1555-1558.
[9] 刘开云,孙红武,张卫军.变异链球菌防治药物的研究现状[J].国际口腔医学杂志,2012,39(5):683-685.
[10] Matsumoto Y,Suzuki S,Nozoye T, et al. Oral immunogenicity and protective efficacy in mice of transgenic rice plants producing a vaccine candidate antigen (As16) of Ascarissuum fused with cholera toxin B subunit[J].Transgenic Res,2009,18(2):185-192.
[11] 许庆安.防龋疫苗[J].中国实用口腔科杂志,2012,5(10):591-594.
[12] 田源,刘建国,白国辉,等.表达嵌合体蛋白PAcA/CTB的转基因番茄口服免疫大白兔的实验研究[J].口腔医学研究,2013,29(3):201-204.
[13] 岳朝辉,刘建国,王晶,等.防龋基因疫苗pcDNA3-PAc不同途径免疫BALB/c小鼠的实验研究[J].实用口腔医学杂志,2010,26(2):145-148.
[14] Sansonetti P J,Phalipon A.Mcell as ports of entry for enteroinvsive pathogens:mechanisms of interaction,concequences for the disease process[J].Semin Immunol,1999,11(3):193-203.
[15] 董竞男,刘建国,白国辉,等. M 细胞——开启黏膜免疫的“门户”[J]. 国际免疫学杂志,2014,37(2):101-104.
