钾与信号抑制剂对外生菌根真菌分泌乙酸的调控作用
2014-08-11杨红军时安东
杨红军,李 勇,袁 玲,时安东
(西南大学资源环境学院, 北碚 400715)
钾与信号抑制剂对外生菌根真菌分泌乙酸的调控作用
杨红军,李 勇,袁 玲*,时安东
(西南大学资源环境学院, 北碚 400715)
外生菌根真菌是森林生态系统中的重要成分,参与树木养分的吸收利用。试验液体培养外生菌根真菌,设置不同供钾水平,添加钙信号抑制剂,研究了它们的有机酸和氢离子分泌,以及乙酸分泌对供钾和信号抑制剂的响应。结果表明,供试菌株的生长,氮、磷、钾含量和吸收量因菌株不同而异,生物量变化于52.91—121.72 mg/瓶之间,相差1倍以上。外生菌根真菌吸收养分的差异可能与它们对土壤养分环境的长期适应、进化、选择有关。在外生菌根真菌的培养液中,分别检测出草酸、乙酸、苹果酸、柠檬酸和丁二酸等,以及大量的氢离子,说明菌根真菌能分解土壤含钾矿物,释放钾离子,改善寄主植物的钾营养。其中,乙酸分泌量较大,具有普遍性,低钾刺激分泌乙酸,高钾时分泌减少,其分泌速率与供钾浓度和菌丝吸钾量之间呈显著负相关(r=- 0.734,r=- 0.617,n=60)。钾对菌根真菌分泌乙酸的调控作用具有改善森林钾素营养,防止土壤养分淋失的生理和生态意义。此外,在低钾条件下,阴离子通道和钙信号抑制剂抑制外生菌根真菌分泌乙酸。说明钙信号和阴离子通道参与了乙酸分泌,缺钾可能是刺激乙酸分泌的原初信号,通过信号转导和一系列级联反应促进乙酸分泌。
外生菌根真菌;钾;信号抑制剂;乙酸分泌;土壤生态
森林是陆地生态系统中的重要成分,具有调节气候,涵养水源、净化空气等多种多样的生态功能。钾是森林需要量最多的营养元素之一,缺钾抑制树木生长发育,造成森林退化和衰亡[1]。在土壤生态系统中,钾是最丰富的矿质元素之一,但绝大部分为矿物结构钾,难于被树木吸收利用(土壤有效钾仅为全钾的1%—3%),难于满足树木营养需要[2]。因此,活化土壤无效钾对于森林钾素营养十分重要。外生菌根真菌是森林生态系统的重要组成部分。优良的外生菌根真菌与树木根系形成菌根之后,能活化土壤养分,改善树木营养,促进生长发育,提高抗病耐旱能力[3- 7]。在欧洲的森林土壤中,存在大量的低分子有机酸,包括乙酸、草酸、甲酸、丁二酸和苹果酸等,其浓度在外延菌丝尖端的土壤中高达1000g/kg,能溶解土壤岩石和矿物,释放钾、钙、镁等矿质元素[8- 10]。其中,乙酸的电离系数高达1.8×10-4,能电离大量的氢离子,产生较强的溶解作用。因此,尽管土壤严重石砾化,但由于外生菌根真菌的存在,森林仍能正常生长而不发生退化和衰亡[11]。此外,外生菌根真菌感染花旗松之后,吸收钾离子的数量增加,其原因是菌根与钾离子的亲和力(1/Km)和最大吸收速率(Imax)提高,使之能适应钾含量极低的土壤环境[12]。研究表明,钙、钾与Ca2+/K+-ATP酶和阴离子通道活性直接相关[13- 16]。因此,外生菌根真菌分泌乙酸可能同样受外源钾、钙信号传导和阴离子通道的影响,但目前未见有关报道。
试验设置不同供钾条件,研究了外生菌根真菌的生长和乙酸分泌,以及乙酸分泌对信号抑制剂的响应。旨在探讨钾素营养丰缺条件下,外生菌根真菌分泌乙酸的调控机理,为改善森林钾素营养,保持森林健康奠定理论基础。
1 材料与方法
1.1 供试菌种
在预备试验的基础上,试验选用我国不同生态条件下,具有代表性的外生菌根真菌为供试菌株,包括彩色豆马勃(Pisolithustinctorius,Pt715),从四川省凉山州干热河谷的桉树林土壤(pH值6.95)中分离获得;松乳菇(Lactariusdeliciosus,Ld2)和双色牛肝菌(Boletusbicolor,Bo15),来源于北亚热带重庆市金佛山的马尾松林土壤(pH值4.23);土生空团菌(Cenococcumgeophilum,Cg04)广泛分布于寒温带的油松森林土壤中,采自于内蒙古大青山(pH值6.47)[17],由内蒙古农业大学白淑兰教授捐赠。菌种保存于西南大学资源环境学院微生物实验室。试验前,将保存菌株接种于Pachlewski固体平板培养基上,(251)℃暗培养14—21 d备用。
1.2 试验设计
用1.146 g/LNaH2PO4代替Pachlewski培养液中的KH2PO4,分别加入0.026、 0.130、0.650 g/L K2SO4形成低钾、正常供钾和高钾培养液(分别用K1、K2和K3表示,下同),各取20 mL 置于150 mL三角瓶中,蒸汽灭菌(121 ℃,30 min)、冷却,接种一块直径为6 mm的圆形固体菌块,(25±1) ℃暗培养14 d。考虑到不同菌株的生物量差异较大,在进一步试验前先将生物量较小的合并,尽量保持各培养瓶中的菌株生物量基本一致。然后,每瓶加入0.1 mol/L CaCl2溶液1 mL预处理24 h,再分别加入20 mL含有信号抑制剂的K1、K2和K3培养液。其中抑制剂的种类和浓度如下:钙调蛋白抑制剂三氟拉嗪(TFP),150 μmol/L;内膜钙通道抑制剂钌红(RR),8 μmol/L;钙离子通道抑制剂异搏定(VP),150 μmol/L和阴离子通道抑制剂尼弗灭酸(NIF),15 μmol/L,以不加抑制剂者为对照。在(25±1) ℃条件下,暗培养48 h。试验为4个菌株 × 3种供钾水平 × 4种抑制剂的3因素试验,各处理重复5次。
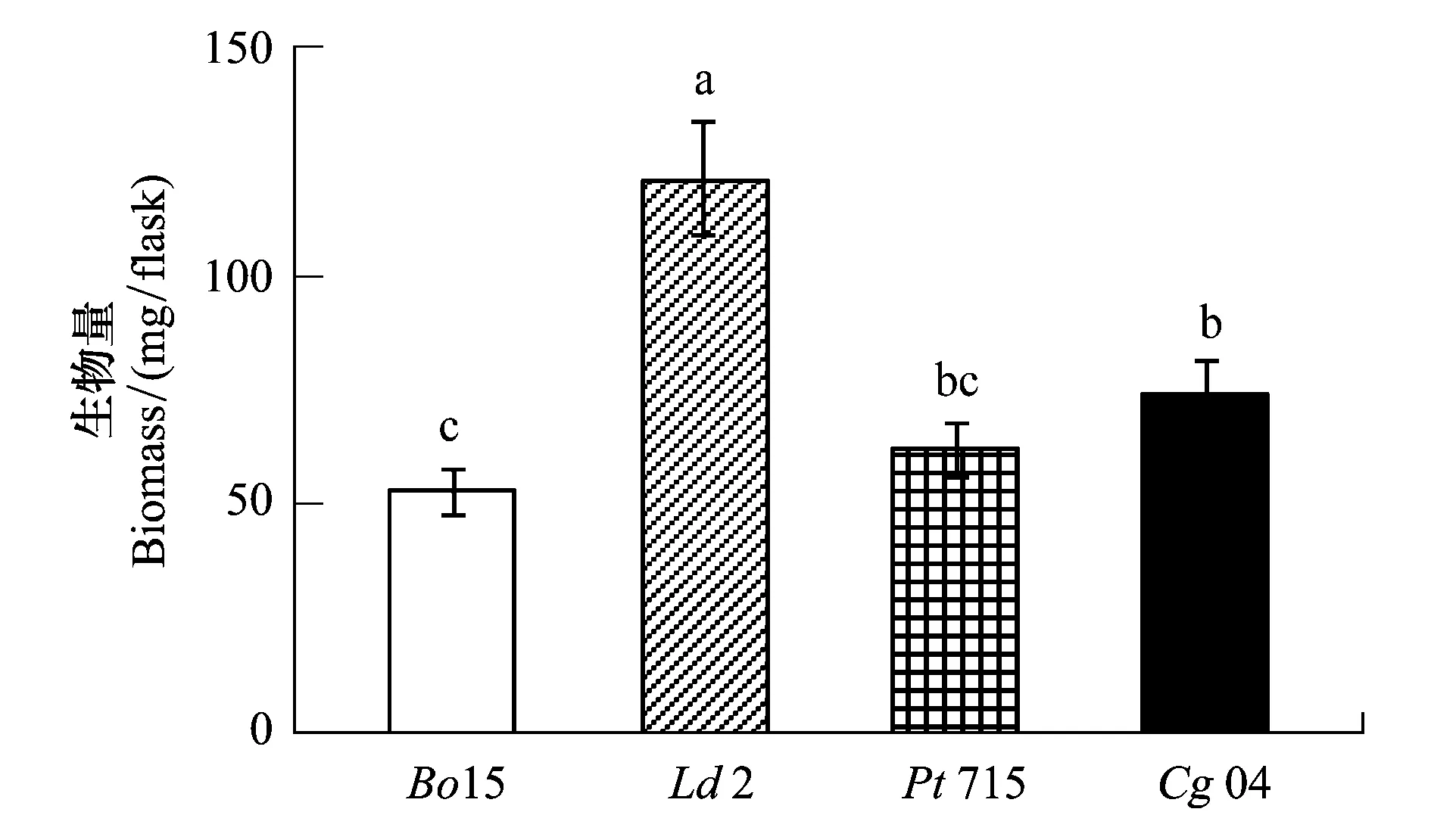
图1 不同外生菌根真菌的生物量Fig.1 Fungal biomass
1.3 测定项目与方法
过滤收集菌丝,去离子水洗净,烘干测定生物量,用硫酸-过氧化氢消化,并依次用靛酚蓝比色法、钼蓝比色法和火焰光度法测定其氮、磷、钾含量[18]。收集滤液,用PHS- 3C精密酸度计测定培养液氢离子浓度,再经酸化后用高效液相色谱仪(日本HITACHI公司生产)测定有机酸含量。其色谱条件为:Diode Array L- 7455紫外检测器,检测波长210 nm;Ion- 300有机酸分析专用柱(Phenomenex, Torrance, CA, USA),柱温35 ℃,压力450 psi;2.5 mmol/L硫酸为流动相,流速0.5 mL/min,进样量20 μL。测定的有机酸包括草酸、柠檬酸、苹果酸、丁二酸、乙酸等,其保留时间(min)依次是9.57、11.52、13.31、15.95、20.72。
1.4 数据处理
试验数据用Excel整理,SPSS(SPSS Statistics 17.0)进行LSD法多重比较(P<0.05)和Pearson法相关分析。
2 结果与分析
2.1 外生菌根真菌的生长
2.2 外生菌根真菌的养分含量与吸收量
图2可见,供试菌株不同,含氮量及氮吸收量也不一样。培养14 d之后,Bo15、Pt715和Cg04的菌丝氮含量无显著差异,但显著高于Ld2,相差1倍以上。Cg04的氮吸收量最高,达到2127.54g/瓶,Bo15、Pt715和Ld2间无显著差异,变化于1108.43—1449.52g/瓶之间。
培养14 d之后,Bo15的菌丝磷含量最高,达到13.38 mg/g-1干重,显著高于Pt715、Cg04和Ld2,相差1.74—2.21倍。Bo15的磷吸收量最高,达到760.72g/瓶,Cg04最低,仅400.31g/瓶,Pt715 和Ld2居于Bo15和Cg04之间(图2)。
图2EF是供试菌株的含钾量及钾吸收量。培养14 d之后,Bo15和Cg04的菌丝钾含量相似,但显著高于Ld2和Pt715。钾吸收量Cg04最高,达到419.71g/瓶,Pt715最低,仅185.09g/瓶,高低之间相差2.27倍,Ld2和Bo15介于二者之间。
2.3 外生菌根真菌的有机酸分泌
在外生菌根真菌的培养液中,有机酸的种类和浓度因菌株不同而异(表1)。在各菌株的培养液中均检测出草酸和乙酸;Ld2的培养液中检测到苹果酸;Pt715和Ld2的培养液中存在柠檬酸;Ld2和Bo15的培养液中有丁二酸。从有机酸的总浓度看,Pt715最高,Cg04最低,相差近3倍。需要指出的是,尽管供试菌株不同,但菌丝培养液中的乙酸浓度相似,变化于32.04—36.06 mg/L之间。相对于其他有机酸,乙酸的浓度值最高,占有机酸总浓度的26.66%—76.39%,说明乙酸是外生菌根真菌分泌的主要有机酸之一。
2.4 外生菌根真菌的氢离子分泌
培养液中的氢离子浓度变化于0.04—0.53 mg/L之间。其中,Pt715最高,Ld2和Bo15次之,Cg04最低,高低相差9.17倍(表2)。计算表明,培养液中的有机酸电离产生氢离子浓度为1.20×10-3—4.56×10-2mg/L,仅占总氢离子浓度1.37%—8.59%,故外生菌根真菌能直接分泌大量的氢离子。

图2 外生菌根真菌的养分含量与吸收量Fig.2 Fungal nutrient concentration and absorption

菌株Strain草酸/(mg/L)Oxalate苹果酸/(mg/L)Malate柠檬酸/(mg/L)Citricate丁二酸/(mg/L)Succinate乙酸/(mg/L)Acetate5种有机酸浓度∑XBo1523.78abNDND30.11a32.04a85.93bLd216.41bc24.16a21.17b20.41b36.06a118.21abPt71530.77aND58.64aND32.50a121.91aCg0411.13cNDNDND36.01a47.14c
ND表示未检出
2.5 钾和钙信号/阴离子通道抑制剂对外生菌根真菌分泌乙酸的影响
表3可见,4株外生菌根真菌中,Bo15和Ld2分泌乙酸的平均速率最高,变化于0.90 mg g-1干重 d-1—1.05 mg g-1干重 d-1之间,Pt715次之,为0.75 mg g-1干重 d-1,Cg04最低,仅0.54 mg g-1干重 d-1。
供钾水平显著影响外生菌根真菌分泌乙酸。外生菌根真菌分泌乙酸的速率低钾时最高,正常供钾次之,高钾最低,平均值分别为1.31 mg g-1干重 d-1(低钾)、0.74 mg g-1干重 d-1(正常供钾)和0.37 mg g-1干重 d-1(高钾)。
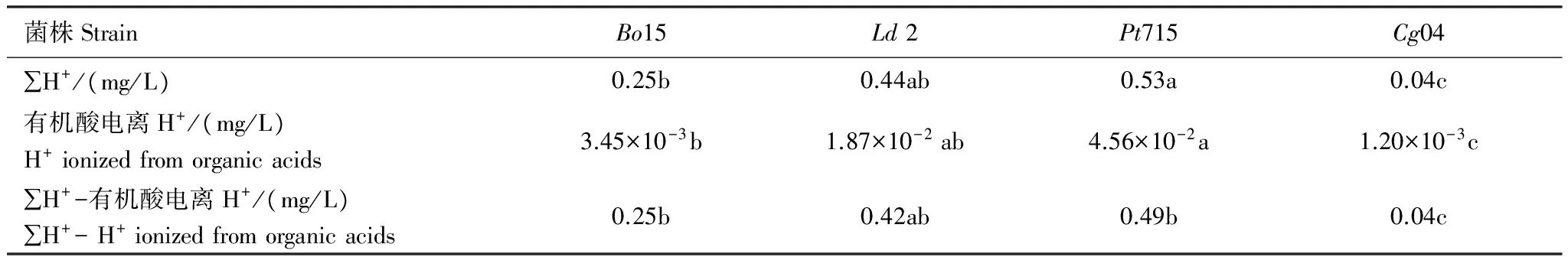
表2 培养液氢离子浓度
在同一行中,有不同字母的数据表示差异显著(p=0.05)

表3 钾和信号抑制剂对外生菌根真菌分泌乙酸速率的影响
表中同列不同字母代表差异显著(P≤0.05); *表示0.01水平差异显著,NS表示差异不著性
钙信号抑制剂对外生菌根真菌分泌乙酸速率的影响因菌株和供钾条件不同而异。在低钾条件下,钙信号/阴离子通道抑制剂不同程度地抑制菌根真菌分泌乙酸(仅RR对Pt715和VP对Cg04例外)。在正常供钾条件下,钙信号/阴离子通道抑制剂不同程度地抑制Bo15、Ld2和Pt715分泌乙酸,但对Cg04分泌乙酸无显著影响。在高钾条件下,钙信号/阴离子通道抑制剂对Bo15分泌乙酸表现出抑制作用,但对Ld2、Pt715和Cg04分泌乙酸无显著影响(仅RR对Cg04例外)。
2.6 外生菌根真菌乙酸和氢离子分泌速率与钾的相关性
表4可见,外生菌根真菌的乙酸分泌速率与培养液中钾浓度和外生菌根真菌的钾吸收量呈极显著负相关,与氢离子分泌速率极显著正相关,相关系数分别为r=-0.734*、r=-0.617*、r=0.404*(n=60)。氢离子分泌速率与培养液中钾浓度以及钾吸收量呈极显著负相关,相关系数分别为r=-0.453*、r=- 0.643*(n=60)。供钾浓度与外生菌根真菌钾的吸收量呈极显著正相关,相关系数为r=0.471*(n=60)。
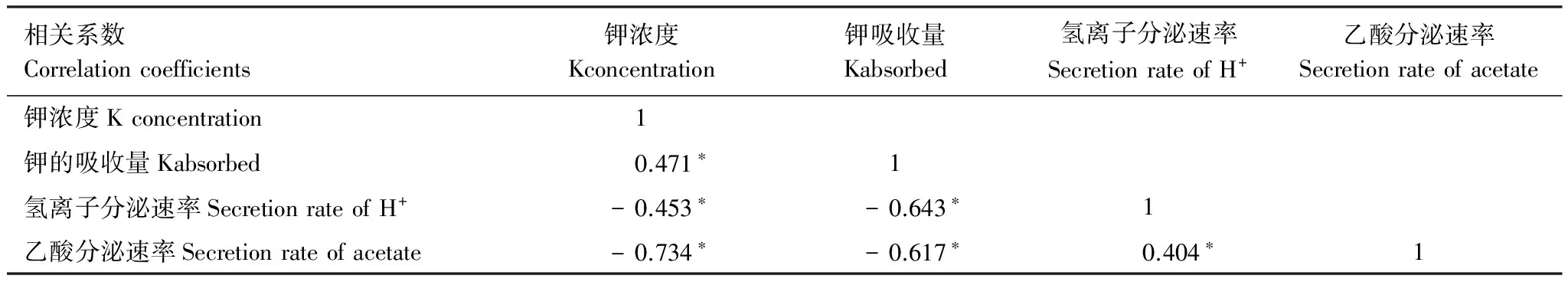
表4 外生菌根真菌乙酸和氢离子分泌速率与钾的相关性
*表示极显著(P≤0.01)
3 讨论
3.1 外生菌根真菌的养分含量与吸收量
外生菌根是外生菌根真菌与树木根系形成的共生体。从结构上看,外生菌根的菌套包蔽根系,外延菌丝广泛分布于土壤,是菌根吸收养分的重要器官,菌丝吸收的养分转移到树木根系内部,再运输至地上部营养植物,发挥它们的生理功能。因此,菌丝养分含量的高低以及外生菌根真菌吸收养分的能力与寄主植物的营养吸收密切相关[19]。供试菌丝氮、磷、钾含量因菌种(株)不同而异。在南方菌株中,Bo15的养分含量显著高于Ld2,其中钾含量前者是后者的3倍以上,这表明Bo15吸收养分的能力可能远远强于Ld2。相对于南方菌株,北方菌株Cg04的氮、钾含量和吸收量相对较高,磷含量和吸收量相对较低,这可能与其长期所处的土壤环境有关。在内蒙大青山森林土壤中,氮、钾元素的含量显著高于南方菌株所在的土壤环境。说明外生菌根真菌吸收养分的能力可能与它们对土壤养分环境的长期适应、进化、选择有关,这与袁玲等研究结果一致[20]。
3.2 外生菌根真菌的有机酸分泌
从供试外生菌根真菌的培养液中,分别检测到草酸、柠檬酸、苹果酸、丁二酸和乙酸等有机酸,类似现象也发生在欧洲高度酸化和砾石化的森林中[21]。这些有机酸均与钙、镁、铁、铝有较强的络合能力[22- 23]。因此,它们能不同程度地络合岩石和土壤矿物晶格中的这些金属离子,使之风化分解,释放钾离子[24]。但是,外生菌根真菌分泌有机酸的能力因菌株不同而异。供试菌株Cg04来自于我国北方大青山,土壤含钾丰富,有机酸分泌总量最低;其余3株Bo15、Pt715和Ld2均来自我国南方的酸性或强酸性缺钾土壤,有机酸分泌总量是前者的2倍以上。从生物进化与环境相适宜的角度看,在长期缺钾的土壤环境中,外生菌根真菌为了获得钾营养,自然选择或进化出了较强的有机酸分泌能力。值得注意的是,在供试菌株的培养液中均检测到较高浓度的乙酸。众所周知,乙酸的分子量小,电离系数大,酸性强,故溶解土壤矿物质和岩石的作用强[25]。在森林生态系统中,土壤含钾矿物的分解风化是树木钾素营养的主要来源。外生菌根真菌均能分泌乙酸的现象表明,树木钾营养对菌根真菌具有普遍的依赖性。此外,外生菌根真菌还能直接分泌大量的氢离子,类似植物根系[26]。氢离子的直径为0.38 Å,远小于钾离子(1.38 Å)。同位素示踪试验表明,氢离子能进入2 ∶1型膨胀性或非膨胀性含钾矿物的晶层和晶格,取代其中的钾离子[27]。因此,外生菌根真菌分泌的氢离子不仅能直接溶解含钾矿物,而且还能释放层间和晶隙钾,提高土壤溶液中的钾离子浓度[10]。
3.3 钾对外生菌根真菌分泌乙酸和氢离子的调控作用
培养液中的钾离子浓度和外生菌根真菌的吸钾量分别与它们分泌乙酸和氢离子的速率呈显著负相关,说明外源钾浓度越低,外生菌根真菌分泌乙酸和氢离子的速率愈快,反之亦然。如果类似现象发生在森林生态系统中,即外生菌根真菌和菌根植物感受到土壤供钾不足时,它们分泌乙酸和氢离子的速率增加,促进含钾矿物分解风化,释放钾离子,供给树木营养;相反,若土壤溶液中的钾离子丰富,外生菌根真菌和菌根植物分泌乙酸和氢离子的速率降低,含钾矿物风化缓慢,可避免土壤钾的淋溶损失。因此,在森林土壤生态系统中,钾对外生菌根真菌分泌乙酸和氢离子的调控作用具有改善森林钾素营养,防止土壤养分淋失的生理和生态意义。
3.4 信号介导对外生菌根真菌分泌乙酸的影响
供试外生菌根真菌因供钾条件不同,分泌乙酸对钙信号/阴离子通道抑制剂的响应也不一样。低钾供应时,刺激外生菌根真菌分泌乙酸,故缺钾可能作为一种原初信号,以不同方式激活了乙酸合成酶相关基因表达或相关合成酶的活性,进而使乙酸合成与分泌增加,钙信号/阴离子通道抑制剂对供试菌株分泌乙酸均表现出抑制效应。在预备试验中,这些钙信号抑制剂在短期时间内对乙酸分泌无抑制现象,随时间的延长,抑制作用才逐渐显现。因此,推测在外生菌根真菌缺钾时,原初信号可能作用于细胞内的第二信使——钙调素(CaM),改变细胞内外的钙离子分布,通过信号传递启动级联反应,促进乙酸合成酶基因的表达或提高乙酸合成酶活性,刺激阴离子通道分泌乙酸。相反,在高钾供应时,Bo15分泌乙酸的速率显著高于Ld2、Pt715和Cg04,钙信号/阴离子通道抑制剂仍然对Bo15分泌乙酸表现出抑制作用;但信号/阴离子通道抑制剂对乙酸分泌速率较低的Ld2、Pt715和Cg04无显著影响。说明在供钾改善的条件下,不存在缺钾信号,外生菌根真菌的乙酸合成酶基因或相关合成酶可能处于低活性状态,分泌乙酸的合成分泌速率较低,钙信号/阴离子通道抑制剂的抑制作用也减弱。
4 结论
(1)外生菌根真菌可分泌草酸、乙酸、苹果酸、柠檬酸和丁二酸等有机酸,以及大量氢离子,有益于分解土壤含钾矿物,释放钾离子,改善寄主植物的钾营养。
(2)外生菌根真菌分泌乙酸具有普遍性,供钾浓度与乙酸分泌速率呈负相关。在森林土壤中,钾对菌根真菌分泌乙酸的这种调控作用具有改善森林钾素营养,防止土壤养分淋失的生理和生态意义。
(3)在低钾条件下,阴离子通道和钙信号抑制剂抑制外生菌根真菌分泌乙酸。
[1] Cairney J W G. Ectomycorrhizal fungi: the symbiotic route to the root for phosphorus in forest soils. Plant and Soil, 2011, 344(1/2): 51- 71.
[2] Mengel K, Uhlenbecker K. Determination of available interlayer potassium and its uptake by ryegrass. Soil Science Society of America Journal, 1993, 57(3): 761- 766.
[3] Guo Q P, Li Y H, Zhang B Q, Zhang Y F. Experimental research on screening excellent ectomycorrhizal fungi ofPiceameyeriMast. Agricultural Information and Technology, 2012, (9): 31- 32.
[4] Yuan L, Huang J G, Christie P, Li X L. Influence of potassium supply on growth and uptake of nitrogen, phosphorus, and potassium by three ectomycorrhizal fungal isolates in vitro. Journal of Plant Nutrition, 2005, 28(2): 271- 284.
[5] Feddermann N, Finlay R, Boller T, Elfstrand M. Functional diversity in arbuscular mycorrhiza-the role of gene expression, phosphorous nutrition and symbiotic efficiency. Fungal Ecology, 2010, 3(1): 1- 8.
[6] Vander Heijden M G A, Bardgett R D, van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296- 310.
[7] Luan Q S, Wu Y H, Bai H M. Advances of antagonistic mechanism of ectomycorhizal fungi to pathogenes. Liaoning Forestry Science & Technology, 2009, (5): 52- 54.
[8] Jentschke G, Brandes B, Kuhn A J, Schroder W H, Godbold D L. Interdependence of phosphorus, nitrogen, potassium and magnesium translocation by the ectomycorrhizal fungusPaxillusinvolutus. New Phytologist, 2001, 149(2): 327- 338.
[9] van Schöll L, Kuyper T W, Smits M M, Landeweert R, Hoffland E, van Breemen N. Rock-eating mycorrhizas: their role in plant nutrition and biogeochemical cycles. Plant and Soil, 2008, 303(1/2): 35- 47.
[10] Yuan L, Huang J G, Li X L,Christie P. Biological mobilization of potassium from clay minerals by ectomycorrhizal fungi and eucalypt seedling roots. Plant and Soil, 2004, 262(1): 351- 361.
[11] Landeweert R, Hoffland E, Finlay R D, Kuyper T W, van Breemen N. Link plants to rocks: ectomycorrhizal fungi mobilize nutrients from minerals. Trends in Ecology & Evolution, 2001, 16(5): 248- 254.
[12] Arocena J M, Glowa K R. Mineral weathering in ectomycorrhizosphere of subalpine fir (Abieslasiocarpa(Hook.) Nutt.) as revealed by soil solution composition. Forest Ecology and Management, 2000, 133(1/2): 61- 70.
[13] Dong H, Li B, Guo F, Guo H C, Wang Y L, Li C Y. Role of sodium pump Na+-K+-ATPase in hypoxic injury of cortical neurons in rats. Academic Journal of Second Military Medical University, 2008, 29(2): 171- 176.
[14] Tang X L, Li X F, Ling G Z, Gu M H, Yu Y H. The involvement of Ca2+signal in the regulation of Al-Induced secretion of organic acids in rye. Scientia Agricultura Sinica, 2008, 41(8): 2279- 2285.
[15] Yang T B, Poovaiah B W. Calcium/calmodulin-mediated signal network in plants. Trends in Plant Science, 2003, 8(10): 505- 512.
[16] Bouche N Y A, Snedden W A, Fromm H. Plant-specific calmodulin-binding proteins. Annual Review Plant Biology, 2005, 56(1): 435- 466.
[17] Bai S L, Liu Y, Zhou J, Dong Z, Fan R. Resources investigation and ecological study on ectomycorrhizal fungi in Daqingshan Mountains, Inner Mongolia. Acta Ecologica Sinica, 2006, 26(3): 837- 841.
[18] Yang J H, Wang C L, Dai H L. Agrochemical Analysis of Soil and Environmental Monitoring. Beijing: China Land Press, 2008.
[19] Ma Q, Huang J G. Mycorrhizae and their effects on mineral nutrients of plants. Journal of Jilin Agricultural Sciences, 2003, 28(2): 41- 43.
[20] Yuan L, Fang D H, Wang Z H, Wei X Y, Huang J G. Effects of potassium on the secretion of proton and oxalate by ectomycorrhizal fungi and the concentrations of nitrogen, phosphorus and potassium in their hyphae. Acta Ecologica Sinica, 2001, 21(2): 254- 258.
[21] Li Q, Huang J G. Advances of improvement of potassium nutrition in trees by ectomycorrhiza fungi. Guizhou Agricultural Sciences, 2011, 39(6): 107- 110.
[22] Fox T R, Comerford N B, McFee W W. Phosphorous and aluminum release from a spodic horizon mediated by organic acids. Soil Science Society of America Journal, 1990, 54(4): 1763- 1767.
[23] Gadd G M. Fungal production of citric and oxalic acid: importance in metal speciation, physiology and biogeochemical processes. Advances in Microbial Physiology, 1999, 41: 47- 92.
[24] Welch S A, Barker W W, Banfield J F. Microbial extracellular polysaccharides and plagioclase dissolution. Geochimica et Cosmochimica Acta, 1999, 63(9): 1405- 1419.
[25] Wang D S, Wang J. Mechanism of soil mineral potassium release extracted by low-molecular-weight organic acids. Journal of Liaoning Technical University: Natural Science, 2009, 28(S1): 259- 261.
[26] Liu Z M, Huang J G. Effects of potassium on the secretion of Hydrion by ectomycorrhizal Fungi and Nitrogen, phosphorus and Potassium Absorption. Gansu Agriculture Science and Technology, 2009, (1): 25- 27.
[27] Wallander H. Use of strontium isotopes and foliar K content to estimate weathering of biotite induced by pine seedlings colonized by ectomycorrhizal fungi from two different soils. Plant and Soil, 2006, 222(1/2): 215- 229.
参考文献:
[3] 郭全平, 李玉环, 张北勤, 张彦峰. 青杄优良外生菌根真菌筛选试验研究. 农业科技与信息, 2012, (9): 31- 32.
[7] 栾庆书, 吴元华, 白慧敏. 外生菌根真菌对病原菌拮抗作用机理研究进展. 辽宁林业科技, 2009, (5): 52- 54.
[13] 董惠, 李彬, 郭芳, 郭会彩, 王永利, 李春岩. Na+, K+-ATP酶在大鼠皮质神经元缺氧性损伤中的作用. 第二军医大学学报, 2008, 29(2): 171- 176.
[14] 唐新莲, 黎晓峰, 凌桂芝, 顾明华, 玉永雄. Ca2+信号参与铝诱导黑麦根系分泌有机酸的调控. 中国农业科学, 2008, 41(8): 2279- 2285.
[17] 白淑兰, 刘勇, 周晶, 董智, 樊荣. 大青山外生菌根真菌资源与生态研究. 生态学报, 2006, 26(3): 837- 841.
[18] 杨剑虹, 王成林, 代亨林. 土壤农化分析与环境监测. 北京: 中国大地出版社, 2008.
[19] 马琼, 黄建国. 菌根及其在植物吸收矿质元素营养中的作用. 林农业科学, 2003, 28(2): 41- 43.
[20] 袁玲, 方德华, 汪智慧, 魏兴元, 黄建国. 钾对外生菌根真菌的分泌作用及氮、磷、钾含量的影响. 生态学报, 2001, 21(2): 254- 258.
[21] 李倩, 黄建国. 外生菌根真菌改善树木钾素营养的研究进展. 贵州农业科学, 2011, 39(6): 107- 110.
[25] 王东升, 王君. 低分子量有机酸作用下土壤矿物钾释放机制. 辽宁工程技术大学学报: 自然科学版, 2009, 28(S1): 259- 261.
[26] 刘志敏, 黄建国. 钾对外生菌根真菌分泌氢离子及吸收氮磷钾的影响. 甘肃农业科技, 2009, (1): 25- 27.
Regulation of potassium supply and signal inhibitors on acetate effluxes by ectomycorrhizal fungi
YANG Hongjun, LI Yong, YUAN Ling*,SHI Andong
CollegeofResources&Environment,SouthwestUniversity,Beibei400715,China
Potassium (K), an element required slightly lower than nitrogen (N), is one of the essential major nutrients for trees in forests. K deficiency inhibits tree growth and limits forest productivities. Ectomycorrhizal fungi are one of important microorganisms in forests. Many forest trees have evolved mutualistic symbioses with the fungi that contribute to their nutrition and growth. In the fungus-tree associations, the fungi obtain carbohydrates from host trees and, in turn, provide the plants with mineral nutrients such as phosphorus (P), calcium (Ca), magnesium (Mg) and K. In our present experiment, ectomycorrhizal fungi isolated from pine and eucalyptus forests were grown in liquid culture media with various K supplies (26, 130, and 650 mg/L K2SO4) and with Ca2+signal and anion channel inhibitors such as Trifluoperazine, TFP; Verapamil, VP; Ruthenium red, RR and Niflumic acid, NIF. The efflux of acetate and protons by the fungal isolates in the response to the K supplies and inhibitors were studied in vitro in order to understand the mechanisms of ectomycorrhizal fungi to improve the nutrition of host plants. The results indicated that the fungal species varied greatly in both growth and nutrient absorption (N, P and K). The hyphae biomass at harvest, for example, showed at least twice difference, ranging from 52.91 mg/flask to 121.72 mg/flask. The reasons for the variations in growth and nutrition could be explained by the biological adaption to soil nutrient environments where they lived for a long time through evolution and selection. Oxalate, acetate, malate, citrate, succinate and large amount of protons were detected in the culture solutions. Taking into the account of dissolution and decomposition of minerals and rocks caused by protons and organic acids, ectomycorrhizal fungi could thus make K in mineral structures available for the host plants. In addition, all study fungi released acetate into liquid culture media and the low K supply stimulated significantly the acetate efflux. The efflux rate correlated negatively with K concentration in culture solutions (r=- 0.734,n=60) and fungal K absorption (r=- 0.617,n=60). In forest soils, therefore, the influence of K on acetate efflux by the external hyphae of ectomycorrhizas could be physiologically and ecologically important for the improvement of tree K nutrition at low K supply but prevention against K leaching in fertile soils. The inhibitors of Ca signals and anion channels decreased the acetate efflux by ectomycorrhizal fungal isolates in culture solutions with low K supply. It seems reasonable to suggest both Ca signals and anion channels involved the process of the fungal acetate exudation in this case. The primary signal of K deficiencies could act as the intracellular second messenger to react on calmodulin (CaM), by which changed the Ca2+distribution inside and outside of the hyphae cells, and then stimulated the cascade reactions responsible for acetate efflux, including gene expression, acetate synthesis and anion channel activation. Concerning the difference between the ectomycorrhizas in the field and the fungal isolatesinvitro, further investigation is necessary to carry out on the mechanisms of the detail processes with ectomycorrhizal trees.
ectomycorrhizal fungi; potassium; signal inhibitor; acetate secretion; soil ecology
国家自然科学基金(40771112, 41171215);中央高校基本科研业务费专项资金资助(XDJK2014C105, XDJK2012C035);西南大学博士基金项目(SWU112083);西南大学研究生科技创新基金项目(Ky2009022)
2013- 07- 09;
2013- 11- 25
10.5846/stxb201307091871
*通讯作者Corresponding author.E-mail: lingyuanh@aliyun.com
杨红军,李勇,袁玲,时安东.钾与信号抑制剂对外生菌根真菌分泌乙酸的调控作用.生态学报,2014,34(5):1126- 1133.
Yang H J, Li Y, Yuan L,Shi A D.Regulation of potassium supply and signal inhibitors on acetate effluxes by ectomycorrhizal fungi.Acta Ecologica Sinica,2014,34(5):1126- 1133.
