青蒿素对实验性糖尿病大鼠肾脏PDGF-B表达上调的影响
2014-08-11张丽坤苏彦君周凤娇张建勇安志霞
张丽坤,苏彦君,周凤娇,张建勇,安志霞
(河北省石家庄市第二医院,河北 石家庄 050051)
青蒿素对实验性糖尿病大鼠肾脏PDGF-B表达上调的影响
张丽坤,苏彦君,周凤娇,张建勇,安志霞
(河北省石家庄市第二医院,河北 石家庄 050051)

目的 探讨青蒿素对实验性糖尿病大鼠肾脏血小板衍化生长因子-B(PDGF-B)表达上调的抑制作用。方法 将36只雄性SD大鼠随机分为正常对照组(A组)、糖尿病非治疗组(B组)及糖尿病青蒿素治疗组(C组),B、C组采用腹腔单剂量注射链脲佐菌素(STZ)65 mg/kg建立糖尿病大鼠模型。C组给予青蒿素300 g/(kg·d)腹腔注射。于实验第3周、第6周各组分别宰杀6只大鼠,采用免疫组织化学染色法检测肾皮质PDGF-B的蛋白表达。并检测肌酐清除率(Ccr)、 24 h尿白蛋白排泄率(UAER)及肾质量/体质量。肾组织制备电子显微镜切片以观察肾组织超微结构改变。结果 C组大鼠肾质量/体质量、Ccr、UAER均显著低于B组(P<0.05或0.01)。免疫组化染色发现B组大鼠肾组织PDGF-B表达显著上调(P<0.01),C组表达明显下调(P<0.01)。电镜示B组大鼠肾脏病变广泛,肾小球系膜细胞增生,系膜区增宽,基底膜增厚,脏层细胞肥大。C组大鼠肾脏超微结构异常显著减轻。结论 青蒿素能减轻糖尿病大鼠肾脏病变,主要通过下调糖尿病大鼠肾组织PDGF-B表达来实现。
糖尿病肾病;青蒿素;血小板衍化生长因子-B;免疫组织化学
近年来,糖尿病发病率在全球迅速上升,使糖尿病肾病发病率逐年增加,目前在发达国家糖尿病肾病已成为引起终末期肾衰竭(ESRD)的首要原因。而肾素-血管紧张素系统(RAS)在其中的作用引起广泛关注。血管紧张素Ⅱ除了具有调节全身和肾血流动力学效应外,尚有一系列非血流动力学效应导致肾脏功能受损,如诱导肾内多种细胞因子表达上调,包括血小板源性生长因子(PDGF)和转化生长因子β(TGF-β)。PDGF介导肾脏细胞的增生肥大及细胞外基质合成增多。其中PDGF-B在其中起重要作用[1]。青蒿素是从青蒿叶中分离的抗疟有效成分,近年来发现青蒿素及其衍生物具有广泛的药理作用,如抗肿瘤、参与细胞周期调节等。而细胞周期调节异常与糖尿病肾病发病密切相关。本实验通过观察青蒿素对糖尿病大鼠肾组织PDGF-B表达的调节作用,为临床探寻防治糖尿病肾病提供新的视角。
1 实验资料
1.1 实验动物与分组 雄性SD大鼠36只,体质量180~220 g(购自河北医科大学实验动物部),随机分为3组,即正常对照组(A组)、糖尿病非治疗组(B组)及糖尿病青蒿素治疗组(C组),每组12只。
1.2 模型制备 大鼠腹腔单剂量注射STZ(购自Sigma公司)65 mg/kg,对照组仅腹腔注射等量柠檬酸缓冲液。72 h后经尾静脉采血,使用达优血糖仪(广州达优医疗设备有限公司)测全血血糖,血糖≥16.7 mmol/L确定为糖尿病大鼠。
1.3 动物给药 青蒿素(购自成都伟辉生物科技有限公司)溶于二甲基亚砜(DMSO)中,自造模当天起C组大鼠腹腔注射青蒿素300 mg/(kg·d),A组与B组分别给予等量二甲基亚砜腹腔注射。所有大鼠自由进食、饮水,不用任何降糖药物。在实验进行到第3周、第6周时各组分别宰杀6只大鼠。
1.4 标本收集 所有大鼠宰杀前1 d收集24 h尿液,分别取6 mL,监测尿肌酐、UAER。大鼠称质量,取血5 mL,测定血肌酐、尿素氮及血糖。双肾称质量,少量右肾肾皮质用3%戊二醛溶液浸泡固定,备电镜观察。用10%中性甲醛溶液浸泡固定部分右肾皮质,以备免疫组织化学染色。
1.5 生化指标检测 用放射免疫法检测大鼠尿白蛋白。生化指标检测采用日产奥林巴斯AU400自动生化分析仪,计算肌酐清除率(Ccr),结果需用体质量校正。
1.6 免疫组化染色 免疫组化染色应用SP方法。其中,用1% BSA代替一抗作阴性对照。采用病理图像分析系统进行半定量分析染色结果。
2 结 果
2.1 各组生化指标比较 B、C组大鼠腹腔注射链脲佐菌素72 h后血糖≥16.7 mmol/L,说明糖尿病模型成功。同期相比,B组大鼠显著低于A组(P<0.05),并呈进行性下降,而肾质量及肾质量/体质量值均逐渐增加,与A组相比有显著性差异(P均<0.05)。C组体质量均高于B组(P<0.05),肾质量、肾质量/体质量值均显著低于B组(P均<0.05)。见表1。
2.2 各组大鼠UAER及肾功能比较 造模后B组大鼠血UAER及尿素氮明显高于A组大鼠(P<0.05或0.01)。而C组大鼠血UAER、尿素氮及Ccr均低于同期B组(P<0.05)。见表2。
2.3 各组大鼠PDGF-B蛋白在肾皮质表达结果比较 A组大鼠PDGF-B蛋白主要在肾集合管、近段小管及远端小管上皮细胞细胞浆表达,系膜细胞表达量极少,实验3周与6周相比其表达无变化。同期相比,B组大鼠上述部位PDGF-B表达较A组大鼠均明显增加(P<0.01)。而C组大鼠上述部位PDGF-B的表达均显著下调(P<0.05或0.01),但在第6周时均明显高于对照组大鼠(P<0.01)。见表3。
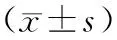
表1 各组大鼠体质量、肾质量、肾质量/体质量及血糖比较
注:①与A组比较,P<0.05;②与A组比较,P<0.01;③与B组比较,P<0.05。
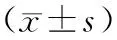
表2 各组大鼠生化指标及UAER的比较
注:①与A组比较,P<0.05;②与A组比较,P<0.01;③与B组比较,P<0.05。
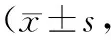
表3 各组大鼠肾皮质表达PDGF-B蛋白比较%)
注:①与A组比较,P<0.05;②与A组比较,P<0.01;③与B组比较,P<0.05;④与B组比较,P<0.01。
2.4 各组大鼠肾组织电镜结果观察 电镜结果表明,对照组大鼠肾脏超微结构在第3周、第6周均未见异常病理学变化;与A组大鼠相比,可发现B组大鼠肾脏病变广泛,呈进行性、弥漫性分布。B组大鼠肾小球脏层上皮细胞肥大,足突部分融合,基底膜不规则增厚,内皮细胞窗空消失或融合。肾小球系膜细胞增生,系膜区增宽,系膜基质增多。而C组大鼠与B组大鼠肾组织同期比较,上述部位病变减轻明显。
3 讨 论
作为一种重要的多肽类生长因子PDGF由内皮细胞、血小板、血管平滑肌细胞、成纤维细胞、单核/巨噬细胞、肾小球系膜细胞等产生。在肾小球疾病中,PDGF的靶细胞主要为系膜细胞,它与细胞增生、分泌细胞外基质密切相关,参与肾小球疾病的发生、发展[2-4]。
研究表明,PDGF-B广泛参与了糖尿病肾病的发生和发展。在高糖环境中培养的系膜细胞及糖尿病大鼠的肾小球,PDGF-B和其受体PDGFR-β表达上调,而PDGF-B是一种强烈的有丝分裂原刺激物,与糖尿病早期肾细胞的有丝分裂密切相关。并可诱导细胞产生TGF-β,导致细胞肥大,引起胶原产生增加,细胞外基质堆积[5-6]。
本研究所采用的糖尿病大鼠模型已出现早期糖尿病肾病的病理学改变,如肾小球系膜区增大,基质堆积,系膜细胞增生,基底膜增厚。分别在第3周、第6周肾质量/体质量值、肾质量、UAER及Ccr逐渐升高。
本实验应用免疫组化染色观察到PDGF-B蛋白在糖尿病大鼠肾组织细胞浆,如系膜细胞、近段及远端肾小管上皮细胞及集合管细胞的胞浆表达均明显上调,糖尿病大鼠腹腔注射青蒿素300 mg/(kg·d)在实验进行到第3周、第6周时,均可观察到PDGF-B在大鼠肾脏上述部位的表达受到明显抑制,并有效减轻肾皮质损伤。通过电镜观察肾脏超微结构,可发现青蒿素治疗组大鼠与非治疗组大鼠比较,治疗组大鼠肾小球系膜细胞增生减轻,基底膜增厚改善,细胞外基质减少。青蒿素有效改善了糖尿病大鼠肾小球超微结构损伤。而这一肾脏保护作用与代谢因素无关,因为糖尿病非治疗鼠组与青蒿素治疗组大鼠血糖水平无明显差异。
[1] 陈颖颖,丁峰. 肾素-血管紧张素系统阻断剂在慢性肾病治疗中的应用[J]. 上海医药,2013,34(1):5-9
[2] Persson DL,Jin L,Xuan H,et al. Effects of aliskiren on blood pressure, aibuminuria, and (pro)rennin receptor expression in diabetic TG (mRen-2) 27 rats[J]. Hypertension,2008,52(1):130-136
[3] Chow FY,Nikolic-Paterson DJ,Atkins RC,et al. Macro,phages in streptozotocin-induced diabetic nephropathy:potential role in renal fibrosis[J]. Tesch GH Nephrol Dial Transplant,2004,19:2987-2996
[4] Fraser D,Brunskill N,Ito T,et al. Long-term exposure of proximal tubular epithelial cells to glucose induces transforming growth factor-beta 1 synthesis via an autocrine PDGF loop[J]. Am J Pathol,2003,163:2565-2574
[5] Langham RG,Kelly DJ,Maguire J,et al. Over-expression of platelet-derived growth factor in human diabetic nephropathy[J]. Nephrol Dial Transplant,2003,18:1392-1396
[6] Kang JH,Chae YM,Park KK,et al. Suppression of mesangial cell proliferation and extracellular matrix production in streptozotocin-induced diabetic rats by Sp1 decoy oligodeoxynucleotide in vitro and in vivo[J]. J Cell Biochem,2008,103:663-674
Effect of Artemisinin on the upregulation of PDGF-B protein expression in the kidney of experimental diabetic rats
Zhang Likun, Su Yanjun, Zhou Fengjiao, Zhang Jianyong, An Zhixia
(The Second Hospital of Shijiazhuang City, Shijiazhuang 050051, Hebei, China)
Objective It is to investigate the inhibitory effect of artemisinin on the upregulation of PDGF-B protein expression in the kidney of experimental diabetic rats. Methods 36 male SD rats were randomly divided into normal control group(A group), non-treatment diabetic group(B group), and diabetic treated with Artemisinin group(C group). The diabetic models of rats were established by STZ 65 mg/kg by intraperitoneal injection in group B and group C. Group C was given Artemisinin 300 g/(kg·d) by intraperitoneal injection. UAER, Ccr as well as the profile of kidney hypertrophy were observed after 3, 6 weeks of treatment, while PDGF-B protein expression was measured by immunohistological staining. In addition, renal tissues were observed by transmission electron microscopy. Results Kidney/body weight ratio, Ccr, and UAER of the rats in group C were significantly lower than those in group B (P<0.05 or 0.01). Immumohistochemical staining results showed that the protein expression of PDGF-B(P<0.01) significantly increased in renal tissue in group B(P<0.01), while decreased in group C(P<0.01). Electron microscopy results showed that in the rats of group B, extensive kidney lesion, glomerular mesangial cell proliferation and mesangial area broadening, thickening of basement membrane, dirty layer cell hypertrophy were found, while in groupC, abnormal ultrastructure was significantly relieved. Conclusion Atemisinin can relieve renal lesions in experimental diabetic rats, which was partly through inhibiting PDGF-B expression in renal cortices.
Atemisinin; diabetic nephropathy; platelet-derived growth factor-B; immunohistological staining
张丽坤,女,主治医师,研究方向为糖尿病肾病及血液透析。
10.3969/j.issn.1008-8849.2014.13.009
R-332
A
1008-8849(2014)13-1392-03
2014-01-10
