3种丙肝病毒检测方法在丙型肝炎诊断和疗效监测中的临床价值
2014-08-11邓兆享
邓兆享
(武警广东省边防总队医院,广东 深圳 518029)
3种丙肝病毒检测方法在丙型肝炎诊断和疗效监测中的临床价值
邓兆享
(武警广东省边防总队医院,广东 深圳 518029)
目的 探讨HCV-cAg、HCV-Ab和HCV RNA在丙型肝炎诊疗中的临床价值,并分析HCV-cAg和HCV RNA的相关性。方法 采用ELISA法和RT-PCR法检测221例疑似丙肝患者血清HCV-cAg、HCV-Ab和HCV RNA含量。结果 单个方法检测时其阳性率分别为HCV RNA 47.5%、HCV-cAg 48.4%、HCV-Ab 84.1%,联合检测时其阳性率分别为HCV-Ab+HCV-cAg 98.2%、HCV-Ab+HCV RNA 97.7%;HCV-cAg检测的敏感性为91.4%,特异性为90.5%,且与HCV RNA的相关系数r=0.997;当HCV-cAg 的S/CO≥3时,与HCV RNA阳性的符合率为98.8%。结论 HCV-Ab联合HCV-cAg或者HCV RNA检测比单项检测阳性率更高(P均<0.05),可防止窗口期丙肝患者漏诊; HCV-cAg出现早且和HCV RNA的相关性高,可用于窗口期丙肝患者的筛查和疗效监测,但是不可以作为停药治疗的指标,当其S/CO≥3时可作为判断丙肝感染较可靠的指标。
丙型肝炎;丙型肝炎病毒;HCV-cAg;HCV-Ab;HCV RNA
丙型肝炎病毒(HCV)是严重威胁人类健康的传染病之一,全球约有1亿人感染,我国的感染率约为3.2%。丙肝患者大部分是通过血液和血制品感染,因此实验室对丙肝的早期筛查显得尤为重要。目前实验室诊断丙肝的主要方法为检测丙肝病毒抗体(HCV-Ab)和丙肝病毒核酸(HCV RNA)。近些年来丙肝病毒核心抗原(HCV-cAg)的检测越来越引起人们的重视[1-3]。本研究将用HCV-cAg、HCV-Ab和HCV RNA 3种方法对221例临床疑似丙肝患者血清进行检测,评价3种方法在丙型肝炎的诊断和疗效监测中的临床价值以及探索提高丙肝诊断效率的方法,并对HCV-cAg和HCV RNA的相关性进行分析。现将结果报道如下。
1 临床资料
1.1 一般资料 收集2011年5月—2013年11月我院门诊和住院患者中疑似丙肝的患者血清221份,并将血清置于-20 ℃冰冻保存。其中男127例,女94例;年龄16~78(45.2±23.1)岁。
1.2 主要仪器 HCV RNA检测仪器为ABI7500荧光定量分析仪(RT-PCR),HCV-Ab和HCV-cAg的检测仪器为尤瑞纳斯150全自动酶免分析仪。
1.3 试剂 HCV-Ab试剂来源于英科新创,HCV-cAg试剂来源于湖南康润,HCV RNA核酸扩增PCR荧光检测试剂盒来源于湖南圣湘,质控品来源于卫生部临检中心,所有试剂和质控品均在有效期内。
1.4 方法 HCV-Ab和HCV-cAg检测用ELISA法,采用尤瑞纳斯150全自动酶免分析仪进行检测,所得到的结果为吸光度值与临界值之比,用S/CO表示,所有阳性结果均需二次复查;HCV RNA用RT-PCR分析仪检测,严格进行操作,所得结果单位用IU/mL表示。
1.5 结果判定 HCV-Ab和HCV-cAg的S/CO≥1为阳性,S/CO<1为阴性;HCV RNA≥500IU/mL为阳性,HCVRNA<500 IU/mL为阴性。
1.6 统计学方法 用SPSS 18.0统计学软件对数据进行分析,相关系数用r表示,P<0.05为差异有统计学意义。
2 结 果
2.1 3种方法检测丙肝的结果比较 用3种方法单独检测时的阳性率分别是HCV RNA 47.5%,HCV-cAg 48.4%,HCV-Ab 84.1%。若将HCV-Ab、HCV-cAg和HCV-Ab、HCV RNA 2种方法联合检测,则得到的阳性率分别为98.2%(217/221)和97.7%(216/221)。107例HCV-cAg阳性结果中HCV RNA的阳性符合率为89.7%。47例HCV-Ab结果为弱阳性和35例HCV-Ab为阴性标本中HCV RNA的阳性率分为46.8%和85.7%。见表1。
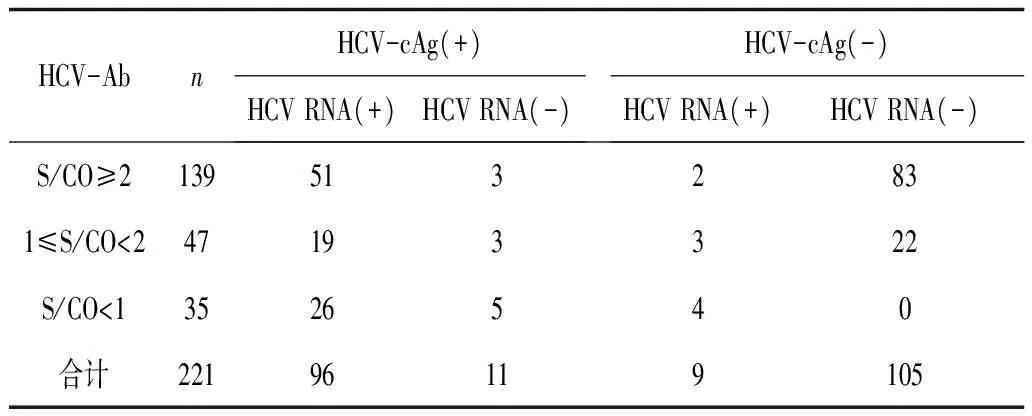
表1 3种方法检测丙肝的结果比较 例
2.2 HCV-cAg和HCV-RNA检测结果的相关性分析 有11例标本HCV-cAg检测结果为阳性而HCV RNA结果呈阴性,有9例标本HCV cAg结果为阴性而HCV RNA结果呈阳性,当以HCV RNA诊断的结果为标准时,HCV-cAg检测的敏感性为91.4%,特异性为90.5%,与HCV RNA的符合率为91%。当HCV RNA的浓度值(IU/mL)在500~103,103~104,104~106和>106时,HCV-cAg的阳性率分别为70.6%,85.7%,94.4%和100%,随着HCV RNA浓度的升高,HCV-cAg的阳性率也在增加。经相关性分析,2种检测方法的相关系数r=0.997,说明2种检测方法显著相关。当HCV-cAg 的S/CO值为≥3,2~3和1~2时与HCV RNA阳性的符合率分别为98.8%,80%和52.9%。 见表2。

表2 HCV RNA在不同浓度的情况下与HCV-cAg吸光度值的关系 例
3 讨 论
目前HCV-Ab 检测多采用第三代技术,具有了更高的特异性,但是由于各厂家所包被的抗原质量和抗原片段比例不同导致HCV-Ab检测结果不一致[4]。本研究HCV-Ab结果为弱阳性和阴性标本中HCV RNA的阳性率分别为46.8%和85.7%,这是因为人体感染丙肝病毒约70 d后才能在血清中检测到HCV-Ab[5],所以窗口期的患者无法检测到HCV-Ab ,还有些免疫缺陷患者则要12个月才能检测到抗体,部分免疫缺陷和免疫功能紊乱的患者感染 HCV后也无法检测到HCV-Ab,且大部分经过治疗后处于静止期的丙肝患者其检测结果也为阳性。所以仅检测HCV-Ab容易漏诊窗口期患者,且不能反映丙肝病毒的活动情况。
HCV RNA阳性是病毒感染和复制的直接标志,是诊断HCV感染的金标准[6],可在患者感染HCV后1~2周内检测出[7]。HCV-cAg的出现时间比HCV-Ab要早5~7 周,且比HCV RNA晚1~2 d[8],所适合于感染丙肝病毒后的14~80 d进行检测。本组研究显示当以HCV RNA检测为标准时,HCV-cAg检测的敏感性为91.4%,特异性为90.5%。这与文献[9]结果相似。本研究中HCV-cAg 阳性样品中HCV RNA阳性率为89.7%,这比Ergunay等[10]报道的81.3%稍高。若将HCV-Ab与HCV-cAg或HCV RNA两种方法联合检测时其阳性率分别为98.2%和97.7%,与单独检测HCV-Ab的阳性率性84.1%比较差异有统计学意义,这与李育芬等[11]研究相似。
本研究还显示,随着HCV RNA浓度的增加,HCV-cAg的阳性率也在增加,两者的相关系数r=0.997,表明2种方法显著相关,这与Vermehren等[3]的报道相似。当HCV RNA的浓度值>106IU/mL时,HCV-cAg检测的灵敏度为100%,这与Veillon等[12]的报道的结果相同;HCV RNA的浓度值在500~103IU/mL时HCV-cAg的阳性率为70.6%,此外还有11例HCV-cAg结果呈阳性而HCV RNA结果呈阴性,说明HCV-cAg的灵敏度和特异性还有待提高;当HCV-cAg 的S/CO值≥3时与HCV RNA阳性的符合率为98.8%,所以在实验过程中可以将HCV-cAg 的S/CO值为3作为判断HCV感染较可靠的指标,这比杨杰等[13]将S/CO值为2时作为有判断点要高。
本研究发现HCV-Ab和HCV-cAg结果为阳性而HCV RNA结果为阴性的标本有6例,HCV-Ab和HCV-cAg结果为阴性而HCV RNA结果为阳性的有4例,有可能是因为丙肝RNA病毒容易被血细胞的RNA酶降解且易与血中脂质及脂蛋白结合造成结果呈假阴性,也可能因为患者体内免疫条件变化、药物或者试剂和操作等原因造成的漏诊或者误诊,所以3种方法均有其局限性。
综上所述,联合检测HCV RNA、HCV-Ab或HCV-Ab、HCV-cAg可提高丙肝检测的敏感性和特异性,防止窗口期患者漏诊;HCV-cAg与HCV RNA的相关性高,可将HCV-cAg 的S/CO值≥3作为判断丙肝感染的较可靠标准;在基层医院可将HCV-cAg代替HCV RNA对窗口期丙肝患者进行筛查和疗效监测,但是不可以作为停药的标准。
[1] Gu S,Liu J,Zhang H,et al. Core antigen tests for hepatitis C virus:a meta-analysis[J]. Mol biol Rep,2012,39(8):81-123
[2] 陈新月,窦晓光,Dale HU,等. 丙型肝炎病毒核心抗原实验室检测及其临床意义[J]. 中国病毒病杂志,2013,3(1):12-16
[3] Vermehren J,Susser S,Berger A,et al. Clinical utility of the ARCHITECT HCV Ag assay for early treatment monitoring in patients with chronic hepatitis C genotype 1 infection[J]. Clin Virol,2012,19(9):615-622
[4] 金一鸣,方志红,曹谊. 血液筛查中丙型肝炎病毒检测方法的应用评价[J]. 检验医学与临床,2013,10(5):552-553
[5] Zeisel MB,Turek M,Baumert TF. Getting closer to the patient: Upgrade of hepatitis C virus infection in primary human hepatocytes[J]. J hepatology,2010,53(2):388-389
[6] Baranov AV,Maleev W. Association between HCV RNA level and anti-HCV antibodies During chronic hepatitis C[J]. Zh Mikrobiol Epidemiol Immunobiol,2009,9(5):19-22
[7] Chevaliez S. Virological tools to diagnose and monitor hepatitis C infection[J]. Clin Microb Inf,2011,17(2):116-121
[8] Laperche S,Le-Marrec N,Simon N,et al. A new HCV core antigen assay based on disassociation of immune complexes: an alternative to molecular biology in the diagnosis of early HCV infection[J]. Transfusion,2003,43(7):958-962
[9] Kato A,Takita T,Furuhashi M,et al. Association of HCV core antigen seropositivity with long-term mortality in patients on regular hemodialysis[J]. Nephron Extra,2012,2(1):76-86
[10] Ergunay K,Sener B,Alp A,et al. Utility of a commercial quantitative hepatitis C virus core antigen assay in a diagnostic laboratory setting[J]. Diaqn Microbiology Infect Dis,2011,70(4):486-491
[11] 李育芬,楚承霞,杨颖. HCV 检测方法研究进展及其临床意义[J]. 中国卫生检验杂志,2013,23(5):1342-1344
[12] Veillon P,Payan C,Picchio G,et al. Comparative evaluation of the total hepatitis C: virus core antigen, branched DNA, and amplicor monitor assays in determining viremia for patients with chronic hepatitis C during interferon plus ribavirin combination therapy[J]. J Clin Microbiol,2003,41(7):3212-3220
[13] 杨杰,崔敬,刘春. 丙型肝炎核心抗原检测在丙型肝炎诊断中的意义[J]. 临床肝胆病杂志,2013,29(2):128-131
10.3969/j.issn.1008-8849.2014.34.036
R446.6
B
1008-8849(2014)34-3854-03
2014-01-03
