基于细胞3D打印技术的肿瘤药物筛选细胞芯片研究
2014-08-11赵占盈徐铭恩
赵占盈 徐铭恩 石 然 郭 淼 严 明 徐 莹 王 玲
(杭州电子科技大学生命信息与仪器工程学院, 杭州 310018)
基于细胞3D打印技术的肿瘤药物筛选细胞芯片研究
赵占盈 徐铭恩*石 然 郭 淼 严 明 徐 莹 王 玲
(杭州电子科技大学生命信息与仪器工程学院, 杭州 310018)
现有的药物筛选评价技术中,动物筛选模型存在种属差异和周期长等缺点,高通量筛选和细胞筛选模型则与体内环境差异大,药物筛选准确率低。细胞3D打印技术为在体外构建仿真的组织器官模型提供了可能,当其与细胞芯片技术结合则为体外构建高效准确的药物筛选模型提供了新的技术空间。本研究构建了含有多个叉指电极(IDEs)阵列的细胞芯片,用细胞3D打印技术在芯片上组装了卵巢癌细胞HO-8910和人肝间充质干细胞HMSC-H组织模型,并通过对组织模型内细胞阻抗变化的检测,反映细胞生长、贴附、增殖、凋亡的过程及药物对细胞活性的影响等,最终基于该模型检测了抗癌药物顺铂和环磷酰胺对肿瘤细胞的杀伤和肝毒性。结果显示:支架微丝直径和孔径约为200~300 μm,肿瘤细胞和肝细胞在三维结构里生长良好;DMEM作为电解液,芯片在104Hz可准确检测到三维结构中细胞增殖引起的阻抗变化,20 h后阻抗升高69.6%;基于该筛选模型,能同步检测到药物的抗肿瘤作用和肝毒性,并筛选出需要肝的二次代谢产物才能产生抗肿瘤性的药物环磷酰胺。
细胞3D打印;细胞芯片;药物筛选;叉指电极;支架
引言
近年来,随着3D打印技术的不断发展,在生物医学工程领域的应用也越来越广泛。目前,研究者已经开发出多种可以将细胞材料打印成三维结构的技术。如:细胞打印技术(Cell printing)[1]、生物3D打印技术(3D-Bioplotter)[2]以及本实验室开发出的细胞3D打印技术(3D cell printing)[3],可操控活细胞,打印出利于细胞粘附、生长、迁移和分化的三维结构。细胞3D打印技术已可以在体外构建复杂的类组织和器官,为生命科学多个领域拓展了新的理论和技术可能。在药物筛选领域,现有的动物筛选模型存在种属差异和周期长等缺陷,而高通量筛选技术则与体内环境差异大,导致筛选准确率低。细胞3D打印为在体外用人体细胞构建复杂的多组织系统药物筛选模型提供了可能。本实验室的研究也证明,可用细胞3D打印技术构建更准确的药物筛选模型[3]。但是如何实时、高通量和无损检测这种类组织系统信号变化,是其用于高通量药物筛选亟待解决的问题。
细胞芯片是通过将芯片与细胞结合,在芯片上完成对细胞控制和检测生理变化,实现对活细胞实时、高通量、原位信号检测的技术[4-6]。近年来,细胞芯片正逐步从“cell on chip”向“Tissue model, living system on chip”发展,即在芯片上构建复杂的组织、器官模型[7-10]。如Harvard大学的Ingber DE[11]和Cornell大学的Sung JH[12]分别在芯片上构建了微组织模型,研究显示在药物领域有巨大的应用价值。然而,如何将不同细胞精确定位装配到芯片上并形成功能组织结构,是目前在芯片表面构建组织模型尚待解决的问题。细胞3D打印技术是构建组织模型芯片最具潜力的技术,其与细胞芯片技术的结合,为构建准确、高效、高通量的多组织系统药物筛选模型提供了可能。
本研究提出用细胞3D打印和细胞芯片技术,构建一个包括肿瘤和肝组织的体外肿瘤药物筛选模型芯片。药物在体内的作用过程涉及多个组织和器官,其中最关键的是靶组织和药物代谢组织。肝组织对药物的代谢不但影响药物的清除时间,代谢产生的二次代谢产物有时也是产生药效的关键,而药物的肝毒性则构成了药物的主要副作用[13-14]。本研究首先设计制造含多个IDEs阵列的细胞芯片;然后选择不影响细胞电生理检测的生物材料固定细胞;通过对比铁氰化钾溶液、PBS溶液和DMEM三种电解液对细胞阻抗变化的检测,选择合适的电解液及阻抗测试频段;用细胞3D打印技术在芯片表面组装卵巢癌细胞HO-8910,检测细胞贴壁、迁移、增殖等引起的阻抗变化,并与生化检测法(Alamar blue)的结果作比照;最后,在由两组IDEs构建的循环系统中组装人肝间充质干细胞HMSC-H和HO-8910,并检测顺铂DDP和环磷酰胺CTX的抗肿瘤作用及肝毒性。
1 材料和方法
1.1细胞3D打印平台

图1 细胞3D打印技术。(a) 生物3D打印机;(b) 生物3D打印机系统图Fig.1 3D cell printing technique. (a) 3D cell printing device; (b) System diagram of 3D cell printing device
细胞3D打印技术是基于离散/堆积原理,在计算机的控制下,以活细胞为操控对象,按照预先构建的3D模型准确定位与输送细胞材料复合物。本研究使用的细胞3D打印平台是一款本团队自主研发的生物3D打印机(Regenovo,杭州捷诺飞生物科技有限公司)。图1(a)即为所用的生物3D打印机,图1(b)是生物3D打印机系统图。
该生物3D打印机成型系统包括软件系统、硬件系统2个部分。软件系统包括数据处理软件和系统控制软件,能精确控制打印过程。硬件系统分为控制系统和机械系统,控制系统包括运动控制卡、温度控制系统以及材料运输控制电路等硬件电路;机械系统包括四轴运动系统、制冷模块等。四轴运动系统中,3个伺服电机控制喷头在X/Y/Z方向的精确定位,一个步进电机控制材料挤出。
1.2细胞芯片的设计和制造
细胞电阻抗传感器(electric cell-substrate impedance sensor, ECIS)是一种能够同时测量多组不同细胞的电阻变化、膜电容变化,以及细胞层-基底膜空间变化的细胞生理与病理研究的细胞传感器。通过微安级的电流测量,可以实时连续地量化研究细胞外基质与细胞增殖之间的相互作用,测量贴壁细胞迁移过程中的细胞形态变化[15]。其测量原理如图2 所示,细胞的贴附、伸展、黏连、增殖和凋亡等都会影响阻抗值。

图2 阻抗随细胞数目和形态改变而变化Fig.2 Impedance varies with the cell number and morphology
本研究选取了ECIS中研究较多的叉指电极(interdigitated electrodes,IDEs)作为芯片表面传感器。IDEs具有高通量、微型化、灵敏度高和信噪比好等优点[16-18]。本实验室和细胞芯片公司合作,采用了集成八组IDEs阵列的细胞芯片,每四组为一个单元,两个单元相互独立,每组IDEs都能打印不同的细胞,能够实时监测细胞的生长、繁殖、毒性、粘附及形态变化等生物学反应过程。图3(a)为单组叉指电极设计图,图3(b)为叉指电极区放大图。
在该设计中,每组叉指阵列有62对叉指电极,分为两部分,间距1mm,便于在显微镜下观察细胞生长状况。电极间距约为30 μm,矩形区电极长度为6 mm,单个叉指采用“圆在线上”的串珠状结构,圆的直径约为95 μm,增大了电极面积和细胞贴附到电极上的概率,能够更灵敏地监测活细胞的生长状况。
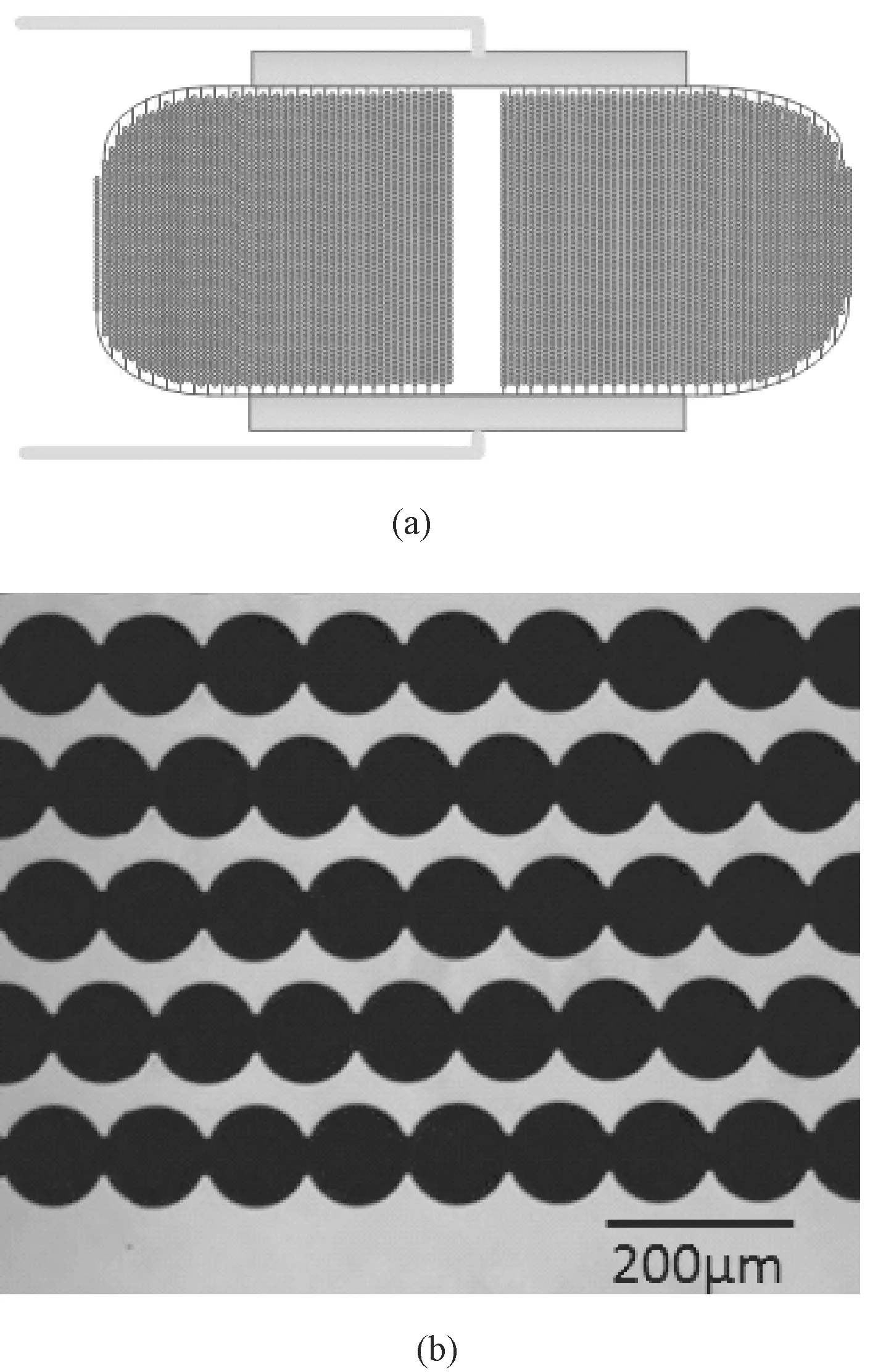
图3 细胞芯片图。(a) 单组叉指电极示意图;(b) 叉指电极局部放大图Fig.3 The cell chip. (a) The schematic illustration of a group of IDEs; (b) A local enlarged photo of (a)
本研究还采用了一款之前设计的传统梳状叉指电极作为对照实验。每组叉指阵列有30对叉指电极,单个叉指宽度及电极间距均为30 μm,长度为0.9 mm,如图4。

图4 传统梳状叉指电极Fig.4 Traditional comb-like electrodes
1.3基质材料的制备及支架的打印
基于对细胞外基质的仿生、材料成型特性和细胞电生理检测技术需求[19-21],本研究选取明胶和海藻酸钠(Sigma, USA)为基质材料。取2 mg明胶和2 mg海藻酸钠,各溶于10 mL超纯水。将两种材料按1∶1混合均匀,4℃保存。
人肝间充质干细胞(human mesenchymal stem cells-hepatic, HMSC-H)用DMEM-LG(dulbecco’s modified eagle’s medium -low glucose, Sigma, USA)培养于37℃、5%CO2培养箱中。培养基中含有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素及2 mM谷氨酰胺,3~4 d换液一次,细胞汇合后,进行常规传代培养[22]。卵巢癌细胞系HO-8910细胞用DMEM(dulbecco’s modified eagle’s medium,Sigma, USA)+10%胎牛血清培养于37℃、5%CO2培养箱,2~3 d细胞达到单层汇合,细胞汇合后,进行常规传代培养[23]。实验前将培养的细胞和基质材料混合,得到浓度约为1×106/mL的细胞-基质材料。
将喷头及成型平台温度降至4℃,将细胞-材料共混物吸入喷射腔,选用120 μm的喷头。用SolidWorks设计三维模型,在生物3D打印机控制软件3D-Bioprint内加载三维模型,设置合适的高度、速度、层厚、轮廓等相关参数,对3D模型进行分层处理生成G-code文件。3D-Bioprint读取G-code文件,按照设定的成型参数直接驱动喷头在芯片表面组装出三维结构。成型后使用5%的CaCl2溶液交联;加含有10% FBS的DMEM培养液,37℃、5%CO2环境下培养24 h。
1.4芯片测试
研究使用电化学站(上海辰华CHI660c)和实时无标记细胞功能分析仪(艾森生物iCELLigenceTM)对芯片进行电化学交流阻抗测试[15,24-26]。以pH为7.2的铁氰化钾溶液(含1.0 mL浓度为0.1 M的铁氰化钾[Fe(CN)6]3-溶液、1.0 mL浓度为0.1 M的亚铁氰化钾[Fe(CN)6]4-溶液和8 mL PBS溶液)为标准电解液体系。分别在以下4种情况下测试IDEs电极的阻抗[27]:
(1)pH为7.2的铁氰化钾溶液作为电解液。
(2)纯PBS溶液作为电解液。
(3)不含胎牛血清的DMEM培养液作为电解液。
(4)不含胎牛血清的DMEM培养液作为电解液,并在芯片表面打印基质材料。
多细胞阻抗测试系统原理图如5(a)。图中A、B两个连通的培养腔底部均有一组IDEs,腔内液体的循环流通由微蠕动泵实现,两组IDEs表面可以分别组装肝细胞和肿瘤细胞。图5(b)显示为单个培养腔内的细胞/材料支架放置图,支架沿液体流动方向存在通道,保证细胞摄取营养和排泄废物。图5(c)为改装后的芯片实物图。支架底部与芯片表面部分接触,细胞在初期只能粘附在芯片与支架接触的区域,细胞向非接触区电极的增殖、迁移形成阻抗的变化,如图5中(d)和(e)所示。IDEs用作阻抗测试时主要采用两电极电路,即工作电极和对电极,由于二者的尺寸相同,细胞对总阻抗测量的贡献在任何位置上都等同,从而减少了大量溶液阻抗的影响。电化学站的工作电极连接IDEs的一端,参比电极和对电极与IDEs另一端相连,电化学站既可以在1 Hz~100 kHz频率范围内测量交流阻抗变化,也能在固定频率下进行阻抗-时间测试。细胞芯片放入37℃、5% CO2培养箱内,以避免测试过程中受到外部环境变化的影响。开路电位下测量电化学阻抗谱,金电极的开路电位Ewe=0.20 V。测量数据密度为12 points/decade(10倍频率范围内取12个频率点),每个频率点测量次数为2,交流电压幅值为5 mV,频率范围为1 Hz~100 kHz。

图5 细胞阻抗测试系统。 (a) 多细胞阻抗测试;(b) 芯片改装实物图;(c) 单个腔内支架放置图;(d) 支架内细胞在芯片表面生长图;(e)细胞生长局部图Fig.5 Cell impedance measuring system. (a) Multicellular impedance measurement; (b) Retrofit of cell chip; (c) A scaffold placed in a chamber; (d) Cells in the scaffold grew on the surface of cell chip; (e) A local enlarged photo of (d)
2 结果
为了给细胞提供一个更接近体内的生长环境,本研究模仿人体组织器官的结构和功能设计出三维模型,并将细胞-基质材料在芯片表面组装成型。通过构建三维模型、设置分层参数和修改扫描路径,能够打印出外形轮廓和内部微通道形状各异的支架结构,如图6所示。图6中(a)和(b)分别是微通道为四边形和三角形的支架,图6(c)为四边形微通道显微镜图片,图6(d)为细胞免疫荧光染色图。由图可以看出,打印的支架微通道结构清晰,四边形微通道结构的微丝直径在200~300 μm,小孔尺寸约200 μm,孔隙率可以达到60%。荧光显微镜显示细胞能在三维结构内生长、铺展。
以上实验结果证明,借助细胞3D打印,可以将细胞/基质材料组装形成三维模型,且细胞在三维结构内生长良好。为了选取合适的电解液及测试频段,以及验证基质材料对芯片测试的影响,分别选取pH为7.2的铁氰化钾溶液、纯PBS溶液和不含胎牛血清的DMEM作为测试电解液,实验结果如图7。结果显示IDEs在pH为7.2的铁氰化钾溶液中的测试结果最为理想,在低频区(1~100 Hz)DMEM和PBS溶液的交流阻抗特性呈容性。这是由于铁氰化钾溶液中有导电离子[Fe(CN)6]3-和[Fe(CN)6]4-,而DMEM和PBS中缺乏强导电离子。所以在细胞测试条件允许的情况下,应优先采用铁氰化钾溶液进行测试。
然而为了长时间维持细胞活性,就需要采用PBS和DMEM等非电解液溶液作为测试液。由图7结果显示,在中高频区(1 k~100 kHz)DMEM与铁氰化钾溶液的电阻抗特性相似,其原始阻抗低于PBS溶液的原始阻抗,且DMEM更适合细胞长时间生长,将DMEM作为电解液研究其特性。结果如图8所示,在适合细胞电生理阻抗测试的中高频区(1 k~100 kHz),加入基质材料前后,幅频特性曲线和相频特性曲线变化均不明显,且相频特性与pH为7.2的铁氰化钾溶液基本一致。实验证明:明胶/海藻酸钠混合材料对阻抗测试影响甚小;在中高频区,DMEM能替代铁氰化钾溶液作为长时间测试电解液;细胞阻抗测试时,中高频区能检测出细胞膜等有机物引起的电极表面容性阻抗的变化,且具有较好的灵敏度。

图6 细胞/基质材料支架结构。(a) 四边形通道的支架;(b) 三角形通道的支架;(c) 四边形微通道支架显微照;(d) 免疫荧光染色Fig.6 Structures of cell/materials scaffolds. (a) Scaffold with square microchannels; (b) Scaffold with triangular microchannels; (c) Micrograph of square microchannels; (d) Immunofluorescence staining
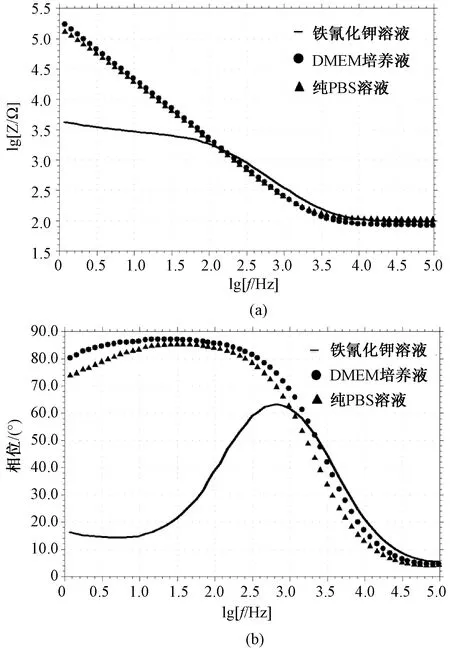
图7 叉指电极在3种溶液中测试数据的叠加图,实验重复3次。(a) 幅频特性;(b) 相频特性Fig.7 Measurement of IDEs in three kinds of solution. (n=3). (a) Impedance modulus of frequency; (b) Phase of frequency

图8 叉指电极在DMEM中测得数据的叠加图,实验重复3次。(a) 幅频特性;(b)相频特性Fig.8 Measurement of IDEs in DMEM solution (n=3). (a) Impedance modulus of frequency; (b) Phase of frequency

图9 串珠型电极与梳状电极对比Fig.9 A comparison of circle-on-line electrodes with comb-like electrodes
本研究比较了串珠型叉指电极和传统梳状叉指电极的检测效果。以104Hz作为测试频率,结果显示(如图9所示),串珠型叉指电极比梳状叉指电极的原始阻抗更低、灵敏度更好。由于用于固定细胞的基质材料会影响细胞阻抗变化检测的灵敏性,因此选用原始阻抗更低、灵敏度更好的串珠型叉指电极更利于打印细胞的阻抗检测。
为验证IDEs能否检测出细胞/材料组装结构中细胞的阻抗变化,本研究在芯片表面组装了HO-8910细胞,并研究IDEs检测到的细胞增殖。组装完成后,置于培养箱培养12 h,然后将IDEs与电化学站相连,在104Hz进行阻抗-时间测试,连续监测20 h,分别在0、5、10、15、20 h时间点采样,实验结果以各时间点Tn的检测值和T0时间点检测值的比值来表示(fold increase),同时用生化检测法(Alamar blue)做平行对照实验。由图10可见,随着培养时间的延长,HO-8910细胞在芯片上贴壁、伸展和增殖,芯片监测到的阻抗值持续增加,但增加幅度减慢,这和细胞在材料内接触抑制达到生长极限有关,这一检测结果和标准的生化检测方法测得数据一致[28]。结果证明,在芯片表面组装了细胞三维结构后,芯片可以准确检测出贴壁细胞增殖。
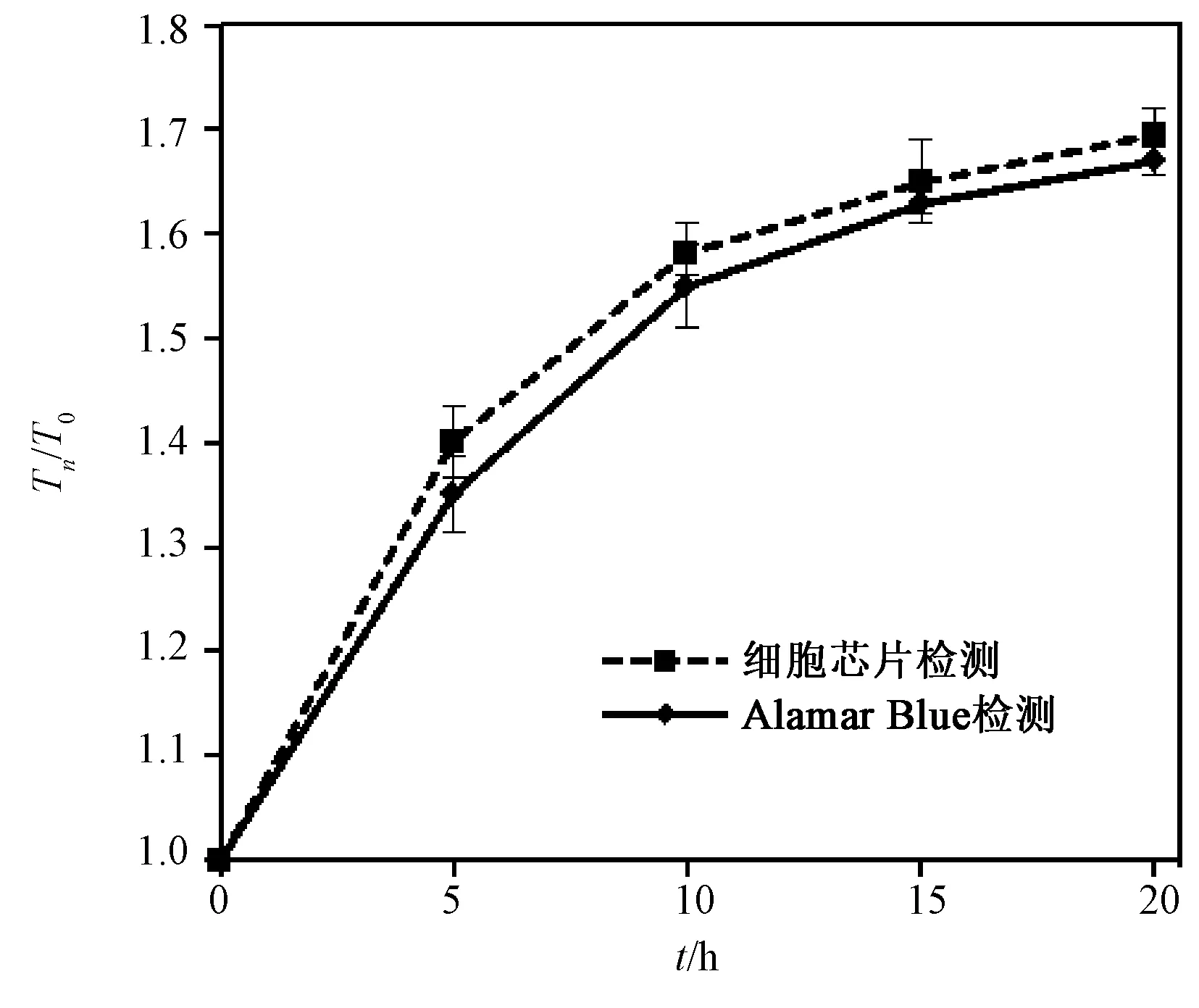
图10 分别用芯片和Alamar Blue 法检测获得的芯片表面HO-8910增殖曲线(增殖速率用Tn/T0表示,实验重复3次)Fig.10 Proliferation of HO-8910 cell were expressed as the celluar impedance and Alamar Blue assay (Fold increase is represented by Tn/T0, n=3)
药物在体内的作用过程涉及多个组织和器官,其中最关键的是靶组织和代谢组织。肝组织对药物的代谢不但影响药物清除时间,二次代谢产物有时也是产生药效的关键,而药物的肝毒性则构成了药物的主要副作用。基于此,本研究构建了一个含有靶组织-肿瘤组织、代谢组织-肝组织的肿瘤药物筛选模型芯片。如图5(a)所示,在A、B两个培养腔底的IDEs上分别组装人肝间充质干细胞HMSC-H和卵巢癌细胞HO-8910。组装完成后,培养48 h,然后进行实时电阻抗测试。两种抗癌药物顺铂DDP和环磷酰胺CTX分别滴加到组装了肝细胞的培养腔内,并在0、1、2、3、4 h时间点同步采样,实验结果以各时间点Tn的检测值和T0时间点检测值的比值来表示(fold increase)。
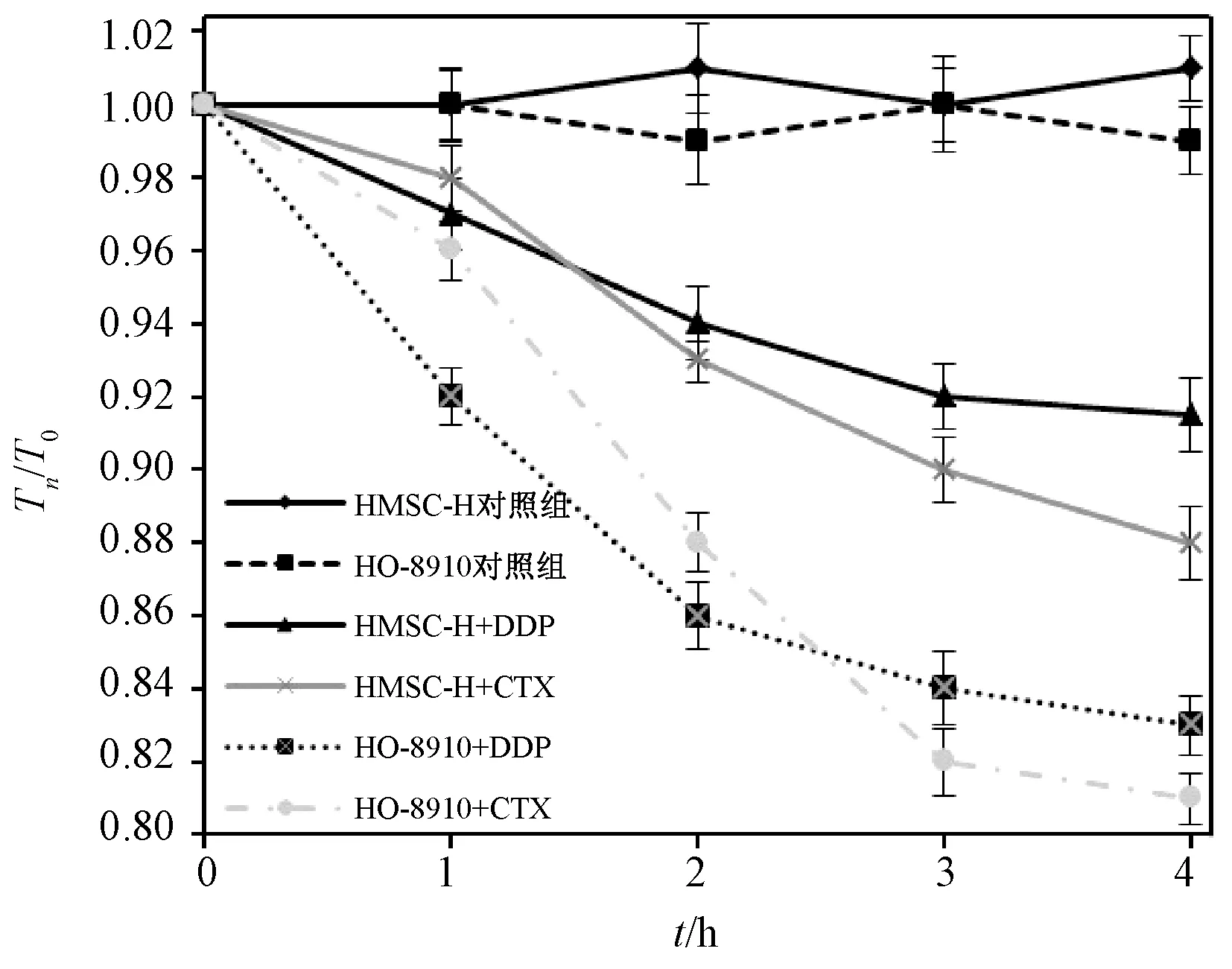
图11 顺铂和环磷酰胺的抗肿瘤作用和肝毒性(变化率用Tn/T0表示,实验重复3次)Fig.11 The antitumor effect and hepatoxicity of DDP and CTX (Represented by Tn/T0, n=3)
由图11可见,芯片可以同步检测到抗癌药物对HMSC-H和HO-8910的作用。结果表明,两种药物对肿瘤细胞都有杀伤作用,对肝细胞都有不同程度的损伤。加入顺铂0~2 h内,卵巢癌细胞的阻抗下降显著,说明顺铂对肿瘤细胞具有良好的杀伤效果。环磷酰胺本身并无抗肿瘤活性,但在体内经肝脏代谢产生活性产物磷酰胺氮芥和丙烯醛,磷酰胺氮芥能抑制肿瘤细胞的生长,丙烯醛则具有肝毒性。因此环磷酰胺对两种细胞的损伤都取决于肝细胞对药物的代谢。加入药物1 h内,由于肝细胞分解代谢环磷酰胺形成的磷酰胺氮芥及丙烯醛浓度尚低,药物对两种细胞的损伤作用较小,随着二次代谢物的逐渐积累,对肝细胞及肿瘤细胞的损伤效果逐渐增强,3 h后超过顺铂的抗肿瘤效果,对肝脏的毒性也逐渐增强,2 h后肝毒性也大于顺铂。
3 讨论和结论
如何将不同细胞精确定位装配到芯片表面,是制约细胞芯片向组织和生理系统芯片方向发展的关键问题之一,细胞3D打印技术能够准确定位与输送细胞材料,为解决这一问题提供了可能。本研究通过细胞3D打印技术将细胞水凝胶材料组装到芯片表面,并对支架内的细胞进行阻抗检测。用于混合和固定细胞的材料对芯片检测的影响是研究关键。本研究选取明胶/海藻酸钠复合水凝胶材料,结果显示,芯片在中高频区(1 k~100 kHz)能检测出细胞阻抗变化,证明可用水凝胶材料作为打印基质固定细胞并保证芯片对细胞检测的灵敏性。其原理是因为水凝胶材料具有较高的含水量,对电解液中离子有良好的渗透性,从而使基质材料对阻抗检测影响小,保证了细胞电生理检测的灵敏度。
本研究将3D组织模型与芯片表面粘附的细胞层作为采样面,进行实时阻抗检测。细胞增殖测试结果证明,芯片检测结果与检测全3D组织细胞生长情况的生化检测结果一致。然而,尽管平面芯片检测方法能够在一定条件下反映出细胞在整个3D结构内的生长状况,但在一些特殊的三维组织结构中,细胞在不同空间结构位置会有不同的生长特性和信号变化,单个面的信号检测不能反映出整个3D模型及特定空间位置的生理变化。因此,如要全面、准确的反映3D组织模型内的生理生化变化,还需要在后续研究中进一步开发出具有三维检测单元的三维细胞芯片。
在药物筛选领域,现有的动物筛选模型存在种属差异和周期长等缺点,高通量筛选和细胞筛选模型则与体内环境差异大,药物筛选准确率低。在体外构建更接近体复杂的组织、器官模型用于药物筛选正成为研究热点[9,29-30]。细胞3D打印技术与细胞芯片技术结合为体外构建高效准确的药物筛选模型提供了可能。本研究用细胞3D打印技术在芯片上同时组装了肝细胞和肿瘤细胞,构建一个体外三维筛选模型,并对顺铂和环磷酰胺的药效进行研究。结果显示基于该筛选模型,能同步检测到药物的抗肿瘤作用和肝毒性,并筛选出需要肝的二次代谢产物才能产生抗肿瘤特性的药物环磷酰胺。
本研究证明了细胞3D打印技术与细胞芯片技术结合,可以构建出准确、高效、高通量的多组织系统药物筛选模型芯片,并可以高效准确地筛选出药物。
[1] Cui Xiaofeng, Dean D, Ruggeri ZM,etal. Cell damage evaluation of thermal inkjet printed Chinese hamster ovary cells[J]. Biotechnology and Bioengineering, 2010, 106(6): 963-969.
[2] Kampmann A, Lindhorst D, Schumann P,etal. Additive effect of mesenchymal stem cells and VEGF to vascularization of PLGA scaffolds[J]. Microvascular Research, 2013, 90: 71-79.
[3] Xu Mingen, Wang Xiaohong, Yan Yongnian,etal. An cell-assembly derived physiological 3D model of the metabolic syndrome, based on adipose-derived stromal cells and a gelatin/alginate/fibrinogen matrix [J]. Biomaterials, 2010,31(14):3868-3877.
[4] Wang Jun, Wu Chengxiong, Hu Ning,etal. Microfabricated electrochemical cell-based biosensors for analysis of living cellsinvitro[J]. Biosensors, 2012,2(2): 127-170.
[5] Koester PJ, Buehler SM, Stubbe M,etal. Modular glass chip system measuring the electric activity and adhesion of neuronal cells—application and drug testing with sodium valproic acid[J]. Lab on a Chip, 2010,10(12): 1579-1586.
[6] Liu Zongbin, Zhang Yu, Yu Jinjiang,etal. A microfluidic chip with poly (ethylene glycol) hydrogel microarray on nanoporous alumina membrane for cell patterning and drug testing[J]. Sensors and Actuators B: Chemical, 2010,143(2): 776-783.
[7] Baker M. Tissue models: a living system on a chip [J]. Nature, 2011,471(7340):661-665.
[8] van der Meer AD, van den Berg A. Organs-on-chips: breaking the in vitro impasse[J]. Integrative Biology, 2012,4(5): 461-470.
[9] Ghaemmaghami AM, Hancock MJ, Harrington H,etal. Biomimetic tissues on a chip for drug discovery[J]. Drug Discovery Today, 2012,17(3): 173-181.
[10] Moraes C, Mehta G, Lesher-Perez SC,etal. Organs-on-a-chip: a focus on compartmentalized microdevices[J]. Annals of Biomedical Engineering, 2012,40(6): 1211-1227.
[11] Huh D, Matthews BD, Mammoto A,etal. Reconstituting organ-level lung functions on a chip. Science. 2010 Jun 25,328(5986):1662-8.
[12] Sung JH, Kam C, Shuler ML. A microfluidic device for a pharmacokinetic-pharmacodynamic (PK-PD) model on a chip. Lab Chip. 2010 Feb 21;10(4):446-55.
[13] Fan Jianghong, Chen Shu, Edwin CYC,etal. PBPK modeling of intestinal and liver enzymes and transporters in drug absorption and sequential metabolism[J]. Current Drug Metabolism, 2010,11(9): 743-761.
[14] Wang Jingfang, Chou Kuochen. Molecular modeling of cytochrome P450 and drug metabolism[J]. Current Drug Metabolism, 2010,11(4): 342-346.
[15] 郑波,刘清君,曾苏. 微电子细胞传感器在抗肿瘤药物分析中的应用研究[J]. 传感器与微系统, 2012,31(4): 40-42.
[16] 颜小飞,汪懋华,安冬. 基于叉指阵列微电极的阻抗免疫传感器研究进展[J]. 分析化学 (FENXI HUAXUE), 2011,39(10):1601-1610.
[17] Singh KV, Whited AM, Ragineni Y,etal. 3D nanogap interdigitated electrode array biosensors[J]. Analytical and Bioanalytical Chemistry, 2010,397(4): 1493-1502.
[18] Eker B, Meissner R, Bertsch A,etal. Label-free recognition of drug resistance via impedimetric screening of breast cancer cells[J]. PloS One, 2013,8(3): e57423.
[19] Helgeson ME, Chapin SC, Doyle PS. Hydrogel microparticles from lithographic processes: Novel materials for fundamental and applied colloid science[J]. Current Opinion in Colloid & Interface Science, 2011,16(2): 106-117.
[20] Geckil H, Xu Feng, Zhang Xiaohui,etal. Engineering hydrogels as extracellular matrix mimics[J]. Nanomedicine, 2010,5(3): 469-484.
[21] Pataky K, Braschler T, Negro A,etal. Microdrop printing of hydrogel bioinks into 3D tissue-like geometries[J]. Advanced Materials, 2012,24(3): 391-396.
[22] Bartosh TJ, Ylöstalo JH, Mohammadipoor A,etal. Aggregation of human mesenchymal stromal cells (MSCs) into 3D spheroids enhances their antiinflammatory properties[J]. Proceedings of the National Academy of Sciences, 2010,107(31): 13724-13729.
[23] Sun Yao, Mu Fansong, Li Chunying,etal. Aspidin BB, a phloroglucinol derivative, induces cell cycle arrest and apoptosis in human ovarian HO-8910 cells[J]. Chemico-Biological Interactions, 2013,204(2): 88-97.
[24] 徐莹. 基于 MEMS 技术的新型细胞传感器及其在细胞电生理中应用的研究[D]. 浙江: 浙江大学, 2007.
[25] 胡朝颖,刘清君,张远帆,等. 细胞阻抗传感器优化设计及其在毒素监测中的应用[J]. 传感技术学报, 2010,23(3): 291-296.
[26] Ge Yakun, Deng Tongle, Zheng Xiaoxiang. Dynamic monitoring of changes in endothelial cell-substrate adhesiveness during leukocyte adhesion by microelectrical impedance assay[J]. Acta Biochimica et Biophysica Sinica, 2009,41(3): 256-262.
[27] 胡金夫,徐铭恩,徐莹,等. 基于细胞三维受控组装技术的细胞芯片构建[J]. 中国生物医学工程学报, 2012,31(3): 374-381.
[28] Jomha NM, Elliott JA, Law GK,etal. Evaluation of chondrocyte survival in situ using WST-1 and membrane integrity stains [J]. Cell and Tissue Banking, 2007,8(3):179-186.
[29] Kloß D, Fischer M, Rothermel A,etal. Drug testing on 3Dinvitrotissues trapped on a microcavity chip[J]. Lab on a Chip, 2008,8(6): 879-884.
[30] Neuži P, Giselbrecht S, Länge K,etal. Revisiting lab-on-a-chip technology for drug discovery[J]. Nature Reviews Drug Discovery, 2012,11(8): 620-632.
ResearchofAnti-TumorDrugScreeningCellChipBasedon3DCellPrintingTechnique
ZHAO Zhan-Ying XU Ming-En*SHI Ran GUO Miao YAN Ming XU Ying WANG Ling
(CollegeofLifeIinformationScience&InstrumentEngineering,HangZhouDianZiUniversity,Hangzhou310018,China)
There are some crucial problems in conventional drug screening systems. For example, animal models have shortcomings of species differences and long test periods; in addition, poor mimics ofinvivomicroenvironment results in the low accuracy of cell-based high-throughput drug screening assays. The 3D cell printing technology may provide solutions of establishing biomimetic tissue modelsinvitro. Moreover, the combination of 3D cell printing and cell chip provides a highly valuable tool for the efficient and accurate drug screeninginvitro. In this study, a cell chip integrating several groups of IDEs, was designed and manufactured. Then, the HMSC-H and HO-8910 cell lines were assembled within the gelatin/alginate mixture on the manufactured chip using 3D cell printing. The IDEs was used to detect changes in the cell impedance which reflects the cell growth, adhesion, proliferation, apoptosis and effects of drugs on the viability. Based on this cells-loaded chip, the antitumor effect or hepatoxicity of both CTX and DDP were measured respectively. Our results showed that the 3D structure could suppot the growth of HMSC-H or HO-8910 cells. The scaffold possessed pores with diameter of 200-300 μm. The change of impedance caused by the cell proliferation was precisely detected by the chip at 104Hz using DMEM as electrolyte solution, 20 h later, the cell impedance increased by 69.6%. Using this chip-based in vitro drug screening model, we simultaneously detected the antitumor effect and hepatotoxicity of the drugs. Meanwhile, the efficacy of these drugs, which require hepatic metabolism for activation such as CTX, was also evaluated in the same chip.
3D cell printing; cell chip; drug screening; IDEs; scaffold
10.3969/j.issn.0258-8021. 2014. 02.005
2013-11-30, 录用日期:2014-03-06
国家自然科学基金(81371695, 61108083);浙江省科技计划(2011C23031)
R318
A
0258-8021(2014) 02-0161-09
*通信作者。E-mail: xumingen@hdu.edu.cn
