肢体远端缺血预处理延缓脑卒中DWI上病灶出现的机制研究
2014-08-11陈秋雁吴富淋缪绍维魏鼎泰
陈秋雁, 吴富淋, 缪绍维, 魏鼎泰
缺血性脑卒中有着极高的致死率和致残率,迄今为止,尚未找到十分有效的办法治愈它。远端缺血预处理(RPC)的神经保护作用明确,肢体远端缺血预处理(Limb remote preconditioning,LRP)作为一种低创性的预处理方式,是目前最常用的用于研究RPC心脏及神经保护作用的预处理方法之一[1],但目前对其发挥神经保护作用的具体机制研究甚少。课题组前期的实验结果发现LRP不仅能够减小还能延缓脑缺血大鼠DWI上病灶的出现[2],说明LRP能够减轻缺血引起的脑水肿,为进一步探索其相关机制,现对与脑内水分子运输密切相关的水通道蛋白4(AQP4)进行检测,以间接探索肢体远端缺血预处理的神经保护机制。
1 材料与方法
1.1 动物及分组 成年雄性SD大鼠(260~330 g)54只,购自上海伊莱克斯动物实验中心,随机分为3组:(1)缺血对照组24只:a亚组12只用于不同时间点(1 h、3 h、12 h、24 h)各项指标的Western blot检测;b亚组12只用于不同时间(1 h、3 h、12 h、24 h)点各项指标的免疫荧光检测。(2)LRP组24只,亚组同组(1)。(3)假手术组6只,分别用于Western blot检测和免疫荧光检测,每亚组3只。
1.2 大鼠脑缺血模型的制作及LRP方法 大鼠脑缺血模型的制作及LRP处理方法如前文所述[2]:大鼠术前24h禁食不禁水;10%水合氯醛腹腔注射(300 mg/kg),固定,脑缺血模型组分离出左侧股动脉,暴露90 min;切开颈部皮肤,分离右侧颈总动脉、颈外动脉及颈内动脉,动脉夹夹闭颈内动脉,于颈外动脉近端近分叉处插入预先浸泡过2%肝素的线栓(直径0.24 mm),松开颈内动脉夹,插入线栓直至距离分叉处约1.8~2.0 cm,1 h后拔出,结扎颈总动脉防止出血,缝合切口。LRP组分离左下肢股动脉,动脉夹夹闭15 min,恢复再灌15 min,反复3个循环,后续脑缺血的诱导方法同前。术中保持大鼠体温在37±5℃。假手术组只进行相同的麻醉及皮肤切开曝露,而不做任何血管夹闭。
1.3 免疫荧光和共聚焦 麻醉大鼠,PBS和4%多聚甲醛行心脏灌注,快速断头取出脑组织,预冷PBS漂洗。鼠脑置于4%多聚甲醛溶液中固定4~6 h,后置于30%蔗糖溶液中沉底,连续冠状切片,片厚40 μm,连续5张片取1张,每一标本各取20张备用。免疫荧光法分别检测缺血组和LRP组各时间点以及假手术组AQP4(1∶100;Santa Cruz Biotechnology;SC-20812)表达情况,而后进行共聚焦显微镜观察。AQP4定位检测:AQP4与星形胶质细胞标志物 GFAP(1∶100;Santa Cruz Biotechnology,SC-56395)共染;AQP4与微血管内皮细胞标志物CD31(1∶100;Santa Cruz Biotechnology,SC-46694)共染;AQP4与神经元标志物MAP-2(1∶100;Santa Cruz Biotechnology,SC-56561)共染。定位均用的是LRP组1 h冰冻切片。
1.4 Western Blot 大鼠麻醉后4℃ PBS经心脏冲洗,断头取脑,分离出右侧半脑的梗死区,加入RIPA裂解液研磨,匀浆,离心收集蛋白样品。BCA法对蛋白进行定量。SDS一聚丙烯酰胺凝胶电泳后转PVDF膜。经漂洗和封闭后,加入兔抗一AQP4抗体(1∶200)孵育,加入HRP标记的山羊抗兔IgG(北京中杉,ZB-2301),显影后,经扫描仪扫描,利用Image J图像分析软件对各条带进行灰度分析,结果以平均灰度值即平均光密度(IOD)表示。
2 结果
2.1 Western blot及灰度分析示LRP能够上调AQP-4的表达 AQP4是脑内表达最多的水通道蛋白,主要负责将胶质细胞及细胞外的水分子运输至血管内。Western blot结果显示在缺血对照组中,AQP4的表达随着时间的延长而下降,但在实验组中,这种表达得到了逆转,说明LRP能够上调AQP-4的表达(见表1、图1、图2)。
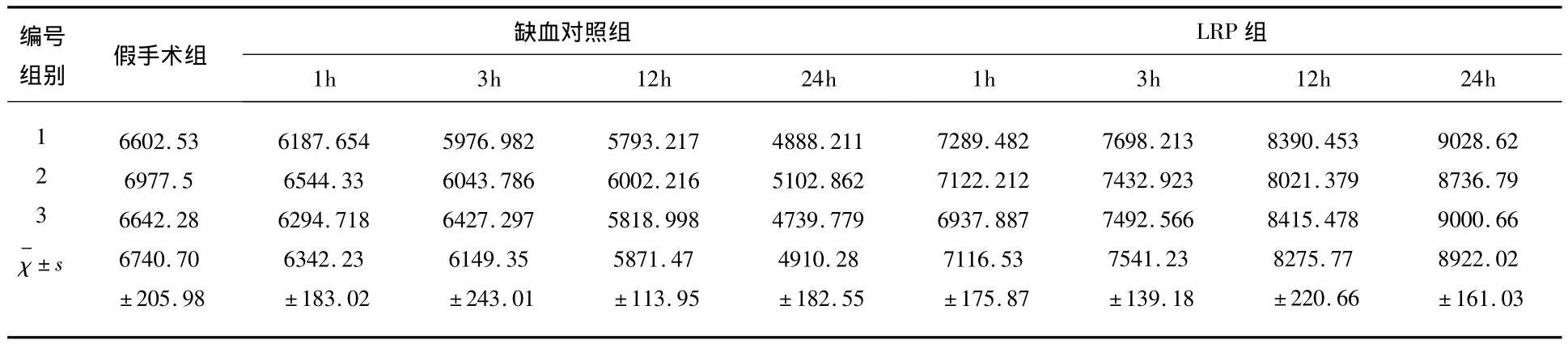
表1 各组大鼠AQP4 Western Blot结果的灰度分析数据比较
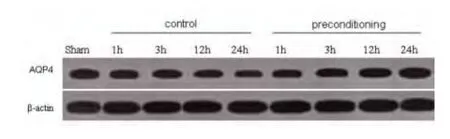
图1 Western blot结果显示AQP4的表达随着缺血时间的延长而降低。但经过LRP处理后,AQP4的表达上升,并且有随时间延长逐渐上升的趋势
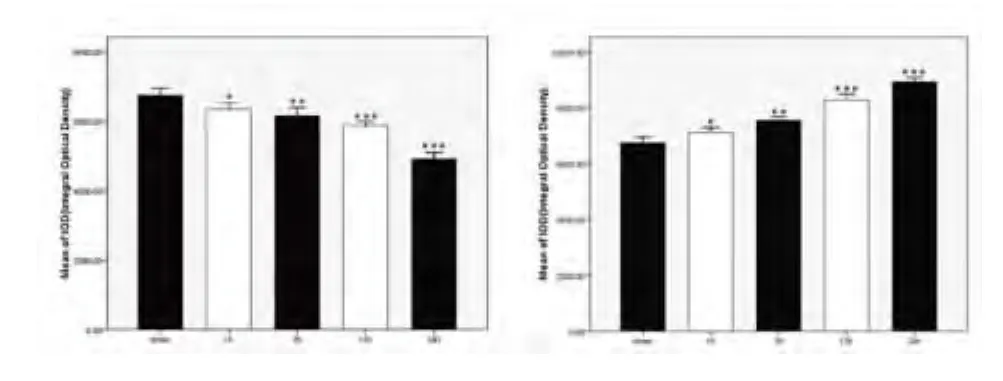
图2 灰度分析结果表明:AQP4的表达随着缺血时间的延长而降低(A)。但经过LRP处理后,AQP4的表达上升,并且有随时间延长逐渐上升的趋势(B)。与 sham比较*P<0.05;**P<0.01;***P <0.001;n=3/group
2.2 共聚焦免疫荧光结果显示LRP各组中的AQP4表达量较假手术组及缺血对照组增多 免疫荧光结果与Western blot结果一致,LRP各组脑内AQP4的表达量较缺血组和假手术组明显增多(见图3A)。
2.3 AQP4定位共染结果 定位显示AQP4与GFAP发生了共染,并与CD31有少量共染,提示了AQP4在星形胶质细胞上的表达及在血管内皮细胞上的少量表达(见图3B、图3C)。AQP4与神经元标志物MAP-2之间无共染(见图3D)。
3 讨论
LRP对脑卒中的神经保护作用明确,但目前国内外对其作用机制的相关研究寥寥无几。课题组前期的研究发现脑缺血组大鼠在1h的检测时间点就已经出现了DWI上的异常信号,LRP组大鼠多出现在缺血3h以后,并且病灶面积大大减小,而说明LRP能通过减轻或抑制缺血所致的脑水肿,从而延长治疗时间窗[2]。这对LRP的神经保护作用机制的探讨提供了一个新方向,所有能够引起弥散受限的因素均应被纳入考虑范围。
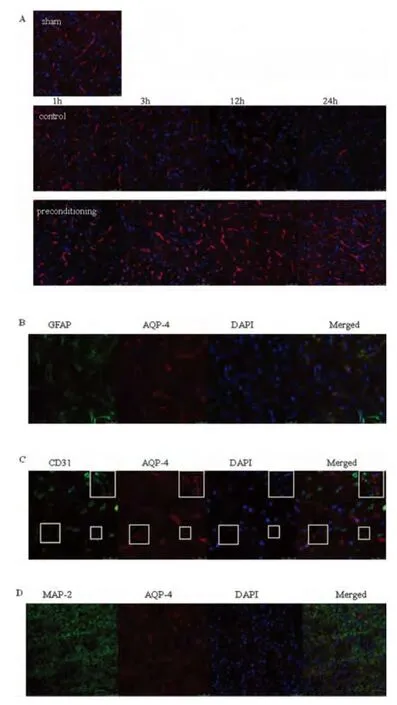
图3 (A)免疫荧光共聚焦检测结果显示LRP各组中的AQP4表达量较假手术组及缺血对照组增多,并呈现出随时间延长而逐渐增加的趋势(Scale bar,50 μmol/L)。(B)AQP4与 GFAP发生了共染(Scale bar,25 μmol/L),提示AQP4在星形胶质细胞上的表达。(C)AQP4与CD31有少量共染,提示了AQP4在血管内皮细胞上的少量表达(Scale bar,25 μmol/L)。(D)AQP4与神经元标志物MAP-2之间无共染(Scale bar,50 μmol/L)。
此次研究中,我们证实了AQP4的表达在脑缺血后降低,这与之前的报道一致[3~8],但是目前对于AQP4在脑缺血后的表达水平存在争议,有不少研究证实 AQP4 在脑缺血后表达升高[9~12],出现这一矛盾的结果可能与建模方法、动物的选择及检测时间点的不同有关,目前尚没有一种建模方法能完全模拟脑卒中,这为研究工作的展开带来了很大的困难。AQP4是脑内主要表达的水通道蛋白[13],水通道蛋白的降低会直接导致了水分子向胞外运输的减少以及细胞肿胀[14],而事实上,AQP4在脑卒中的具体功能十分复杂,首先对于脑水肿的两种类型AQP4表现出不同的作用,在细胞毒性脑水肿中,AQP4的缺失能够延缓水分子进入脑内,而在血管源性脑水肿中,AQP4的缺失则使脑实质内的水分清除水平下降[13],因此有学者认为在缺血后初期AQP4的表达水平应升高才符合逻辑,其实不然,Zeng XN等[15]通过比较AQP4基因敲除的小鼠和正常基因型的小鼠所建立的大脑中动脉栓塞脑缺血模型,证实了AQP4在I/R病理损伤机制中的重要作用,表现在AQP4基因敲除的小鼠在脑缺血后死亡率大大增加、行为病理学缺陷更加明显、梗死面积大大增加,同时更有意义的是,该研究发现AQP4基因敲除小鼠的星形胶质细胞的肿胀较正常基因型的小鼠更加明显,可见在活体模型中AQP4表达水平的升高并不与星形胶质细胞的肿胀乃至细胞毒性水肿成正比,而缺血损伤的病理机制中,星形胶质细胞的肿胀也并不一定需要伴随着AQP4水平的升高。实际上缺血后AQP4表达水平的降低能够直接导致AQP4在星形胶质细胞上的去极化分布,AQP4的这种去极化分布在缺血初期是机体在缺血后发生的一种自发性的反馈保护机制,用来抵制神经胶质细胞的肿胀从而抑制水肿形成并降低缺血造成的损害[7],Amiry-Moghaddam等[8]的研究也得出相似的结论,即缺血后AQP4表达水平的降低有利于减轻细胞毒性脑水肿,但缺血后星形胶质细胞突触上尚存在一种特殊类型的水通道蛋白即与α-互生蛋白依赖的AQP4,这种类型的AQP4表达水平稳定,介导着脑实质和血管内的双向水分子的流通。但缺血导致的AQP4的水平降低始终弊大于利,AQP4不仅仅只在水分子的流通上起作用,AQP4还被证实能够参与调节神经胶质细胞的迁移和神经元的应激性[13]。这些复杂的作用均提示AQP4在细胞毒性水肿、血管源性水肿及脑缺血损伤中的重要作用。
此次研究结果表明LRP能够上调缺血后的AQP4表达水平,AQP4表达的升高机制很可能是LRP通过MAPK信号转导通路实现[16],我们推测高表达的AQP4主要参与了脑内水分子的清除,抑制后续的血管源性水肿的发生,同时也参与抵抗细胞毒性脑水肿,这个看似矛盾的结果更从侧面反应出AQP4在脑卒中中的多重的复杂作用机制。AQP4的具体功能与其表达部分有关,AQP4主要表达在胶质细胞与毛细血管内皮细胞接触的足突膜上[17],AQP4同时也高表达于邻近软脑膜的胶质细胞、脑室室管膜上皮细胞、毛细血管内皮细胞及脉络丛上皮细胞等[18]。星形胶质细胞中AQP4的分布具有极性,在脑缺血后,可以观察到AQP4在星形胶质细胞中的去极化[7],而在软脑膜、室管膜细胞、脉络丛上皮细胞的AQP4分布与脑脊液分泌和重吸收部分一致,此外,分布于海马、小脑,脑干神经核团和部分皮质神经元上的AQP4主要参与调节细胞外间隙大小及细胞外间隙的K+浓度[19]。在此次研究结果中,我们仅利用LRP 1 h组的切片对高表达的AQP4进行初步定位,定位显示AQP4主要表达在星形胶质细胞上,而在血管内皮细胞膜上有少量的表达,但这并不能否定高表达的AQP4能够不参与抑制细胞毒性水肿。高表达的AQP4很可能通过负反馈调节机制导致AQP4的去极化重新分布从而发挥抑制细胞毒性水肿的作用,而1 h的检测时间点可能正处于重新分布的时期内,因而仍表现出AQP4在星形胶质细胞上的多量表达。因此,进一步明确LRP后AQP4表达部分的变化对探讨LRP的神经保护作用十分重要。高表达的AQP4也可能通过促进星形胶质细胞的迁移,增加神经元的应激耐受性来发挥抗水肿作用。但是其具体机制有待进一步证实。此外,在预期结果中,我们推测AQP4在周围血管细胞膜上的表达增多,但是通过与CD31的共染只得到少量的共染表达。推测出现此结果的原因有:(1)1 h时间点AQP4的多量表达尚不明显,或正处于重新分布的过程中,因此不被检测,通过重新分布后,周围血管细胞内皮上的AQP4表达量逐渐增多,促进脑内水分子的清除,从而减轻后续的血管源性水肿的产生。(2)CD31作为一种反应血管内皮完整性的指标,其表达水平在缺血发生后是降低的[7],而LRP是否能够对CD31产生影响尚不明确。
综上,LRP很可能通过上调AQP4的表达来减轻脑水肿。RPC对脑缺血的保护作用明确,具有极大的临床应用潜质,只有深入全面得了解其机制,才能充分发挥它的临床应用价值。相信不久的将来,在RPC原理上建立的新技术能成为脑卒中的克星,造福全人类。
[1]Wei D,Ren C,Chen X,et al.The chronic protective effects of limb remote preconditioning and the underlying mechanisms involved in inflammatory factors in rat stroke[J].PLoS One,2012,7(2):30892.
[2]魏鼎泰,陈秋雁,吴富淋,等.肢体远端缺血预处理对抑制缺血性脑卒中的MRDWI研究[J].中风与神经疾病杂志,2012,8:691-694.
[3]Amiry-Moghaddam M,Otsuka T.An α-syntrophin-dependent pool of AQP4 in astroglial end-feet confers bidirectional water flow between blood and brain[J].PNAS,2003,100:2106 -2111.
[4]Sato S,Umenishi F,Inamasu G,et al.Expression of water channel mRNA following cerebral ischemia[J].Acta Neurochir Suppl,2001,76:239-241.
[5]Ke C,PoonWS,Ng HK,et al.Heterogeneous responses of aquaporin-4 in oedema formation in a replicated severe traumatic brain injury model in rats[J].Neurosci Lett,2001,301(1):21 -24.
[6]Kiening KL,Van Landeghem FK,Schreiber S,et al.Decreased hemispheric Aquaporin-4 is linked to evolving brain edema following controlled cortical impact injury in rats[J].Neurosci Lett,2002,324(2):105-108.
[7]Steiner E,Enzmann GU,Lin S,et al.Loss of astrocyte polarization upon transient focal brain ischemia as a possible mechanism to counteract early edema formation[J].Glia,2012,60:1646 -1659.
[8]Amiry-Moghaddam M,Otsuka T,Hurn PD,et al.An alpha-syntrophindependent pool of AQP4 in astroglial end-feet confers bidirectional water flow between blood and brain[J].Proc Natl Acad Sci USA,2003,100(4):2106-2111.
[9]Lu H,Sun SQ.A correlative study between AQP4 expression and the manifestation of DWI after the acute ischemic brain edema in rats[J].Chin Med J(Engl),2003,116(7):1063 -1069.
[10]Kleindienst A,Fazzina G,Amorini AM,et al.Modulation of AQP4 expression by the protein kinase C activator,phorbol myristate acetate,decreases ischemia-induced brain edema[J].Acta Neurochir Suppl,2006,96:393 -397.
[11]Cai SN,Zhu SM.The effects of ketamine pretreated on cerebral edema and AQP4 expression after transient focal cerebral ischemia/reperfusion in rats[J].Zhonghua Yi Xue Za Zhi,2010,90(23):1648-1651.
[12]Qi LL,Fang SH,Shi WZ,et al.CysLT2 receptor-mediated AQP4 upregulation is involved in ischemic-like injury through activation of ERK and p38 MAPK in rat astrocytes[J],Life Sci,2011,88(1 -2):50-56.
[13]Papadopoulos MC,Verkman AS.Aquaporin-4 and brain edema[J].Pediatr Nephrol,2007,22(6):778 - 784.
[14]Meng S,Qiao M,Lin L,et al.Correspondence of AQP4 expression and hypoxic-ischaemic brain oedema monitored by magnetic resonance imaging in the immature and juvenile rat[J].Neurosci,2004,19(8):2261-2269.
[15]Zeng XN,Xie LL,Liang R,et al.AQP4 knockout aggravates ischemia/reperfusion injury in mice[J].CNS Neurosci Ther,2012,18(5):388-394.
[16]Tang Z,Sun X,Huo G,et al.Protective effects of erythropoietin on astrocytic swelling after oxygen-glucose deprivation and reoxygenation:Mediation through AQP4 expression and MAPK pathway[J].Neuropharmacology,2012,67:8 -15.
[17]Nielsen S,Nagelhus EA,Amiry-Moghaddam M,et al.Specialized membrane domains for water transport in glial cells:high-resolution immunogold cytochemistry of aquaporin-4 in rat brain[J].J Neurosci,1997,17:171 -180.
[18]Rash JE,Yasumura T,Hudson CS,et al.:Direct immunogold labeling of aquaporin-4 in square arrays of astrocyte and ependymocyte plasma membranes in rat brain and spinal cord[J].Proc Natl Acad Sci USA,1998,95:11981 -11986.
[19]刘 静.AQP4与脑水肿[J].中国中医药咨询,2011,3(14):83-84.
