脑梗死后出血性转化患者血浆白细胞介素 1β、6、10 含量的变化
2014-08-11姜爱钟张建明
童 慧,洪 克, 姜爱钟,张建明
脑梗死出血性转化(hemorrhagic transformation,HT)是颇令临床医生担心的脑梗死的合并症。它既是脑梗死的自然转归过程之一,亦可出现于溶栓及抗凝等药物治疗之后。虽然研究表明大梗死、有占位效应的脑梗死、早期发现的密度改变、严重的神经功能缺损、高龄是出血性转化的危险因素[1],但出血性转化仍有很多未知的病理过程,难以预测。白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、白细胞介素10(IL-10)是脑梗死急性期炎症反应的主要炎性标志物,它们介导的炎症反应在脑缺血及再灌注时可造成继发性脑损伤。本研究主要观察脑梗死出血性转化患者外周血内IL-1β、IL-6、IL-10的变化,探讨脑梗死出血性转化与脑梗死后炎性反应之间的关系。
1 资料和方法
1.1 临床患者
对2010年1月~2013年1月在我科住院的脑梗死患者的病例资料进行回顾性分析:选取发病时间在1 d之内,经MRI证实为脑梗死,后在发病1 w或病情出现变化时复查头部CT呈现梗死区内高密度的脑梗死并发出血性转化的患者60例,按ECASS法分为HI-1型(梗死边缘小点状出血)15例,HI-2型(梗死区内片状无占位效应出血)15例,PT-1型(血肿小于梗死面积的30%,占位效应轻)15例,PT-2型(血肿大于梗死面积的30%,有明显占位效应)15例。按年龄、性别、神经功能缺损评分(NIHSS)、出血部位、治疗措施相匹配的原则选取无出血性转化的脑梗死患者作为对照组。分为:HI-1型对照组15例,HI-2型对照组15例,PT-1型对照组15例,PT-2型对照组15例。所有患者都根据病情有针对性地进行正规治疗[2]:如溶栓、抗血小板凝聚、降颅压等。所有患者治疗期间均无严重感染、无多器官损伤等并发症,未使用糖皮质激素等免疫增强或抑制剂,既往无免疫性疾病病史。
1.2 监测指标
所有患者在入院后2 d清晨空腹抽取静脉血4 ml放入经肝素抗凝的试管中,即刻以4000 r/min低温离心10 min,吸取血浆于-40℃存储备用。采用免疫酶联吸附法测定 IL-1β、IL-6、IL-10、S-100β 蛋白的浓度,IL-1β、IL-6、IL-10、S-100β 蛋白测定试剂盒由晶美生物技术有限公司提供。
1.3 统计方法
应用SPSS10.0软件包进行统计分析。均数比较采用方差分析,构成比用卡方检验。P<0.05作为显著性差异的标准。
2 结果
各组之间患者的性别构成比、年龄、梗死部位无显著性差异。虽然各组之间NIHSS评分(F=4.056,P=0.01),S-100β 蛋白浓度(F=2.057,P=0.05)有差异,相互比较显示HI-1组、HI-1对照组、HI-2组、HI-2对照组的NIHSS评分低于PT-2组及PT-2对照组,HI-1组、HI-1对照组、HI-2组患者S-100β蛋白浓度显著低于PT-2组,但出血转化组患者与相对应的对照组之间NIHSS评分、S-100β蛋白的浓度无明显差别。各组之间IL-1β(F=18.104,P=0.00)、IL-6(F=18.081,P=0.01)有差异,相互比较显示HI-2组、PT-1组、PT-2组患者发病初期IL-1β、IL-6浓均显著高于各自对照组,PT-1、2组患者IL-1β、IL-6浓度显著高于HI-1、HI-2组患者。而各组之间IL-10无明显差别(见表1)。
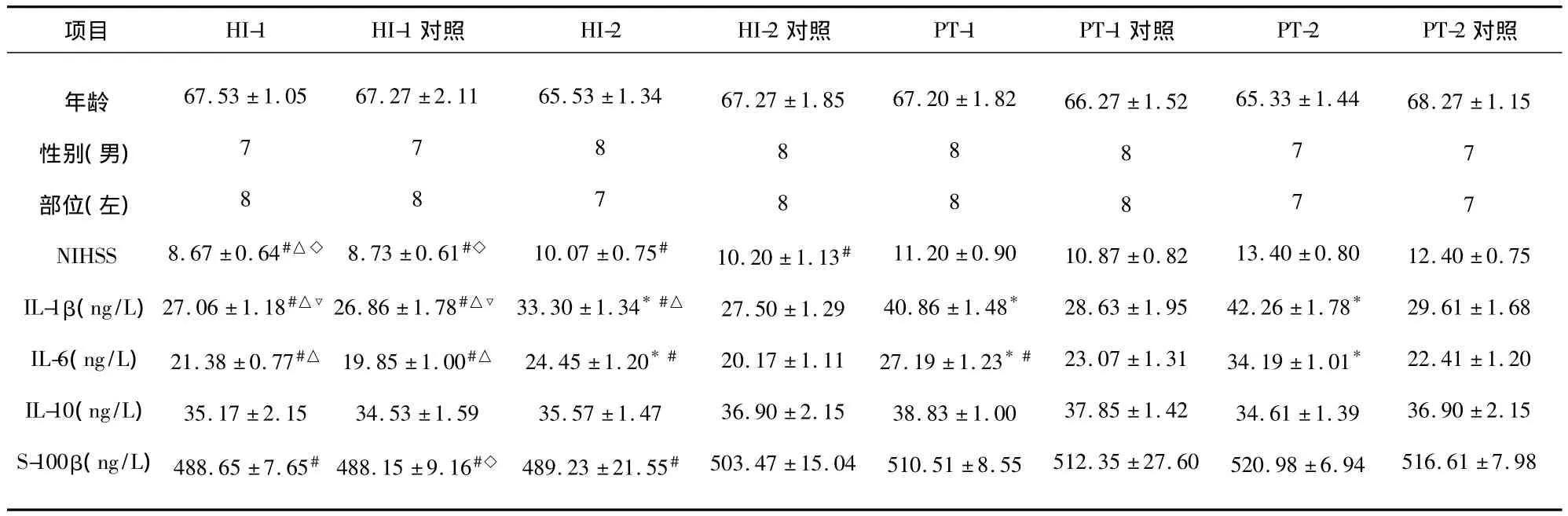
表1 出血性转化患者与对照组之间临床情况及血浆炎性因子浓度的比较)±SD)
3 讨论
虽然我们的结果再次证实了脑梗死后神经功能缺损程度的严重性与脑梗死后出血性转化的发病及出血的严重程度密切相关,但在NIHSS评分、S-100β蛋白无明显差别的两组之间相比,有出血转化的HI-2组、PT-1组、PT-2组的血清IL-1β、IL-6的水平分别显著高于非出血性转化HI-2对照组、PT-1对照组、PT-2对照组。S-100β蛋白是一种具有促神经生长的钙结合蛋白,由活化胶质细胞分泌,作为一种神经系统损伤的生化标志物,它是迄今为止最能反映脑损伤程度和预后的特异性蛋白[3],即在同样程度脑损伤的情况下,脑梗死急性期的高水平的促炎性细胞因子IL-1β、IL-6是脑梗死出血性转化发生的重要因素。
IL-1β、IL-6是脑缺血损伤后最早出现的促炎性细胞因子,IL-1β的主要作用是激活单核/巨噬细胞、中性粒细胞,增强它们的吞噬杀伤功能,促进它们释放炎性蛋白和炎症介质。IL-6除了与IL-1β有相似的作用以外,还能抑制IL-1β的合成,合适浓度的IL-6在中枢神经系统内被认为具有保护作用。但高水平的IL-1β、IL-6仍被公认认为是脑梗死预后不佳的独立危险因素[4,5]。考虑 IL-1β、IL-6 可能通过以下的途径影响脑梗死后出血性转化:首先在血液生化指标中,血清基质金属蛋白酶-9(MMP-9)的升高被认为是脑梗死出血性转化的重要预测因子[6]。IL-1β、IL-6能够激活血清基质金属蛋白酶(MMPs),而MMPs激活后可以降解血管壁的基底层,基底层的降解又与出血性转化有关。其次IL-1β、IL-6可直接诱导内皮细胞上调黏附因子的表达,促进白细胞黏附脑微血管,引起血管炎性反应,破坏血管壁内皮细胞之间的紧密连接及加重血脑屏障的损伤导致渗血和漏血[7]。另外IL-1β、IL-6既可以通过降低内皮对缩血管物质的反应性又可以通过使一氧化氮的合成和释放增加而致血管扩张造成梗死区的血流再灌注,但IL-1β、IL-6明显升高一般在在急性脑缺血后的6~24 h,此时梗死区血流增加只会造成缺血再灌注的损伤,甚至发生出血性转化。IL-10在免疫反应中起着抗炎症作用,是重要的保护性炎性因子。它可以抑制IL-1β、IL-6、MMP-9的合成,并可以抑制炎症细胞因子的迁移,具有神经保护作用,对脑梗死患者的预后有着积极的影响。我们观察到出血性转化组和非出血性转化的脑梗死组之间IL-10水平无明显差异,说明出血性转化组患者虽然IL-1β、IL-6明显增高,但 IL-10没有相应升高,不能对抗 IL-1β、IL-6的致炎作用。研究提示外源性IL-10可显著减少脑梗死或脑出血的面积[8],如果此时能外源性地给予IL-10,可能会减少脑梗死后出血性转化。
综上所述,脑梗死急性期的高水平的促炎性细胞因子IL-1β、IL-6是脑梗死出血性转化发生的重要因素。最近一项研究显示伴发感染的脑梗死出现PT型出血性转化的可能是不伴发感染的脑梗死患者的2.4倍[9],佐证颅内过高的促炎性细胞因子是脑梗死出血性转化发生的重要因素,急性期控制炎症反应可能会减少脑梗死出血性转化,改善患者的预后。
[1]叶 静,崔 颖,郭春生,等.脑梗死出血性转化相关危险因素的分析[J].中华脑血管病杂志,2008,(4):158-162.
[2]苏镇培,黄如训.急性脑梗死的临床分型、分期治疗[J].中国神经精神病杂志,1998,24:63 -64.
[3]周超宁,刘 宁.S-100β在神经系统疾病中的研究进展[J].医学综述,2011,17:3219 -3222.
[4]Huang J,Upadhyay UM,Tamargo RJ.Inflammation in stroke and focal cerebral ischemia[J].Surgical Neurology,2006,66:232 - 245.
[5]Denes A,Thornton P,Rolhwell NJ,et al.Inflammation and brain injury:Acute cerebral ischaemia,peripheral and central inflammation[J].Brain Behavior and Immunity,2010,24:708 -723.
[6]Montaner J,Molina C,Monasterio J,et al.Matrix metalloproteinase-9 ptetreatment level predicts intracranial hemorrhagic complications after thrombolysis in human stroke[J].Circulation,2003,107:598 - 603.
[7]McColl BW,Rothwell NJ,Allan SM.Systemic inflammation alters the kinotics of cerebrovascular tight junction disruption after experimental stroke in mice[J].J Neurosci,2008,28:9451 - 9462.
[8]王 栋,李哓红.白细胞介素10与动脉粥样硬化、脑血管病的关系[J].中国动脉硬化杂志,2009,17:249-253.
[9]Salat D,Delqado P,Alonso S,et al.Ischemic stroke outcome and early infection:its deleterious effect seems to operate also among tissue plasminogen activator-treated patients[J].Eur Neurol,2011,65:82 - 87.
