沉水植物茎叶微界面及其对水体氮循环影响研究进展
2014-08-10王文林韩睿明王国祥
王文林,刘 波,韩睿明,范 婤,王国祥,*
(1. 南京师范大学地理科学学院,江苏省环境演变与生态建设重点实验室, 南京 210023;2. 环境保护部 南京环境科学研究所, 南京 210042; 3.南通大学地理科学学院, 南通 226007)
沉水植物茎叶微界面及其对水体氮循环影响研究进展
王文林1,2,刘 波1,3,韩睿明1,范 婤1,王国祥1,*
(1. 南京师范大学地理科学学院,江苏省环境演变与生态建设重点实验室, 南京 210023;2. 环境保护部 南京环境科学研究所, 南京 210042; 3.南通大学地理科学学院, 南通 226007)
沉水植物茎叶表面常富集了水中各类物质,包括有机质、泥沙、菌胶团、藻类、微生物等,形成厚度不等的附着层,形成特殊的茎叶微界面,其具有特殊的氧化-还原异质环境,并能为氮素循环细菌提供有机质,是水中氨化、反硝化及厌氧氨氧化等脱氮行为的重要基础,因此,了解沉水植物茎叶微界面组分、微环境变化特征及其对氮循环的调控作用,对于正确认识和利用沉水植物的生态调控功能、改善水环境质量具有十分重要的意义。基于此,就沉水植物茎叶微界面物质组成、微环境特征及其对水体氮循环影响研究现状进行了归纳总结,并对今后的研究方向进行了简要展望。
沉水植物; 茎叶微界面; 物质组成;微环境特征;水体氮循环
地球表面与近地表存在着许多固、液和气相之间的微界面[1],微界面存在相互分异又密切联系的氧化-还原异质环境,其对土壤及水体氮素循环具有十分重要的影响[2- 3],就水生生态系统而言主要存在3个微界面[4]:水-沉积物、生物-沉积物(根际圈)、生物-水(如水生植物体表与水之间)。
水-沉积物微界面研究已经取得了长足进展,微界面内溶解氧(DO)、氧化还原电位(Eh)、酸碱度(pH)等剖面梯度变化的定量测定研究屡见报道[5-10]。研究表明,在水-沉积物界面,DO、Eh 及 pH 等因子时空变化较大,物质的迁移转化过程活跃,尤其是反硝化作用十分剧烈[11- 12]。而生物-沉积物界面主要集中于根际圈研究,张福锁等[13]指出根际概念最早系Hiltner于1904年提出,1989年Reddy[14]发现湿地植物根系附近的富氧-厌氧微环境控制了根-沉积物界面的硝化-反硝化过程,提出了根-沉积物界面的硝化-反硝化理论,并用同位素技术测定了水稻(Oryza.sativaL.)、梭鱼草(PontederiacordataL.)、灯芯草(JuncuseffususLinn.)的根际氮迁移转化过程,从而证实了这一理论,将根际研究从农作物拓展到湿地植物。由此影响氮素循环的湿地植物根际微界面环境也日益受到关注,已有研究结果表明根际微界面 DO、Eh 及 pH 值分布不仅受光照、光合作用强度[15- 16]等因素影响,存在明显的昼夜时间序列差异;还受植物生长阶段的影响,存在明显的季节性时间分布差异[17- 18]。
生物-水微界面广泛存在于水体中各种生物表面,而在浅水湖泊生态系统中,沉水植物与水的关系最为密切,占据着湖泊生态系统的关键界面,对湖泊生产力及生物地球化学循环具有重要的影响[19]。位于水面以下的沉水植物茎叶表面常富集了水中各类物质,包括有机质、泥沙、菌胶团、藻类、微生物等,形成厚度不等的附着层[20],形成了特殊的茎叶微界面[21]。茎叶微界面的出现不仅直接阻抑了植物茎叶与水之间的气体交换[22],而且其内富集的有机质分解耗氧[23- 24]容易导致茎叶表面成为耗氧厌氧区域。一些研究已经证实,沉水植物茎叶表面 DO 和 pH 值等因子的时空分布差异比较明显[25- 26],表明茎叶表面亦存在富氧-厌氧交替出现的氧化-还原微环境,同时还可为氮素循环细菌提供有机质[27- 29]。因此,了解沉水植物茎叶微界面环境变化特征及其对氮循环的调控作用,对于正确认识和利用沉水植物的生态调控功能、改善水环境质量具有十分重要的意义。基于此,本文就沉水植物茎叶微界面物质组成、微环境特征及其对水体氮循环影响研究现状进行了归纳总结,并对今后的研究方向进行了展望。
1 沉水植物茎叶微界面物质组成
1.1 微界面物质组成特征
曲久辉等对天然水体中主要颗粒物及其界面特征进行了总结(表1)[4],而理论上沉水植物茎叶微界面均可能含有矿物质、金属氢氧化物、腐殖质、纤维素、藻类、微生物、有机无机复合物等物质,它们在水体中的物理、化学和生物学特性往往是决定微界面体系特征的基本因素。
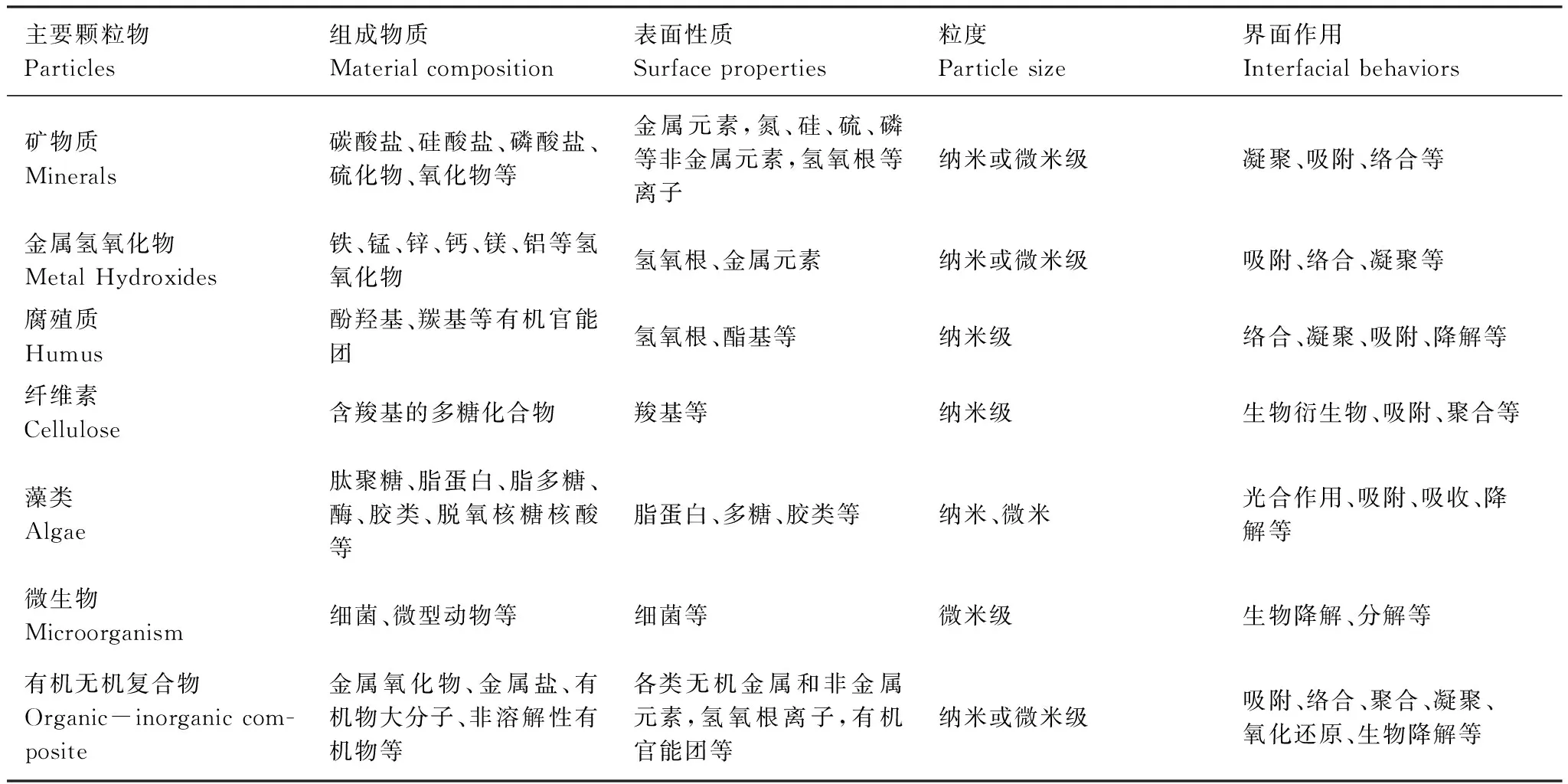
表1 天然水体中主要颗粒物及其界面特征
目前针对沉水植物茎叶附着藻类组成已有大量研究,但多从湖泊生态驱动机制的角度出发,集中于附着藻类组成及生物量等受沉水植物种类[30- 31]、生长阶段[32- 34]、水体营养盐负荷[35- 36]等因素影响方面。由文辉等[31]发现富营养化水体中附着藻类的生物量大小表现为黑藻 (Hydrillaverticillata) > 金鱼藻 (CeratophyllumdemersumL.) > 菹草 (Potamogetoncrispus) > 苦草 (Vallisnerianatans) > 马来眼子菜 (Potamogetonmalaianus);苏胜齐等[34]对菹草表面附植生物群落动态变化的研究发现,附生藻类的密度和生物量在菹草不同生长时期表现为:衰亡期 > 幼苗期 > 成熟期 > 生长期,并且不同叶龄沉水植物上附生藻类的群集时间也有长短之差,此外,沉水植物茎的不同部位附着藻类的分布也不同[33]。但是,也有学者认为附着藻类的组成与沉水植物关系不大,主要受水体环境制约[37- 38],在营养状态显著不同的湖泊中,附生藻类的物种数呈减少趋势而种群密度呈增大趋势[39]。
沉水植物茎叶表面同样也是微生物栖息的良好生境[40],沉水植物茎叶着生微生物也日益受到关注。Körner[41]用最大计数法分析了沉水植物表面和底泥表面硝化细菌和反硝化细菌差异,发现沉水植物表面硝化细菌数量大于底泥,而反硝化细菌则相反。Coci等[42]运用聚合酶链式反应(Polymerase chain reaction,PCR)技术对沉水植物表面、底泥表面和水面浮游植物表面的氨氧化细菌数量和活性进行了对比分析,发现沉水植物表面的氨氧化细菌无论在数量和活性上与其他两个载体上的无明显差异,并发现只有水力停留时间、总氮和总磷与氨氧化细菌潜在活性相关。此外,沉水植物附着菌类也存在时空分布差异。研究表明,叶片的附着菌类密度要小于茎部和叶柄处[43],同一叶片的不同部位菌群密度差异显著[44]、叶片越老菌群密度越大[44],不同植物之间差异明显[43- 44]。
综上,现有沉水植物茎叶微界面物质组分研究多集中于生物组分(着生藻类、微生物)特征,鲜见针对非生物组分特征的相关报道。
1.2 微界面形态结构及物质交互作用
沉水植物微界面的形态结构直接影响光照的传输、气体的交换及物质的输移。光通过附着层到达植物茎叶表面时会发生衰减,附着层越厚越复杂光衰减越多;光的衰减在一定条件下会限制沉水植物的光合作用速率,进而影响附着物微界面内的氧的时空分布,最终对植物生长和水-植物间的物质迁移与转化产生重要影响[45- 47];如厚度加大会增加水与植物表面间物质的传输距离和物质传递的阻力[25,48],研究证实沉水植物叶表附着层会阻抑游离态氧气(O2)、二氧化碳(CO2)和可溶性有机碳(DOC)等物质从水相向植物表面的迁移[48- 49],但其阻抑机制尚不清楚,这均源于缺乏对微界面形态结构的认识,而现有研究更多的浮于表象,如有学者观察到[50],富营养和贫营养湖泊中的附生藻类群落不仅组成结构有所差异,外部形态结构也显著不同,富营养湖泊通常有相对厚但松散附着、不稳定的附着层,而贫营养湖泊的附着层则相对紧凑而且稳定。Jones等[26]通过附着层内 DO 和 pH 产生波动的范围来表征其厚度,发现受植物茎叶表面附着物组成、植物种类、生长阶段等的影响,厚度从200 μm (大叶藻(Zosteramarina))至2300 μm (宣藻(Scytosiphonlomentaria))不等[25- 26]。
此外,由于微界面中存在多种性质和尺寸的颗粒物,其物理、化学或生物学等特性不同,因而也存在复杂的相互间的交互作用,其中不同性质颗粒物之间的碰撞、聚集、沉积、分解是最基本的交互作用过程[4, 51]。这一过程不仅依赖于颗粒物的大小、密度、紧密程度和强度等物理特性,而且与其表面化学性质有关[52]。目前尚未见有针对沉水植物茎叶微界面物质交互作用的相关报道。
2 沉水植物茎叶微界面环境特征
由于沉水植物茎叶微界面厚度往往不足几毫米[25- 26],其内部环境因子定量测定比较困难,随着微电极技术的发展,原位测定沉水植物茎叶微界面环境因子的微时空分布,真实反映茎叶微界面环境特征成为可能。已有沉水植物茎叶微界面环境因子研究主要针对 DO 和 pH 等。
2.1 微界面DO分布特征
沉水植物叶表面的溶解氧存在显著的时空分布特征。Sand-Jensen等[25]运用微电极技术对菹草、车前草(Littorellauniflora)、大叶藻、宣藻4种沉水植物叶表微界面 DO 变化进行了测定,发现越接近植物叶表 DO 浓度越高,且随着光照强度增强而升高,叶表微界面 DO 的空间分布差异明显;在白天,植物表面产生富氧环境,而夜间即使水体 DO 达到饱状态,叶表附着层内也会出现高度厌氧的环境,故叶表微界面存在昼夜交替的富氧-厌氧环境;研究还发现菹草叶表 DO 对光照响应速率还存在季节性差异,8月份快于6月份。另外,在相同的光照强度变化范围内,不同宿主植物微界面内 DO 变化幅度不同,菹草快于车前草,光合能力强的宿主植物变化幅度大,说明不同沉水植物叶表微界面 DO 变化程度受宿主植物自身的光合特性影响较大,可能是导致不同沉水植物分布区域水体 DO 的时空异质性的重要原因。在后续研究中,Sand-Jensen等[22]发现在微界面内光合作用强度有两个峰值,一个在微界面顶部,主要受附着藻类影响,一个出现在叶表,主要受叶片光合作用影响。
现有研究对附着生物与沉水植物形成的微界面中 DO 变化及机理做了一定的探讨,认为微界面内 DO 的变化主要是附着生物与宿主植物的光合作用共同决定的,微界面内物质的传输方式和速率与上覆水体的差异是形成 DO 特殊剖面的主要原因,但是附着层内的着生藻类和沉水植物的光合与呼吸作用对微界面氧变化的贡献还难于甄别。且上述研究都集中在水质相对较好的水体中,认为附着生物大部分是自养生物[25- 26],光合作用产生的O2多数被呼吸作用消耗,而在富营养化水体中氮、磷等营养物质丰富,有机质含量也较高,那么在沉水植物表面的附着生物量也会较高,有机质等耗氧物质会出现富集[29],耗氧物质的富集势必对微界面的 DO 变化产生影响,必将重塑 DO 的剖面分布规律和时间变化规律。目前关于富营养化水体中沉水植物茎叶微界面的 DO 研究还未见报道。
2.2 微界面pH值分布特征
沉水植物茎叶微界面内pH要高于周围水体的 pH 值[25- 26]。Sand-Jensen等[25]发现沉水植物茎叶微界面的 pH 值要高于周围水体的 pH 值,差值随附着层厚度增大而增加。Eaton[26]将人造叶片与伊乐藻(Elodeanuttallii)在实验室共同培养,利用微电极技术研究分析了人造叶片附着层的 pH 值空间分布,发现自微界面外侧向内至叶表 pH 值逐渐升高,在叶表处达到最高,且附着层越厚,pH 值增加越多,但是,他们并未实际测定沉水植物伊乐藻叶表微界面 pH 值的变化。根据模拟实验结果,认为附着生物光合作用及附着层对游离态 CO2的阻抑是导致 pH 值垂直分布差异的主要原因。此外,Jones等[26]还发现近叶表处 pH 值有所下降,但对下降的原因并没有做深入研究。现有研究仅对沉水植物茎叶微界面内 pH 值的空间分别作了简要探讨,尚未有针对pH的时间变化报道。
3 沉水植物茎叶微界面对氮循环的调控作用
在水中氮素负荷不断加剧的背景下,关于水生植物对氮调控的研究,学者们更关心水生植物对水体氮的去除效果。一般认为水生植物的吸收作用、加速颗粒物质沉降作用及被人为收割是水生植物除氮的主要途径[53- 55]。Weisner等[28]发现沉水植被茎叶附着层具有增强水体反硝化速率的作用,后有研究还发现在营养物质丰富的水体中,有沉水植物区域的硝化强度要比无沉水植物的区域高10倍,沉水植物茎叶茎叶附着层的反硝化作用与沉积物的反硝化作用相当[53,56],Körner[41]发现沉水植物表面有大量的硝化和反硝化细菌富集。沉水植物茎叶附着层形成的微界面硝化-反硝化作用作为水体中重要的自然脱氮机制逐渐引起学者的关注。
一般认为沉水植物与漂浮植物和挺水植物相比,其茎叶微界面为附着生物提供了更大的栖息地,同时沉水植被的分泌物和残体为微生物提供了必要的有机物质[28,57],微界面的光合-呼吸作用为硝化-反硝化细菌创造了富氧-缺氧条件[28,58]。目前关于沉水植物茎叶附着层氮素调控研究主要围绕在光照、水流、植物生长阶段等因素下硝化-反硝化速率方面。研究发现光合作用产生的 O2是反硝化反应的一个重要抑制因素[42],但有利于硝化反应。Eriksson[56]发现光照条件下 O2和硝酸根离子净富余,在黑暗条件下净消耗,说明光照条件下硝化强度明显高于黑暗条件,而反硝化只在呼吸作用明显的黑暗条件才出现。但是Sørensen等[59]发现在白天微界面内的反硝化也在进行,只是速率比夜间低2—3倍。在流动水体中,附着层内反硝化反应仅在低DO浓度时发生,而在静水条件下即使周围水体中DO达到饱和状态反硝化反应也能进行[57],主要是因为沉水植物及附着生物层呼吸作用耗氧较多造成表面缺氧导致。Palijan[60]等将不同枝龄金鱼藻放在同一水体坏境中培养,发现成熟枝段表面的净硝化活性有了明显增强,认为成熟枝段附着生物层生物量较大是促使硝化速率增大的主要原因,由此可以推断沉水植物的不同生长阶段由于自身生理特点和附着生物的差异,会导致微界面对氮的调控能力差异。
上述研究从尺度上看,多基于沉水植物个体或群落水平,鲜见微界面水平研究;从表征指标来看,只是通过周围水体环境中的无机氮的变化来反应植被对氮素调控的结果,尚未涉及到直接反映界面过程内氮形态的变化;从调控机制研究来看,缺乏微界面内微环境指标(DO、pH、Eh 等)的同步测定,只是通过水体的背景环境指标间接表征。因此,上述研究难以揭示沉水植物茎叶微界面的富氧-厌氧微环境对水体氮循环的调控机制。
4 研究展望
在富营养化水体中,沉水植物茎、叶表面的微界面是水中氨化、反硝化及厌氧氨氧化等脱氮行为机制的重要基础,这可能是在一些沉水植物茂盛的水体中,水质长期处于清澈优质状态,且沉水植物衰亡期并未出现明显的“二次污染”现象的重要原因之一[61]。沉水植物茎叶微界面组分复杂,目前研究多侧重于生物组分的特征描述,对各组分特别是非生物物质的作用,尤其是对茎叶微界面环境的影响缺乏系统深入研究。沉水植物微界面对水体氮循环的调控,尤其是反硝化脱氮作用是富营养化水体生态修复的重要生物化学过程[41]。目前的研究对于沉水植物微界面对水体氮循环调控结果有了初步的认识,认为沉水植物的微界面的存在可以促进水体的硝化-反硝化作用,在一定条件下反硝化速率可观。但是,并没有从微界面组成特征及其内部环境因子的角度深入揭示氮素形态迁移与转化的机制。
因此,开展针对沉水植物茎叶微界面组分特征、环境因子特征及氮形态转化主要过程的研究,可深入揭示沉水植物对富营养化水体氮素循环的调控机制,为富营养化水体氮素污染治理提供科学支撑。此外,针对污染物在环境微界面的转移转化机制与控制原理的研究,不仅要解决系统性问题,还必须解决方法学问题、过程认识问题和技术发展问题[4]。
(1)沉水植物茎叶微界面物质组成、结构特征及时空变化规律
重点发展基于原位取样的质谱技术,深入探索不同生长阶段沉水植物茎叶微界面物质组成及物质间化学反应动力学、反应速率、物质转化通道、物料平衡等问题,通过发展微界面形貌原位连续观测的显微技术,实现对沉水植物茎叶微界面过程中显微形貌变化的直接观察,揭示微界面附着层物质的时空变化规律及相互作用机制。
(2)沉水植物茎叶微界面主要环境因子及其富氧-厌氧微生境的时空变化特征
重点发展基于原位测定的微电极技术,测定典型沉水植物茎、叶微界面 DO、pH 值、Eh 等环境因子,分析微界面主要环境因子的时空变化特征,探讨沉水植物光合作用及呼吸作用强度及组织结构对茎、叶微界面主要环境因子的生理周期影响规律,揭示沉水植物茎叶微界面主要环境因子的影响机制。
(3)沉水植物茎叶微界面对富营养化水体氮素循环的调控机制
重点发展微量原位取样技术、微电极技术、同位素示踪技术等,测定不同沉水植物、不同生长阶段的沉水植物茎叶微界面铵态氮、硝酸盐氮、亚硝酸盐氮、氧化亚氮等指标,研究微界面组成、结构及主要环境因子变化对氨化、硝化及反硝化作用的影响,探讨微界面氨化、硝化及反硝化作用的时空分布特点及驱动机制,揭示沉水植物微界面对水体氮循环的影响及调控机制。
[1] Brown G E J, Foster A L, Ostergren J D. Mineral surfaces and bioavailability of heavy metals: A molecular-scale perspective. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(7): 3388- 3395.
[2] Fan C X, Wang C X. Environmental Geochemistry and Eutrophication of Lakes in the Middle and Lower Reaches of Yangtze River. Beijing: Science Press, 2007.
[3] Wu F C, Jin X C, Zhang R Y, Liao H Q, Wang S R, Jiang X, Wang L Y, Guo J Y, Li W, Zhao X L. Effects and significance of organic nitrogen and phosphorous in the lake aquatic environment. Journal Lake Science, 2010, 22(1): 1- 7.
[4] Qu J H, He H, Liu H J. Typical environmental micro-interfaces and its effect on environmental behaviors of pollutants. Acta Scientiae Circumstantiae, 2009, 29(1): 2- 10.
[5] Cai W J, Reimers C E. The development of pH and pCO2microelectrodes for studying the carbonate chemistry of pore waters near the sediment-water interface. Limnology and Oceanography, 1993, 38(8): 762- 773.
[6] David A, Steven E, Clare R. Dissolution of calcite in deep-sea sediments: pH and O2microelectrode results. Geochimica et Cosmochimica Acta, 1989, 53(11): 2831- 2845.
[7] Gundersen J K, Jørgensen B B. Microstructure of diffusive boundary layers and the oxygen uptake of the sea floor. Nature, 1990, 345(6276): 604- 607.
[8] Jørgensen B B, Marais D J D. The diffusive boundary layer of sediments: oxygen microgradients over a microbial mat. Limnology and Oceanography, 1990, 35(6): 1343- 1355.
[9] Lansard B, Rabouille C, Massias D. Variability in benthic oxygen fluxes during the winter-spring transition in coastal sediments: an estimation by in situ micro-electrodes and laboratory mini-electrodes. Oceanologica Acta, 2003, 26(3): 269- 279.
[10] Rasmussen H, Jørgensen B B. Microelectrode studies of seasonal oxygen uptake in a coastal sediment: role of molecular diffusion. Marine Ecology Progress Series, 1992, 81(3): 289- 303.
[11] Gardner W S, McCarthy M J. Nitrogen dynamics at the sediment-water interface in shallow, sub-tropical Florida Bay: why denitrification efficiency may decrease with increased eutrophication. Biogeochemistry, 2009, 95(2- 3): 185- 198.
[12] Strauss E A, Richardson W B, Cavanaugh J C, Bartsch L A, Kreiling R M, Standorf A J. Variability and regulation of denitrification in an Upper Mississippi River backwater. Journal of the North American Benthological Society, 2006, 25(3): 596- 606.
[13] Zhang F S, Shen J B, Feng G. Rhizosphere Ecology: Processes & Management. Beijing: China Agricultural University Press, 2009: 10- 11.
[14] Reddy K R, Patrick W H, Lindau J A C W. Nitrification-denitrification at the plant Root-sediment interface in wetlands. Limnology and Oceanography, 1989, 34(6): 1004- 1013.
[15] Waters I, Armstrong W, Thompson C J, Setter T L, Adkins S, Gibbs J, Greenway H. Diurnal changes in radial oxygen loss and ethanol metabolism in roots of submerged and non-submerged rice seedlings. New Phytologist, 1989, 113(4): 439- 451.
[16] Connell E L, Colmer T D, Walker D I. Radial oxygen loss from intact roots ofHalophilaovalisas a function of distance behind the root tip and shoot illumination. Aquatic Botany, 1999, 63(3- 4): 219- 228.
[17] Caffrey J M, Kemp W M. Seasonal and spatial patterns of oxygen production, respiration and root-rhizome release inPotamogetonperfoliatusL. andZosteramarinaL.. Aquatic Botany, 1991, 40(2): 109- 128.
[18] Inoue T M, Tsuchiya T. Interspecific differences in radial oxygen loss from the roots of threeTyphaspecies. Limnology, 2008, 9(3): 207- 211.
[19] Carpenter S R, Lodge D M. Effects of submersed macrophytes on ecosystem processes. Aquatic Botany, 1986, 26: 341- 370.
[20] Vis C, Hudon C, Carignan R. Influence of the vertical structure of macrophyte stands on epiphyte community metabolism. Canadian Journal of Fisheries and Aquatic Sciences, 2006, 63(5): 1014- 1026.
[21] Stevens C L, Hurd C L. Boundary-layers around bladed aquatic macrophytes. Hydrobiologia, 1997, 346(1): 119- 128.
[22] Sand-Jensen K, Revsbech N P. Photosynthesis and light adaptation in epiphyte-macrophyte associations measured by oxygen microelectrodes. Limnology and Oceanography, 1987, 32(2): 452- 457.
[23] McCormick P V, O′Dell M B, Shuford R B E, Backusa J G, Kennedyb W C. Periphyton responses to experimental phosphorus enrichment in a subtropical wetland. Aquatic Botany, 2001, 71(2): 119- 139.
[24] Pietro K C, Chimney M J, Steinman A D. Phosphorus removal by the Ceratophyllum/periphyton complex in a south Florida (USA) freshwater marsh. Ecological Engineering, 2006, 27(4): 290- 300.
[25] Sand-Jensen K, Revsbech N P, Barker Jørgensen B. Microprofiles of oxygen in epiphyte communities on submerged macrophytes. Marine Biology, 1985, 89(1): 55- 62.
[26] Jones J I, Eaton J W, Hardwick K. The influence of periphyton on boundary layer conditions: a pH microelectrode investigation. Aquatic Botany, 2000, 67(3): 191- 206.
[27] Liboriussen L, Jeppesen E. Structure, biomass, production and depth distribution of periphyton on artificial substratum in shallow lakes with contrasting nutrient concentrations. Freshwater Biology, 2006, 51(1): 95- 109.
[28] Weisner S E B, Eriksson P G, Granéli W, Leonardson L. Influence of macrophytes on nitrate removal in wetlands. Ambio, 1994, 23(6): 363- 366.
[29] Qin B Q, Song Y Z, Gao G. The function of periphyton during the transition between algal and macrophytic types in shallow eutrophic lake. Science in China Ser. C Life Sciences, 2006, 36(3): 283- 288.
[30] Pip E, Robinson G. A comparison of algal periphyton composition on eleven species of submerged macrophytes. Hydrobiological Bulletin, 1984, 18(2): 109- 118.
[31] You W H. The species composition and quantitative features of the periphytic algae communities in Dianshan Lake. Environmental Science, 1999, 20(5): 59- 62.
[32] Brönmark C. Interactions between epiphytes, macrophytes and freshwater snails: A review. Journal of Molluscan Studies, 1989, 55(2): 299- 311.
[33] Morin J O N, Kimball K D. Relationship of macrophyte-mediated changes in the water column to periphyton composition and abundance. Freshwater Biology, 1983, 13(5): 403- 414.
[34] Su S Q, Shen A L, Yao W Z. Species composition and quantitative features of perphytic algae communities onPotamogetoncrispus. Journal of Southwest Agricultural University, 2002, 24(3): 255- 258.
[35] Chen C, Yin D, Yu B, Zhu H. Effect of epiphytic algae on photosynthetic function ofPotamogetoncrispus. Journal of Freshwater Ecology, 2007, 22(3): 411- 420.
[36] Lin H J, Dai X X, Shao K T, Su H M, Lo W T, Hsieh H L, Fang L S, Hung J J. Trophic structure and functioning in a eutrophic and poorly flushed lagoon in southwestern Taiwan. Marine Environmental Research, 2006, 62(1): 61- 82.
[37] Blindow I. The composition and density of epiphyton on several species of submerged macrophytes: The neutral substrate hypothesis tested. Aquatic Botany, 1987, 29(2): 157- 168.
[38] Cejudo-Figueiras C,lvarez-Blanco I, Bécares E, Saúl B. Epiphytic diatoms and water quality in shallow lakes: the neutral substrate hypothesis revisited. Marine and Freshwater Research, 2010, 61(12): 1457- 1467.
[39] Yuan X F, Shi Y H, Wang X R. Temporal and spatial distributions of periphytic algae in Taihu Lake. Journal of Agro-Environment Science, 2006, 25(4): 1035- 1040.
[40] Coci M, Bodelier P L E, Laanbroek H J. Epiphyton as a niche for ammonia-oxidizing bacteria: detailed comparison with benthic and pelagic compartments in shallow freshwater lakes. Applied and Environmental Microbiology, 2008, 74(7): 1963- 1971.
[41] Körner S. Nitrifying and denitrifying bacteria in epiphytic communities of submerged macrophytes in a treated sewage channel. Acta Hydrochimica et Hydrobiologica, 1999, 27(1): 27- 31.
[42] Coci M, Nicol G W, Pilloni G N, Schmid M, Kamst-van Agterveld M P, Bodelier P L E, Laanbroek H J. Quantitative assessment of ammonia-oxidizing bacterial communities in the epiphyton of submerged macrophytes in shallow lakes. Applied and Environmental Microbiology, 2010, 76(6): 1813- 1821.
[43] Rimes C A, Goulder R. Temporal variation in density of epiphytic bacteria on submerged vegetation in a calcareous stream. Letters in Applied Microbiology, 1986, 3(1): 17- 21.
[44] Baker J H, Orr D R. Distribution of epiphytic bacteria on freshwater plants. Journal of Ecology, 1986, 74(1): 155- 165
[45] Black M A, Maberly S C, Spence D H N. Resistances to carbon dioxide fixation in four submerged freshwater macrophytes. New Phytologist, 1981, 89(4): 557- 568.
[46] Madsen T V, Sand-Jensen K. Photosynthetic carbon assimilation in aquatic macrophytes. Aquatic Botany, 1991, 41(1- 3): 5- 40.
[47] Smith F A, Walker N A. Photosynthesis by aquatic plants: effects of unstirred layers in relation to assimilation of CO2and HCO3-and to isotopic descrimination. New Phytologist, 1980, 86(3): 245- 259.
[48] Sand-Jensen K, Borg D, Jeppesen E. Biomass and oxygen dynamics of the epiphyte community in a Danish lowland stream. Freshwater Biology, 1989, 22(3): 431- 443.
[49] Demarty M, Prairie Y T. In situ dissolved organic carbon (DOC) release by submerged macrophyte-epiphyte communities in southern Quebec lakes. Canadian Journal of Fisheries and Aquatic Sciences, 2009, 66(9): 1522- 1531.
[50] Raeder U, Ruzicka J, Goos C. Characterization of the light attenuation by periphyton in lakes of different trophic state. Limnologica-Ecology and Management of Inland Waters, 2010, 40(1): 40- 46.
[51] Tang H X. Environmental nano-pollutants (ENP) and their micro-interfacial processes on the aquatic particles. Acta Scientiae Circumstantiae, 2003, 23(2): l46- 155.
[52] Liang L, Morgan J J. Chemical aspects of iron oxide coagulation in water, laboratory studies and implications for natural systems. Aquatic Sciences, 1990, 52(1): 32- 55.
[53] Eriksson P G, Weisner S E B. Nitrogen removal in a wastewater reservoir: the importance of denitrification by epiphytic biofilms on submersed vegetation. Journal of Environmental Quality, 1997, 26(3): 905- 910.
[54] Kreiling R, Richardson W B, Cavanaugh J C, Bartsch L A. Summer nitrate uptake and denitrification in an upper Mississippi River backwater lake: the role of rooted aquatic vegetation. Biogeochemistry, 2011, 104(1- 3): 309- 324.
[55] McKellar H N, Tufford D L, Alford M C, Saroprayogi P, Kelley B J, Morris J T. Tidal nitrogen exchanges across a freshwater wetland succession gradient in the upper Cooper River, South Carolina. Estuaries and Coasts, 2007, 30(6): 989- 1006.
[56] Eriksson G P, Weisner S E B. An experimental study on effects of submersed macrophytes on nitrification and denitrification in ammonium-rich aquatic systems. Limnology and Oceanography, 1999, 44(8): 1993- 1999.
[57] Eriksson P. Interaction effects of flow velocity and oxygen metabolism on nitrification and denitrification in biofilms on submersed macrophytes. Biogeochemistry, 2001, 55(1): 29- 44.
[58] Toet S, Huibers L H F A, Van Logtestijn R S P, Verhoeven J T A. Denitrification in the periphyton associated with plant shoots and in the sediment of a wetland system supplied with sewage treatment plant effluent. Hydrobiologia, 2003, 501(1- 3): 29- 44.
[59] Sørensen J, Jørgensen T, Brandt S. Denitrification in stream epilithon: Seasonal variation in Gelbk and Rabis Bk, Denmark. FEMS Microbiology Letters, 1988, 53(6): 345- 353.
[60] Palijan G, Fuks D, Vidakovic J. Spatial and temporal distribution of net nitrite and nitrate production on submersed macrophyteCeratophyllumDemersumL.. Fresenius Environmental Bulletin, 2009, 18(1): 64- 69.
[61] Ge X G, Wang G X, Li Z G. Effects ofEichhorniacrassipesremains on the organic pollution in urban riverway. Journal of Anhui Agricultural Sciences, 2010, 38(10): 5287- 5288, 5291- 5291.
参考文献:
[2] 范成新, 王春霞. 长江中下游湖泊环境地球化学与富营养化. 北京: 科学出版社, 2007.
[3] 吴丰昌, 金相灿, 张润宇, 廖海清, 王圣瑞, 姜霞, 王立英, 郭建阳, 黎文, 赵晓丽. 论有机氮磷在湖泊水环境中的作用和重要性. 湖泊科学, 2010, 22(1): 1- 7.
[4] 曲久辉, 贺泓, 刘会娟. 典型环境微界面及其对污染物环境行为的影响. 环境科学学报, 2009, 29(1): 2- 10.
[13] 张福锁, 申建波, 冯固. 根际生态学——过程与调控. 北京: 中国农业大学出版社, 2009: 10- 11.
[29] 秦伯强, 宋玉芝, 高光. 附着生物在浅水富营养化湖泊藻-草型生态系统转化过程中的作用. 中国科学C辑: 生命科学, 2006, 36(3): 283- 288.
[31] 由文辉. 淀山湖着生藻类群落结构与数量特征. 环境科学, 1999, 20(5): 59- 62.
[34] 苏胜齐, 沈盎绿, 姚维志. 菹草着生藻类的群落结构与数量特征初步研究. 西南农业大学学报, 2002, 24(3): 255- 258.
[39] 袁信芳, 施华宏, 王晓蓉. 太湖着生藻类的时空分布特征. 农业环境科学学报, 2006, 25(4): 1035- 1040.
[51] 汤鸿霄. 环境纳米污染物与微界面水质过程. 环境科学学报, 2003, 23(2): 146- 155.
[61] 葛绪广, 王国祥, 李振国. 凤眼莲残体对城市河道有机物污染的影响. 安徽农业科学, 2010, 38(10): 5287- 5288, 5291- 5291.
Research advancements and perspectives on leaf and stem micro-interfaces in submerged macrophytes and its effect on water nitrogen cycling
WANG Wenlin1,2, LIU Bo1,3, HAN Ruiming1, FAN Zhou1, WANG Guoxiang1,*
1JiangsuKeyLaboratoryofEnvironmentalChangeandEcologicalConstruction,CollegeofGeographicalScience,NanjingNormalUniversity,Nanjing210023,China2NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtection,Nanjing210042,China3CollegeofGeographicalScience,NantongUniversity,Nantong226007,China
Various kinds of substances in water, including organic matter, silt, zoogloea, algae, microorganisms etc., often cumulate on the leaf and stem surface in submerged macrophytes. A micro-interface is therefore established which varies in its composition, structure and thickness according to the actual environmental properties. It induces specific heterogeneous oxidation-reduction condition and provides organic material for nitrogen-cycle bacteria thus plays an important role in micro-interfacial processes such as ammonification, denitrification and anammox. The composition of this micro-interface, its responses to micro-environmental changes and functions in regulating nitrogen cycling constitute the fundamental horizon for better understanding the feature of submerged macrophytes in water management and ecological regulation. The present paper summarizes the research advancements on leaf and stem micro-interface in submerged macrophytes and its effect on water nitrogen cycling. The substance composition and micro-environmental property of the micro-interface are identified and reviewed respectively. Perspectives on future research are raised.
Because of the compositional complexity in the leaf and stem micro-interface, recent studies have been mainly focused on the characterization of biotic components for example alga and microbe in submerged macrophytes. Much less information is available concerning the function of a certain component, especially that of the abiotic matters and that their effects on the micro-environmental properties in this micro-interface.
Thanks to the development of microelectrode technique, in situ measurement of micro-environmental factors in the leaf and stem micro-interface and their spatial and temporal changes becomes feasible recently. However, current studies are much centered on the non-eutrophicated freshwater in which the major proportional periphyton is considered as autotrophic and the photosynthesis-sourced oxygen is to be consumed by respiration processes. The actual condition in eutrophicated waters is characterized by the abundance of oxygen-depleting substances and their accumulation on the leaf and stem surface of submerged macrophytes greatly changes the environmental properties in the micro-interface. Reports on the fluctuation of such micro-environmental properties in eutrophicated waters are still largely missing.
The modulation of aquatic nitrogen cycling, specifically the denitrification by microbes in the micro-interface of submerged macrophytes, is the key biogeochemical process in ecological remediation of eutrophicated waters with high level of nitrogen nutrition. It has been proven that the existence of periphytic layers on the leaf and stem of submerge macrophytes could facilitate the aquatic nitrification-denitrification processes. The denitrification efficiency is apparently intensive in certain conditions. Nevertheless, these studies are mainly upon individual submerged plant or at the level of community as maximum, and in most cases estimating the nitrogen modulation according to the overall level of aquatic inorganic nitrogen, rather than the actual substance composition and inner environmental factors of the micro-interface that directly alter the nitrogen transportation and transformation.
To further elucidate the secrets of leaf and stem micro-interface, studies are needed on the spatial and temporal variations in substance composition, structural characteristics and oxic-anoxic micro-inhabitants. The modulation mechanism of this micro-interface on the biogeochemical cycling of nitrogen in eutrophicated waters are fundamentally required.
submerged macrophyte; leaf and stem micro-interface; substantial composition; micro-environmental property; water nitrogen cycling
国家自然科学基金 (41173078); 科技部国际合作重大项目 (2010DFB33960); 环保公益性行业科研专项 (201309035); 国家水体污染控制与治理科技重大专项 (2012ZX07506-007, 2014ZX0710- 012)
2013- 08- 15;
2014- 06- 06
10.5846/stxb201308152085
*通讯作者Corresponding author.E-mail: wangguoxiang@njnu.edu.cn
王文林,刘波,韩睿明,范婤,王国祥.沉水植物茎叶微界面及其对水体氮循环影响研究进展.生态学报,2014,34(22):6409- 6416.
Wang W L, Liu B, Han R M, Fan Z, Wang G X.Research advancements and perspectives on leaf and stem micro-interfaces in submerged macrophytes and its effect on water nitrogen cycling.Acta Ecologica Sinica,2014,34(22):6409- 6416.
