沙尘胁迫对阿月浑子光合作用及叶绿素荧光特性的影响
2014-08-10帕提古力麦麦提巴特尔巴克海利力库尔班
帕提古力·麦麦提,巴特尔·巴克,*,海利力·库尔班
(1. 新疆农业大学草业与环境科学学院, 乌鲁木齐 830052; 2. 新疆农业大学林业与园艺学院, 乌鲁木齐 830052)
沙尘胁迫对阿月浑子光合作用及叶绿素荧光特性的影响
帕提古力·麦麦提1,巴特尔·巴克1,*,海利力·库尔班2
(1. 新疆农业大学草业与环境科学学院, 乌鲁木齐 830052; 2. 新疆农业大学林业与园艺学院, 乌鲁木齐 830052)
为了探讨长期沙尘胁迫下阿月浑子叶片光合性能的变化机制,以室内盆栽阿月浑子为材料,对叶片进行覆盖厚度为2 mg/cm2(轻度),9 mg/cm2(重度)的沙尘处理,无沙尘覆盖为对照,并分别在处理后第7 天、14 天、28 天和42 天,测定叶片光合CO2同化速率,叶绿素含量以及叶绿素荧光特性等参数。结果表明,阿月浑子叶片的净光合速率(Pn)和气孔导度(Gs)随沙尘处理时间延长而下降,重度沙尘处理下Pn和Gs下降幅度比轻度大,胞间CO2浓度(Ci)处理前期增加而后期下降,重度沙尘处理下Ci增幅比轻度小;叶绿素a(Chl-a)、叶绿素b(Chl-b)和总叶绿素含量均随处理时间的延长而下降,在重度沙尘处理下下降幅度比轻度沙尘处理大,Chl-a的下降速率大于Chl-b,叶绿素a 和b的比值(Chl-a/Chl-b)在重度沙尘处理下逐渐下降,而在轻度沙尘处理下呈升-降-升趋势;PSⅡ最大光化学效率(Fv/Fm)不同程度下降,在重度沙尘处理下下降幅度比轻度沙尘处理大;轻度沙尘覆盖下实际光化学效率(ΦPSⅡ)及非环式电子传递效率(ETR)在处理第42天显著下降,而重度覆盖处理先急剧下降,后期逐渐恢复;非光化学荧光猝灭(NPQ)在轻度胁迫下先下降而后逐步上升,在重度处理下则在处理前期就迅速上升。从而得出结论,阿月浑子轻度沙尘胁迫条件下前期其光合作用非气孔限制贡献率大于气孔限制,随胁迫时间气孔限制逐渐占优势,并且随处理时间的延长其吸收的光能用于保护性耗散量逐渐增加,使其光合CO2同化效率下降。
阿月浑子;沙尘胁迫;光合特性;叶绿素荧光特性
在我国沙尘天气危害最严重的是新疆塔里木盆地及其周围地区,在春季和夏季沙尘天数居多[1]。由于春、夏季正好是当地作物、果树及蔬菜生长及成熟旺季,给当地农业生产带来了严重的威胁和经济损失。沙尘可引起果树叶片表面物理和化学伤害[2]、通过遮蔽减弱太阳辐射[3]、影响呼吸作用[4],叶片光合作用等生理生态特性[5]。因此,研究沙尘颗粒物对植物的危害,寻求减灾方法,越来越成为科学工作者研究的重心,是亟待研究的重要的科学问题之一。目前很多研究者发现,沙尘覆盖能够降低植物叶片的蒸腾作用[6]。Hirano的研究表明沙尘覆盖能促进植物叶片的蒸腾作用[7],并认为叶片温度升高会提高胞间水蒸汽压,使得细胞间隙和外界的水蒸汽压产生差异,进而促进植物叶片的蒸腾速率。陈雄文[5]研究了北京地区22种常见绿化植物在短时间(2 h)的沙尘处理后叶片生理指标的变化,结果表明植物叶片的光合作用普遍受到抑制,其中5种植物的净光合速率降低超过35%。Sharifi的研究表明,蒙尘覆盖抑制了蒸腾速率的正常进行,导致叶片的温度升高[8],使叶片细胞受到损伤,叶绿素含量降低,这些因素可能导致植物叶片的光合能力下降。
最近研究结果表明,水泥粉尘对植物叶片生理代谢有负面影响[9],如降低叶绿素含量,叶绿素a与叶绿素b的比值也下降,导致光合作用、呼吸作用、气孔导度和产量均下降,叶面温度上升。国外研究者Naidoo和Chirkoot研究了长期灰尘覆盖对海榄雌叶片PSⅡ的影响,发现叶片PSⅡ的量子产量下降约21%、非环式电子传递速率降低58%左右,同时叶片光合速率也大幅度降低[10]。在国内,对城市公路沿线多种园林植物叶面滞尘能力及其滞尘机理方面进行了研究[3,11- 14]。而迄今的研究大多是探讨短期尘污染处理对植物的影响,对长期尘污染胁迫下植物生理生态特性,尤其是长时间沙尘覆盖影响果树光合生理方面的研究报道罕见。因此,本文以沙尘天气多发区域的喀什特有果树阿月浑子(PistaciaveraL.)为材料,研究长期受沙尘覆盖后对其叶片光合特性、叶绿素含量以及叶绿素荧光等光合生理生态指标的影响,试图为进一步揭示沙尘危害阿月浑子的生理生态机理提供参考。
1 材料与方法
1.1 试验地概况和试验材料
试验点位于乌鲁木齐市新疆农业大学网室(43°48′N,87°34′E),地理位置位于新疆北部,地处天山北麓、准噶尔盆地南缘。海拔高度848 m,四季温度的变化较大,昼夜温差明显,年平均温度7.3 ℃,年平均降水236 mm,年平均日照2775 h,无霜期为105—168 d,春秋两季较短,冬夏两季较长,土壤有机质丰富,土壤略碱性。
试验材料阿月浑子(PistaciaveraL.)商品名称为“开心果”,维吾尔语称“皮斯坦”,系漆树科黄连木属植物。我国新疆是唯一的阿月浑子栽培区,栽培历史约70余年,集中分布地区为疏附县、莎车县和喀什市[15]。
1.2 试验方法
1.2.1 试验苗木准备
试验苗木于2012年3月至6月在新疆农业大学网室采用新疆本土阿月浑子品种种子盆栽播种栽培获得。盆栽土壤培土方案比例,较肥沃土壤∶洗净的河沙∶羊粪=6∶2∶1。阿月浑子种子先在高为10 cm,直径为15 cm的小花盆播种。5月上旬,苗木转栽到高为45 cm,直径为38 cm的大花盆内。
1.2.2 沙尘覆盖处理
以无沙尘覆盖为对照, 设计2 mg/cm2(轻度覆沙)和9 mg/cm2(重度覆沙)两种滞尘量(沙尘覆盖厚度根据1a的野外测定叶片滞尘量变化幅度来确定)试验,每种滞尘量处理设有沙尘覆盖7、14、28 d和42 d 的处理,共设8种处理和1个对照(二因素正交试验),每个处理3个花盆,每个花盆选择中上层3个叶片进行覆沙。植物叶片进行扫描并用MapGis 6.7图形处理软件,分别计算出每个叶片的面积,根据叶面积计算出叶片滞尘量;根据滞尘量称取沙尘均匀洒在叶片表面,待达到预定处理日期时对各项指标进行测定。
1.2.3 光合速率日变化和光合响应曲线的测定
2012年8月18日(晴天),采用Li 6400光合仪(LI-COR, Lincoln, USA),用自然光测定阿月浑子健康叶片的净光合速率(Pn, net photosynthetic rate)日变化,测定时间为当地时间6:00开始18:30结束,每30min测定1次,重复3次。
光合响应曲线测定时间为2012年8月19日7:00—9:00,采用Li 6400红蓝光源,空气流速为0.5 L/min,控制叶温在26—28 ℃之间,相对湿度60%左右,CO2浓度为365 μmol/mol。光强设定在0—2800 μmol m-2s-1之内,从2800 μmol m-2s-1光强开始测定,依次降为2800—0 μmol m-2s-1。
光合响应曲线的非直角双曲线模型理论公式如下[16]:
式中,Pn为净光合速率;α为初始量子效率;PPFD为叶室内光合有效辐射;Pmax是最大净光合速率;k为曲率;Rd是在光合作用时暗呼吸速率。
1.2.4 叶片光合参数测定
光合参数测定日期为2012年8月19日(晴天)上午。先将长时间沙尘覆盖处理叶片表面上的沙尘用清水冲洗干净,在太阳光下晒干(大概15 min),然后采用Li-6400光合仪,用自然光照射下进行测测定,测定项目包括叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)等。
1.2.5 叶绿素荧光参数的测定
2012年8月19日上午开始采用英国汉莎公司生产FM- 2便携式荧光仪(Hansatech Instruments Ltd, King′s Lynn, UK)测定长时间沙尘覆盖处理的阿月浑子叶片叶绿素荧光参数。取暗适应叶片,测定初始50 μs荧光(F0)和最大荧光(Fm)。当叶片在600 μmol m-2s-1的光强下光合作用处于稳态时,测定光适应下的最大荧光Fm′和暗适应后照光t时间时的荧光(Ft)。测定Fm′时给叶片照以0.8 s的饱和闪光2400 μmol m-2s-1。测定指标包括F0,Fm,并计算可变荧光(Fv),PSⅡ最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(ΦPSⅡ)和非光化学猝灭系数(NPQ),非环式电子传递速率(ETR),计算公式为:
ΦPSⅡ=(Fm′-Ft)/Fm′
ETR=ΦPSⅡ×PPFD×(0.5)
Fv/Fm=(Fm-F0) /Fm
NPQ =Fm/Fm′-1
1.2.6 叶绿素含量的测定
采用分光光度法测定叶绿素含量,参照李合生等的方法[17]。沙尘处理同一叶片位的新鲜叶擦净后各称取0.3 g,剪粹后用2—3 mL 95%乙醇,研成均浆,研玻璃棒把提取液倒入漏斗中,过滤到25 mL棕色容量瓶中,用滴管吸取乙醇,将过滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至25 mL,摇匀。把叶绿体色素提取液倒入比色杯内。以95%乙醇为空白,在波长665 nm,649 nm下测定吸光度。
各种叶绿体色素的含量(mg/g)=(色素浓度(C)×提取液体积×稀释倍数)/鲜样品质量,即:
Chl-a = (13.95A665- 6.88A649) ×V/ (1000×W)
Chl-b= (24.96A649- 7.32A665) ×V/ (1000×W)
式中,Chl-a(chlorophyll-a)为叶绿素a含量,Chl-b (chlorophyll-b)为叶绿素b含量,为V为提取液体积,W为鲜样品质量。
1.2.7 数据分析与统计方法
实验结果应用SPSS 16.0统计软件对不同覆盖厚度和时间下叶片光合生理指标进行分析,采用单因子方差分析法(One-Way ANOVA)方差分析(P<0.05),用LSD法对各参数平均数进行显著性检验和多重比较。利用Excel 2003做数据整理并绘图,其中光合响应曲线的非直角双曲线模拟图用SigmaPlot 12.5软件绘图。
2 结果与分析
2.1 光合有效辐射和光合速率日变化
由图1可以看出,阿月浑子叶片的光合日变化呈双峰曲线。当地时间6:00—9:00时急剧上升,至9:00时第1次高峰曲线达最大Pn值为23 μmol CO2m-2s-1,9:00—10:00时呈时缓慢下降趋势,10:00—13:00平稳,13:00—15:00时略有回升,至15:30时出现次高峰,16:00—18:00时迅速降至最低。Pn的变化在6:00—9:00的时和13:00—15:00时与光强的变化规律相一致;在9:00—12:00时呈相反变化,说明其光合作用存在“午休”现象[18],可能是“光抑制”的结果。早上和晚上太阳出来之前和落下以后Pn值为负值,7:00开始一直呈上升趋势,9:00最大, 10:00—12:00时光合速率为9—13 μmol CO2m-2s-1,下午的高峰值比上午的高峰值低。
2.2 叶片光合响应曲线特征
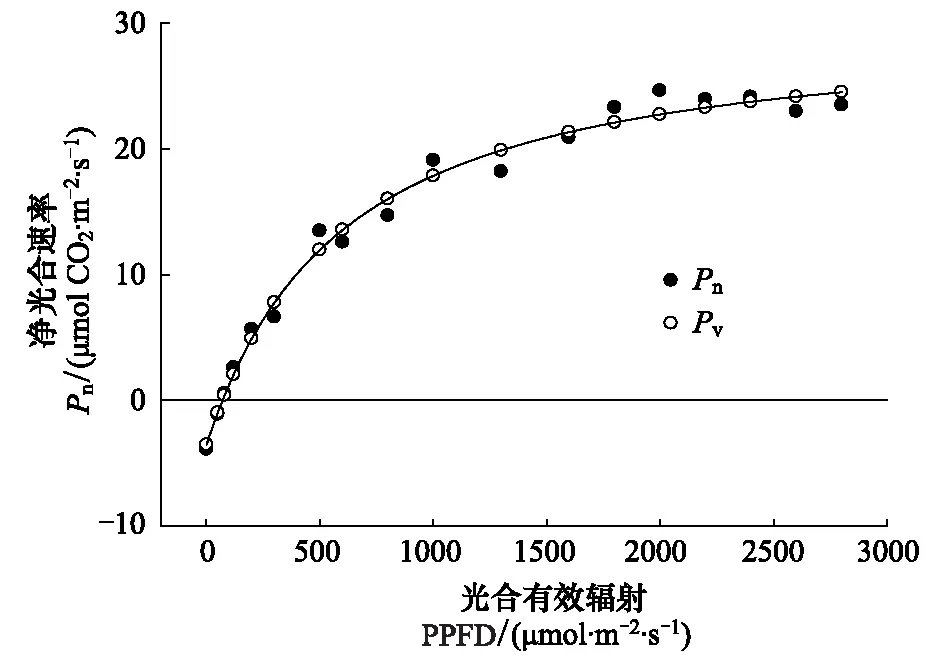
图2 阿月浑子叶片光合响应曲线的非直角双曲线模型拟合结果Fig.2 Matching of the light-response curve of Pistacia vera L. leaves to a non-rectangular hyperbola
光合作用光响应曲线,当光合有效辐射(PPFD)为0 μmol m-2s-1时,Pn为-4.6 μmol CO2m-2s-1,这表示植物的呼吸;当PPFD为65 μmol m-2s-1时Pn为0,表明该植物光补偿点(LCP)为65 μmol m-2s-1(图2);PPFD在光补偿点以上其Pn随PPFD逐渐上升,当PPFD达到1600 μmol m-2s-1时Pn最初达到峰值,其光饱和点(LSP)约在1600 μmol m-2s-1。光响应曲线用非直角双曲线模型进行拟合后,Pn与其预测值(Pv)之间有高度相关性(R2=0.993)(图2)[16,19]。
经SPSS软件计算光响应曲线的非直角双曲线模型参数k、Pmax、α、Rd分别为0.06、34.768、0.082、-3.769 μmol CO2m-2s-1,拟合曲线R2=0.988。
2.3 长时间沙尘处理对叶片Pn、Gs、Ci的影响
试验结果表明,阿月浑子叶表覆盖沙尘以后,叶片Pn呈明显下降趋势(图3)。沙尘覆盖时间7 d时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的Pn值分别为19.46 μmol CO2m-2s-1和17.08 μmol CO2m-2s-1,比对照下降10%和20%;沙尘覆盖时间42 d时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的Pn值分别为15.57 μmol CO2m-2s-1和6.1 μmol CO2m-2s-1,比对照分别下降30%和70%;14 d和28 d的Pn值介于7 d和42 d之间,Pn值随着沙尘覆盖时间的延长而下降(图3),说明叶片沙尘覆盖厚度越厚、沙尘覆盖时间越长叶片Pn值越低。
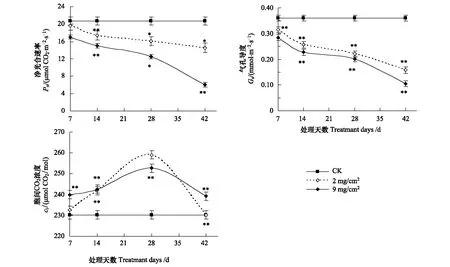
图3 不同沙尘处理天数对叶片Pn、Gs、Ci的影响Fig.3 Pn, Gs and Ci at different treatment days沙尘覆盖厚度分别为2 mg/cm2, 9 mg/cm2;*表示差异达显著水平(P<0. 05),**表示差异达极显著水平(P<0. 01)
沙尘处理后,叶片的Gs普遍受到抑制(图3)。沙尘覆盖时间7 d时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的叶片Gs值分别0.315 mmol m-2s-1和0.285 mmol m-2s-1,比对照相比分别下降10%和20%;14 d 时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的Gs值分别0.257 mmol m-2s-1和0.227 mmol m-2s-1,与对照相比下降32%;处理28 d时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的Gs值分别0.220 mmol m-2s-1和0.202 mmol m-2s-1,比对照分别下降38%和43%;在沙尘处理42 d时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的叶片的Gs值分别0.158 mmol m-2s-1和0.105 mmol m-2s-1,比对照分别下降55%和70%(图3)。气孔是水汽和CO2进出的门户,是连接生态系统碳循环和水循环的结合点。导致叶片Gs下降原因可能是沙尘微粒堵塞叶片表面气孔,影响气体交换,加上沙尘减少到达叶片表面的太阳光,引起气孔部分关闭,使Gs下降。在本试验中,叶片蒸腾速率与Gs的变化趋势相似(蒸腾速率数据没有显示)。本次试验结果显示,净光合速率与气孔导度之间有呈对数相关性。轻度沙尘量和重度沙尘量处理叶片的Gs和Pn的相关性关系分别为:y=21.442e-0.0973x(R2=0.9951) 和y=26.763e-0.3268x(R2=0.8441)。
叶片长期沙尘覆盖处理后,在沙尘覆盖厚度2 mg/cm2和9 mg/cm2处理下Ci值均呈“凸”型(图3)。沙尘覆盖时间7 d时,沙尘覆盖厚度2 mg/cm2叶片的Ci值与对照相比没有明显差异,但沙尘覆盖厚度9 mg/cm2的Ci值比对照增加4%;处理14 d时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的Ci值之间没有显著差异,但与对照的Ci值显著高;处理28 d时,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的Ci值与对照相比分别增加12%和8%;在沙尘处理42 d时,沙尘覆盖厚度2 mg/cm2叶片的Ci值与对照没有显著差异,而9 mg/cm2的值比对照高4%(图3)。
2.4 长时间沙尘覆盖后叶片叶绿素a、b含量和a/b值变化特性
沙尘对叶片光合作用色素的影响也表现在对植物叶绿素含量和叶绿素a/b比值的变化。阿月浑子叶片在不同覆盖厚度沙尘处理下其总叶绿素、叶绿素a(Chl-a)及叶绿素b(Chl-b)含量均随时间的延长呈下降趋势(图4)。Chl-a和Chl-b的含量在沙尘处理7 d时已开始下降,沙尘覆盖厚度2 mg/cm2时Chl-a和Chl-b的含量分别比其对照下降1%和4%,在9 mg/cm2处理下比对照低18%和11%;在沙尘处理第42天时,沙尘覆盖厚度2 mg/cm2时Chl-a和Chl-b的含量分别比对照下降25%和27%,在9 mg/cm2处理下分别比对照低44%和32%。在沙尘2 mg/cm2处理和其对照叶绿素 a/b 值在不同时间之间没有显著差异,而在沙尘9 mg/cm2处理条件下叶绿素a/b值第28 天之外均显著下降,表明在沙尘9 mg/cm2处理条件下其Chl-a含量下降速率大于Chl-b。总叶绿素含量 (Chl)随处理时间的延长,在对照与处理以及不同处理之间的差距逐次增加(图4)。

图4 沙尘覆盖对阿月浑子叶片叶绿素a、b、叶绿素a/b和总叶绿素含量的影响Fig.4 Effects of dust on leaf Chl-a, Chl-b, Chl-a/Chl-b and total Chl content图中不同字母表示差异达显著水平(P<0. 05)
2.5 长时间沙尘处理对叶片荧光参数的影响
由图5可以看出,在处理期间对照叶片PSⅡ最大光化学效率(Fv/Fm)没发生变化,沙尘覆盖厚度2 mg/cm2和9 mg/cm2的Fv/Fm值均下降,随处理时间的延长其下降幅度逐渐增加,在处理之间相比重度胁迫显著大于轻度胁迫值,处理第42天重度胁迫Fv/Fm值略低于轻度胁迫,但两者之间没有显著统计差异。在处理期间对照叶片PSⅡ光化学效率(ΦPSⅡ)没发生变化,沙尘覆盖厚度2 mg/cm2叶片的ΦPSⅡ在处理第7 天显著提高,第14 天、28 天的值与对照相比没有差异,最终第42 天则显著下降;沙尘覆盖厚度9 mg/cm2叶片ΦPSⅡ在处理第7天略有提高趋势,处理第14天急剧下降,此后又随时间延长逐渐恢复到对照的水平。非环式电子传递速率(ETR)的变化模式与ΦPSⅡ基本相似;对照叶片非光化学猝灭系数NPQ在处理期间没有发生变化,沙尘覆盖厚度2 mg/cm2叶片的NPQ,在处理7 d显著下降,此后随处理时间的延长而升高,而沙尘覆盖厚度9 mg/cm2叶片的NPQ在处理第7 天就显著增加,并在处理期间始终维持高水平。在处理第28天和42天,轻度和重度胁迫之间没有显著差异(图5)。

图5 沙尘覆盖对阿月浑子叶片Fv/Fm、ΦPSⅡ、ETR和NPQ的影响Fig.5 Effects of dust on leaf Fv/Fm,ΦPSⅡ, ETR and NPQ in Pistacia vera L.图中不同字母表示差异达显著水平(P<0. 05)
3 讨论
干旱胁迫[20- 22]、盐胁迫[23]、低温[24]及沙尘等逆境条件均导致植物叶片净光合速率(Pn)的下降[5,7,25- 26 ]。通常认为引起Pn下降的因素主要有两种:一种是气孔因素,另一种为非气孔因素[27- 29]。Reddy等认为水分胁迫导致气孔关闭是光合作用强度下降的首要原因[30]。根据Farquhar和Sharkey的观点,如果Pn下降的同时Ci值不变或升高,则Pn下降是由叶片叶肉细胞光合能力的下降而引起的;反之,如果Pn下降的同时Ci值也下降则说明是由气孔受限引起的[27]。在本次试验,轻度和重度沙尘胁迫下阿月浑子叶片Pn值均低于对照并且随处理时间逐渐降低、重度胁迫的降低速率大于轻度胁迫。气孔导度的变化趋势与光合作用的变化相似,似乎光合作用的下降是由气孔限制所造成,然而在沙尘处理第7天轻度和重度沙尘胁迫叶片Ci值均显著高于对照;处理7 d到28 d之间Ci值随时间而增加,在轻度胁迫下其增加速度更快而处理28—42 d之间Ci值迅速下降到对照的水平,在重度胁迫下略有下降。说明,阿月浑子叶片在沙尘胁迫前期非气孔因素对光合作用限制的贡献略高于气孔因素,在中期非气孔限制更为明显,到后期气孔成为主要限制因素。路丙社等[21],对阿月浑子抗旱生理研究发现,在轻度干旱胁迫下光合作用主要受气孔限制,而在严重干旱胁迫下则受非气孔因素限制。根据黄蜂等的研究结果显示,在连续蒙尘处理40 d后,大多数植物的气孔导度明显下降,抑制程度接近50%[26]。
叶绿素是光合作用过程中进行光能吸收、传递,并且极少数特殊Chl-a参与光化学反应[31],即将光能转化为化学能。光合效率的高低涉及到叶绿素含量、Chl-a/Chl-b值以及光化学活性[32]。外界环境条件通过叶绿素含量、Chl-a/Chl-b值以及叶绿素光能转化活性的改变影响植物光合作用。本文研究结果显示,沙尘对阿月浑子叶片光合色素的影响表现在总叶绿素含量和Chl-a、Chl-b都下降,由于Chl-a的下降速率较Chl-b快,引起Chl-a /Chl-b值下降。Agastian 等研究发现,逆境下植物体内活性氧大量产生,破坏了叶绿体的结构,使叶绿素的合成缓慢导致叶绿素含量降低[33]。Agastian和黄承建等苎麻干旱胁迫均使叶绿素含量显著降低,而Chl-a/Chl-b值增高[33- 34]。盐生植物骆驼刺在盐胁迫条件总叶绿素含量升高,而Chl-a /Chl-b值却下降[23]。
光合作用结合叶绿素荧光特性可以更系统、深刻地反映出逆境对植物叶片光合的伤害机理。叶绿素荧光参数反映植物光合性能,被光合色素吸收的光能通过一系列光物理反应最终激发反应中心色素,其激发能用于光化学反应,释放荧光、放热或通过叶黄素循环调节性耗散过量的光能,这被认为非光化学荧光熄灭(NPQ)。根据前人的研究[35],干旱和沙尘对植物荧光特性的影响在不同植物有差异,使不同植物光能捕捉能力与光化学转化效率不同程度降低、提高热耗散比例,进一步使叶片PSⅡ反应中心受损,形成可逆或不可逆失活[20,35- 36]。PSⅡ反应中心失活分为可逆失活和不可逆失活两种[37],其中PSⅡ反应中心不可逆失活是由于天线色素脱离PSⅡ反应中心引起的[38]。阿月浑子叶片PSⅡ反应中心失活是否存在不可逆失活,这有待进一步深入研究并揭示其机理。在本试验中,轻度和重度沙尘处理的阿月浑子叶片的Fv/Fm均随处理时间的延续而显著下降,同时PSⅡ的光化学活性和非环式电子传递效率也下降,表明沙尘胁迫使PSⅡ下降。这与王鑫等对盐处理高粱所得的结果相一致[39]。然而,沙尘覆盖厚度9 mg/cm2叶片ΦPSⅡ在处理中期下降,此后又随时间延长逐渐恢复到对照的水平,观察NPQ值发现,轻度沙尘处理中NPQ随时间逐渐增高,而在重度沙尘胁迫下NPQ始终维持较高水平。似乎在重度胁迫或长时间轻度胁迫条件下,光合色素所吸收的光能用于保护性耗散比例增加,NPQ上升是叶片对沙尘胁迫的一种反应,同时也是一种自我保护措施。沙尘处理前、中期光合作用主要由非气孔以限制,而后期可能由于NPQ的保护性增加,使得轻度沙尘胁迫叶片ΦPSⅡ和ETR增加,非气孔光合CO2固定能力适应性好转,气孔限制便成为主要因素。在胁迫条件下PSⅡ反应中心失活使得天线色素原初捕光能力减弱,植株吸收的光能减少,但由于电子传输途径受到损伤,光合电子传递能力减弱,使得用于光化学反应的光能部分显著减少,从而形成过剩光能。当大量过剩光能不能及时用于光化学反应时,就能形成光抑制现象,植物为了免受PSⅡ受到破坏,往往通过叶黄素循环、荧光发射、光呼吸等热耗散途径来消耗过剩光能[40]。
4 结论
(1) 在沙尘处理28d内光合作用的非气孔限制逐渐上升,第28 天以后非气孔限制逐渐下降,以气孔限制为主。
(2) 在轻度沙尘处理条件下Chl-a和Chl-b的下降速率基本相同,即Chl-a/Chl-b值不变,而在重度沙尘处理下Chl-a的下降速率高于Chl-b,引起Chl-a/Chl-b值下降。
(3) 沙尘处理下PSⅡ潜在能力逐渐下降,保护性能量耗散增多(NPQ),ΦPSⅡ和ETR在重度胁迫下先急剧下降而后逐渐恢复。
[1] Li J C, Dong Z B, Wang X M, He S S. Seasonal distribution and causes of dust events in Tarim Basin. Chinese Journal of Desert Research, 2008, 28(1): 142- 148.
[2] Farmer A M. The effects of dust on vegetation-a review. Environmental Pollution, 1993, 79(1): 63- 75.
[3] Yao J M, Gao X Q, Feng Q, Zhang X Y, Gu L L. The photosynthestically active radiation during dust storm day inEjinaOasis. Acta Energiae Solaris Sinica, 2006, 27(5): 484- 488.
[4] Chen X, Wei W S, Liu M Z. Influence of sand-dust over Tarim Basin on shortwave radiation: a case study in Tazhong area. Chinese Journal of Desert Research, 2008, 28(5): 920- 926.
[5] Cheng X W. Study of the short time eco-physiological response of plant leaves to dust. Acta Botanica Sinica, 2001, 43(10): 1058- 1064.
[6] Honour S L, Bell N B, Ashenden T W, Caped J N, Power S A. Responses of herbaceous plants to urban air pollution: Effects on growth, phenology and leaf surface characteristics. Environmental Pollution, 2009, 157(4): 1279- 1286.
[7] Hirano T, Kiyota M, Aiga I. Physical effects of dust on leaf physiology of cucumber and kidney bean plants. Environmental Pollution, 1995, 89(3): 255- 261.
[8] Sharifi M R, Gibson A C, Rundel P W. Surface dust impacts on gas exchange in Mojave Desert shrubs. Journal of Applied Ecology, 1997, 34(4): 837- 846.
[9] Iqbal M Z, Shafiq M. Periodical effect of cement dust pollution on the growth of some plant species. Turk Journal of Botany, 2001, 25(1): 19- 24.
[10] Naidoo G, Chirkoot D. The effects of coal dust on photosynthetic performance of the mangrove,Avicenniamarinain Richards Bay, South Africa. Environmental Pollution, 2004, 127(3): 359- 366.
[11] Bake B, Musha R, Abudurufu S, SI M, Wang X, Abulaiti M. Dust retaining capability of six fruit tree leaves in Southern Xinjiang. Journal of Xinjiang Agricultural University, 2010, 33(2): 125- 128.
[12] Li H M, Liu X. Relationships between leaf epidermal morphology and dust-retaining capability of main garden trees in Chengyang District of Qingdao City. Chinese Journal of Ecology, 2008, 27(10): 1659- 1662.
[13] Nanos G D, llias I F. Effects of inert dust on olive (OleaeuropaeaL.) leaf physiological parameters. Environmental Science and Pollution Research, 2007, 14(3): 212- 214.
[14] Wang Z H, Li J B. Capacity of dust uptake by leaf surface of Euonymus Japonicus Thunb. and the morphology of captured particle in air polluted city. Ecology and Environment, 2006, 15(2): 327- 330.
[15] Wang S Q, Shang X Y, Shi Y Q, He J, Nurmemet T, Gu W M, Haxim P. Case ofPistaciaveraresources in Xinjiang. Chinese Journal of Economic Forest Researches, 1996, 14(4): 54- 56.
[16] Liu Y F, Xiao L T, Tong J H, Li X B. Primary application on the non-rectangular hyperbola model for photosynthetic light-response curve. Chinese Agricultural Science Bulletin, 2008, 21(8): 76- 79.
[17] Li H S, Sun Q, Zhao S J, Zhang W H. Principle and Technology of Experimental Plant Physiology and Biochemistry. Beijing: Higher Education Press, 2000: 134- 137.
[18] Lu B S, Bai Z Y, Liang H Y, Wu J M, Dong Y. A study on photoinhibition of photosythesis in Pistachio (PistaciaveraL.) leaves. Acta Horticulturae Sinica, 2002, 29(4): 313- 316.
[19] Herrick J D, Thomas R B. Effects of CO2enrichment on the photosynthetic light response of sun and shade leaves of canopy sweetgum trees (Liquidambarstyraciflua) in a forest ecosystem. Tree Physiology, 1999, 19(12): 779- 786.
[20] Wang Y, Chen J W, Di X Y. Characterization of the responses of photosynthetic and chlorophyll fluorescence parameters to water stress in seedlings of six provenances of Chinese Pine (PinusTabulaeformisCarr.). Acta Ecologica Sinica, 2011, 31(23): 7031- 7038.
[21] Lu B S, Bai Z Y, Cui J Z, Li C Y, Li H P. The effect of relative soil water content on photosynthesis in Pistachio (PistaciaveraL.)leaves. Journal of Agricutural Universit of Hebei, 2004, 27(1): 44- 47.
[22] Wei X D, Chen G X, Shi D W, Liu D. Effects of drought on fluorescence characteristics of photosystem Ⅱ in leaves ofGinkgobiloba. Acta Ecologica Sinica, 2012, 32(23): 7492- 7500.
[23] Kakem U, Kurban H, Chen Q J, Wang X C. Study on daily change and midday depression of photosynthesis of alhagi pseudoalhagi, and vigna radiata under salt stress. Chinese Journal of Arid Zone Research, 2012, 29(6): 1039- 1045.
[24] Brüggemann W. Low-temperature limitations of photosynthesis in three tropicalVignaspecies: A chlorophyll fluorescence study. Photosynthesis Research, 1992, 34(2): 301- 310.
[25] Thompson J R, Mueller P W, Flückiger W, Rutter A J. The effect of dust on photosynthesis and its significance for roadside plants. Environmental Pollution Series A, Ecological and Biological, 1984, 34(2): 171- 190.
[26] Huang F. Effect of Highway Dust Pollution on Photosynthesis in Plant Leaves [D]. Wuhan: Wuhan University of Technology, 2007.
[27] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(1): 317- 345.
[28] Chaves M M, Flexas J, Pinheiro C. Photosynthesis under drought and salt stress: Regulation mechanisms from whole plant to cell. Annals of Botany, 2009, 103(4): 551- 560.
[29] Stepien P, Johnson G N. Contrasting responses of photosynthesis to salt stress in the glycophyte arabidopsis and the halophyte thellungiella: role of the plastid terminal oxidase as an alternative electron sink. Plant Physiology, 2009, 149(2): 1154- 1165.
[30] Reddy A R, Chaitanya K V, Vivekanandan M. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants. Journal of Plant Physiology, 2004, 161(11): 1189- 1202.
[31] Björn L O, Papageorgiou G C, Blankenship R E, Govindjee. A viewpoint: Why chlorophylla? Photosynthesis Research, 2009, 99(2): 85- 98.
[32] Zhang Z S, Yang C, Li G, Gao H Y, Liu P. Relationship between photochemistry activity and decrease in chlorophyll content during senescence in leaves of stay green and quick-leaf-senescence inbred line of maize. Scientia Agricultura Sinica, 2012, 45(23): 4794- 4800.
[33] Agastian P, Kingsley S J, Vivekanandan M. Effect of salinity on photosynthesis and biochemical characteristics in mulberry genotypes. Photosynthetica, 2000, 38(2): 287- 290.
[34] Huang C J, Zhao S Y, Wang L C, Shu Z X, Yang Y, Fang C M. Effect of drought stress on chlorophyll contents in ramie. Plant Fiber Sciences in China, 2012, 34(5): 208- 212.
[35] Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: The basics. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42(1): 313- 349.
[36] Demmig-Adams B, Adams W W. Photoprotection and other responses of plants to high light stress. Annual Review of Plant Physiology and Plant Molecular Biology, 1992, 43(1): 599- 626.
[37] Sayed O H, Earnshaw M J, Emes M J. Photosynthetic responses of different varieties of wheat to high temperature Ⅱ. Effect of heat stress on photosynthetic electron transport. Journal of Experimental Botany, 1989, 40(6): 633- 638.
[38] Yamane Y, Kashino Y, Koike H, Satoh K. Increases in the fluorescence Folevel and reversible inhibition of photosystem Ⅱ reaction center by high temperature treatments in higher plants. Photosynthesis Research, 1997, 52(1): 57- 64.
[39] Wang X, Li Z Q, Gu W B, Shi L, Gao H Y, Zhao S J. Systemic regulation of anatomic structure and photosynthetic characteristics of developing leaves in sorghum seedlings under salt stress. Acta Agronomica Sinica, 2010, 36(11): 1941- 1949.
[40] Ort D R. When there is too much light. Plant Physiology, 2001, 125(1): 29- 32.
参考文献:
[1] 李晋昌, 董治宝, 王训明, 何树生. 塔里木盆地沙尘天气的季节变化及成因分析. 中国沙漠, 2008, 28(1): 142- 148.
[3] 姚济敏, 高晓清, 冯起, 张小由, 谷良雷. 额济纳绿洲沙尘暴天气下光合有效辐射的基本特征. 太阳能学报, 2006, 27(5): 484- 488.
[4] 陈霞, 魏文寿, 刘明哲. 塔里木盆地沙尘气溶胶对短波辐射的影响——以塔中为例. 中国沙漠, 2008, 28(5): 920- 926.
[5] 陈雄文. 植物叶片对沙尘的短时间生理生态反应. 植物学报, 2001, 43(10): 1058- 1064.
[11] 巴特尔·巴克, 茹鲜·木沙, 沙依甫加玛力·阿布都鲁莆, 司玛丽, 王新军, 买买提·阿布来提. 新疆南疆6种果树叶片滞尘能力分析. 新疆农业大学学报, 2010, 33(2): 125- 128.
[12] 李海梅, 刘霞. 青岛市城阳区主要园林树种叶片表皮形态与滞尘量的关系. 生态学杂志, 2008, 27(10): 1659- 1662.
[14] 王赞红, 李纪标. 城市街道常绿灌木植物叶片滞尘能力及滞尘颗粒物形态. 生态环境学报, 2006, 15(2): 327- 330.
[15] 王树清, 尚新业, 石玉琴, 何健, 吐拉克孜, 谷为民, 帕提古丽. 新疆阿月浑子资源情况. 经济林研究, 1996, 14(4): 54- 56.
[16] 刘宇锋, 萧浪涛, 童建华, 李晓波. 非直线双曲线模型在光合光响应曲线数据分析中的应用. 中国农学通报2005, 21(8): 76- 79.
[17] 李合生, 孙群, 赵世杰, 章文华. 植物生理生化学实验原理和技术. 北京: 高等教育出版社, 2000: 134- 137.
[18] 路丙社, 白志英, 梁海永, 吴京民, 董源. 阿月浑子叶片光合作用的光抑制研究. 园艺学报, 2002, 29(4): 313- 316,
[20] 王琰, 陈建文, 狄晓艳. 不同油松种源光合和荧光参数对水分胁迫的响应特征. 生态学报, 2011, 31(23): 7031- 7038.
[21] 路丙社, 白志英, 崔建州, 李春友, 李会平. 干旱胁迫对阿月浑子叶片光合作用的影响. 河北农大学学报2004, 27(1): 44- 47.
[22] 魏晓东, 陈国祥, 施大伟, 刘丹. 干旱胁迫对银杏叶片光合系统Ⅱ荧光特性的影响. 生态学报, 2012, 32(23): 7492- 7500.
[23] 吾木替汗·卡克木, 海利力·库尔班, 陈其军, 王学臣. 盐胁迫条件下骆驼刺与绿豆光合日变化特征及午休现象的成因. 干旱区研究, 2012, 29(6): 1039- 1045.
[26] 黄峰. 高速公路尘污染对植物叶片光合作用的影响 [D]. 武汉: 武汉理工大学, 2007.
[32] 张子山, 杨程, 高辉远, 李耕, 刘鹏. 保绿玉米与早衰玉米叶片衰老过程中叶绿素降解与光合作用光化学活性的关系. 中国农业科学, 2012, 45(23): 4794- 4800.
[34] 黄承建, 赵思毅, 王龙昌, 舒忠旭, 杨燕, 方传茂. 干旱胁迫对苎麻叶绿素含量的影响. 中国麻业科学, 2012, 34(5): 208- 212.
[39] 王鑫, 李志强, 谷卫彬, 石雷, 高辉远, 赵世杰. 盐胁迫下高粱新生叶片结构和光合特性的系统调控. 作物学报, 2010, 36(11): 1941- 1949.
Influence of dust stress on the photosynthetic and chlorophyll fluorescence characteristics ofPistaciaveraL.
Patigul MAMAT1,Batur BAKE1,*,Halil KURBAN2
1CollegeofGrasslandandEnvironmentalScience,XinjiangAgriculturalUniversity,Urumqi830052,China2CollegeofForestryandHorticulturalScience,XinjiangAgriculturalUniversity,Urumqi830052,China
In plants, photosynthesis is one of the physiological processes that are sensitive to sand-dust stress. The leaves of sand-dust stressed plants show decreases in net photosynthetic rate and chlorophyll pigment content, and changes in chlorophyll fluorescence parameters because of decreased leaf-absorbed solar radiation, physical blockage of stomata and physical leaf epidermis damage by sand-dust particles. Photosystem Ⅱ (PSⅡ) is the most sensitive component of the photosynthetic apparatus to environmental stresses. Analyses of chlorophyll fluorescence dynamics are useful to determine the effects of environmental stresses on PSⅡ structure, and to study the response mechanisms of the photosynthetic machinery.PistaciaveraL. is often subjected to drought and salt stress during its growth season in planted areas. However, little is known about chlorophyll pigment content and the physiological mechanisms underlying changes in the photochemical activity of PSⅡ inPistaciaveraunder sand-dust stress. This experiment was designed to study the adaptive photosynthetic mechanism and chlorophyll fluorescence characteristics ofPistaciaveraunder dust stress and was carried out in a greenhouse at the experimental site of Xinjiang Agricultural University. Plant materials were grown in flowerpots in the greenhouse and the stress treatment was performed by covering plant leaves with 2 mg/cm2(mild sand-dust cover) or 9 mg/cm2(severe sand-dust cover) dust, with 0 mg/cm2as a control. Photosynthesis, chlorophyll pigment content and chlorophyll fluorescence parameters were measured at 7, 14, 28 and 42 d after treatment. The results showed that prolonged dust stress led to decreases in net photosynthetic rate (Pn) and stomatal conductance (Gs), and thatPnandGsdecreased more under severe dust treatment than mild dust treatment, while the intercellular CO2concentration (Ci) increased at the beginning but later declined, and was increased less under severe dust treatment than mild dust treatment. Chlorophyll-a (Chl-a), chlorophyll-b (Chl-b) and total chlorophyll contents decreased with increasing treatment time, and decreased more in the severe dust treatment than the mild. The rate of Chl-a decrease was higher than that of Chl-b, which resulted in a decrease in Chl-a/Chl-b ratio. TheFv/Fmgradually decreased under mild and severe stress conditions, and decreased more under severe sand-dust cover compared with mild sand-dust cover. While the quantum efficiency of photosystem Ⅱ (ΦPSⅡ) and the nonlinear electron transport rate (ETR) were decreased after 42 d in the mild dust treatment, they rapidly decreased until the 14thday of treatment under severe stress conditions and then increased to the levels of the control by the 42ndday. Non-photochemical quenching (NPQ) was decreased at first and then continually increased under mild stress conditions, whereas it was maintained at a high level during the entire treatment period under severe stress. In conclusion, the contribution of non-stomatal inhibition to the photosynthetic rate was greater than stomatal inhibition at the beginning, but stomatal inhibition became the main factor at later stages under mild sand-dust stress, because of the increased adaptive dissipation of absorbed photoenergy by the photosynthetic machinery, and caused a decrease in photosynthetic CO2assimilation rate inPistaciaveraleaves.
PistaciaveraL.; dust stress; photosynthetic characteristics; chlorophyll fluorescence characteristics
霍英东青年教师基金(121019);国家自然科学基金(31060169);新疆维吾尔自治区土壤学重点学科资助
2013- 02- 08;
2014- 03- 17
10.5846/stxb201302080258
*通讯作者Corresponding author.E-mail: bateerbake@163.com
帕提古力·麦麦提,巴特尔·巴克,海利力·库尔班.沙尘胁迫对阿月浑子光合作用及叶绿素荧光特性的影响.生态学报,2014,34(22):6450- 6459.
Patigul MAMAT,Batur BAKE,Halil KURBAN.Influence of dust stress on the photosynthetic and chlorophyll fluorescence characteristics ofPistaciaveraL..Acta Ecologica Sinica,2014,34(22):6450- 6459.
