从烟草丛顶病病原复合物中分离烟草扭脉病毒的方法
2014-08-10马琨玲兰平秀缪玉东李晓静
刘 芳, 马琨玲, 兰平秀, 缪玉东, 李晓静, 李 凡*
(1. 云南农业大学植物保护学院,昆明 650201;2. 云南农业大学农学与生物技术学院,昆明 650201;3. 云南大理州烟草公司大理市分公司,大理 671000;4. 云南农业大学动物科学技术学院,昆明 650201)
实验方法与技术
从烟草丛顶病病原复合物中分离烟草扭脉病毒的方法
刘 芳1,2#, 马琨玲3#, 兰平秀4, 缪玉东2, 李晓静1, 李 凡1*
(1. 云南农业大学植物保护学院,昆明 650201;2. 云南农业大学农学与生物技术学院,昆明 650201;3. 云南大理州烟草公司大理市分公司,大理 671000;4. 云南农业大学动物科学技术学院,昆明 650201)
烟草丛顶病是由烟草丛顶病毒(TBTV)、烟草丛顶病毒类似卫星RNA(Sat-TBTV)、烟草扭脉病毒(TVDV)和烟草扭脉病毒相关RNA(TVDVaRNA)复合侵染引起的一类特殊病害,目前尚不清楚这些病原物各自在病害症状形成和病害传播中的作用。本文根据蚜虫传播烟草丛顶病复合病原物传毒特性的差异,探索了3种分离TVDV的生物学方法。方法A为将获得了烟草丛顶病复合病原物的蚜虫饥饿24 h后,以单虫单苗的方式接到健康烟株上传毒,24 h后灭虫。方法B为将无毒蚜虫饥饿2~4 h后转接到感病烟株上饲毒48 h,再以单虫单苗的方式接到健康烟株上传毒,24 h后灭虫。方法C为将无毒蚜虫于感病烟株上饲毒48 h后,以单虫单苗的方式接到健康烟株上传毒24 h,此后每隔24 h将蚜虫移到另一健康烟株上传毒,直到蚜虫死亡。其中方法A和B均可将TVDV从烟草丛顶病病原复合体中分开,方法A操作简单、分离周期短且TVDV的分离效率高。单独TVDV侵染的烟株无明显的丛顶症状,叶片靠近主脉的地方会出现皱缩,生长后期叶片变得细长且顶端会发生扭曲。本试验可为研究TVDV与其他病原物、寄主植物和传播介体的相互作用提供很好的试验材料,也可为蚜虫传播的复合侵染病毒的生物学分离提供参考。
烟草丛顶病; 病原复合物; 烟草扭脉病毒; 蚜虫; 生物学分离
烟草扭脉病毒(Tobaccoveindistortingvirus,TVDV)为黄症病毒科(Luteoviridae)马铃薯卷叶病毒属(Polerovirus)成员[1-2],TVDV与烟草丛顶病毒(Tobaccobushytopvirus,TBTV)、烟草丛顶病毒类似卫星RNA(Tobaccobushytopvirussatellite-like RNA,Sat-TBTV)及烟草扭脉病毒相关RNA(Tobaccoveindistortingvirus-associated RNA,TVDVaRNA)等病原物复合侵染引起烟草丛顶病(tobacco bushy top disease,TBTD)。1957年烟草丛顶病首先在津巴布韦北部的春克旺里烟区暴发[1],接着便在津巴布韦邻国马拉维、南非等国家发生[3]。在我国云南省的保山、大理、楚雄等烟区曾大面积暴发流行,给烟区生产带来了重大损失[4-5],目前该病在我国仅云南有报道发生。
TVDV是引起烟草丛顶病的主要病毒之一,2010年Mo等获得了TVDV的全基因组序列[6],该病毒基因组全长为5 920 bp,具有6个主要的开放阅读框(open reading frames,ORFs)。通过比对其RdRp和CP序列,显示TVDV与黄症病毒科的马铃薯卷叶病毒属(Polerovirus)具有很高的同源性,ICTV 第9次分类报告将TVDV归为该属的确定成员[7]。
在自然条件下表现典型烟草丛顶病症状的烟株中,TVDV总是与TBTV等病原物复合侵染,人工获得单独感染TVDV的烟株极为困难,只有Smith和Cole报道在偶然的机会下曾分离到单独感染TVDV的烟株[2,8]。TVDV局限在寄主的韧皮部,病毒含量低,不易直接从病株里提纯到病毒粒子,并且TVDV编码的CP(coat protein)可能异源包裹了TBTV、Sat-TBTV及TVDVaRNA等病原的RNA,因此很难通过提纯病毒的方法获得单独的TVDV。
TBTV为幽影病毒属(Umbravirus)成员,可以通过机械接种方式传播,在辅助病毒TVDV的帮助下还可以通过蚜虫以持久性方式传播,单独的TBTV不能通过蚜虫传播[5]。而TVDV只能通过蚜虫传播,不能经机械摩擦传播[5]。另外,迄今尚未发现TBTD各病原物的枯斑寄主,无法通过枯斑寄主分离法获得单独的TVDV。要想获得单一的TVDV,目前只能通过构建其侵染性cDNA克隆,但是由于植物RNA病毒产生侵染性转录物所涉及的体外逆转录酶、DNA聚合酶和RNA聚合酶的忠实性并非百分之百,必然会产生突变,这可能导致所获得的cDNA克隆没有侵染性[9]。到目前为止,只有为数不多的植物病毒获得了侵染性的cDNA克隆。鉴于TVDV只能通过蚜虫传播,因此本文尝试通过生物学方法来分离TVDV,设计了多种蚜虫传毒方法,通过大量的单虫单苗传毒方法,获得了只含有 TVDV 的烟株。另外,研究表明TBTV在病害的症状表现中起主要作用,而TBTV的远距离传播主要依靠TVDV编码的外壳蛋白将其包裹后由蚜虫传播,所以TVDV在烟草丛顶病的发生和流行危害中起到了重要作用。因此分离获得单独感染TVDV的试验材料对研究烟草丛顶病的发生、传播及防治就显得非常重要,并将极大促进对TVDV与烟草丛顶病的其他病原物、寄主植物及传播介体之间的相互作用的研究。本文根据烟草丛顶病复合病原物经蚜虫传毒的差异,通过生物学的方法探索出2种能分离获得单一TVDV的方法,希望可以为多种病毒复合侵染病害的病毒分离提供一定的参考价值。
1 材料与方法
1.1 毒源及健康烟株
烟草丛顶病感病烟株采自保山市隆阳区潞江镇东松村委会,发病烟株表现为顶端优势丧失、叶片褪绿黄化、侧枝丛生和节间缩短等症状。病株于无虫温室栽培并用蚜虫传毒方式保存备用,健康烟株均为防虫温室培育的烤烟品种‘K326’。
1.2 分子生物学常用酶和试剂盒
RNA提取试剂为TRIpure Reagent,为北京百泰克生物技术有限公司产品, Reverse Transcriptase M-MLV(RNase H-)、TaKaRa TaqTM均购自宝生物工程(大连)有限公司。通用型DNA纯化回收试剂盒(离心柱型)购自天根生物技术(北京)有限公司。
1.3 检测引物设计
根据NCBI中登录的TBTV、TVDV、Sat-TBTV和TVDVaRNA基因序列(登录号分别为:AF402620、EF529624、AJ315135和EF529625)分别设计了检测TBTV、TVDV、Sat-TBTV和TVDVaRNA的特异引物,由深圳华大基因公司合成,见表1。
表1检测TBTV、TVDV、Sat-TBTV和TVDVaRNA的引物
Table1ListofprimersusedfordetectionofTBTV,TVDV,Sat-TBTVandTVDVaRNA

引物名称1)Primer序列(5′⁃3′)Sequence扩增片段大小/bpFragmentlength所检测病原物TargetvirusTBTVdFTACCACACCTAAACAGCGTTGTBTVdRCTCATCTCCCGCTAAGTCAG1049TBTVTVDVdFAGCCAAGCATACATCAGTTGCATVDVdRGTCTACCTATTTGGGGTTGTG803TVDVSatTBTVdFTGTTGGCCGTGGGCAGCAASatTBTVdRTTCGTATTTGGCTCCGTCGC598Sat⁃TBTVTVDVaRNAdFGCGTACTGCGGAAGTCTCACTVDVaRNAdRTGTACTGGAGTGCTTCAACCG792TVDVaRNA
1) F:正义链引物; R:反义链引物。
F:Sense primer; R:Antisense primer.
1.4 无毒蚜虫的获得
将田间采集的烟蚜挑到白菜上,在网箱隔离条件下繁殖,将每一代的仔蚜移到另一白菜上进行脱毒,脱毒至第10代,经检测无毒后在白菜上扩大培养备用。
1.5 TVDV的生物学分离方法
方法A:先将无毒蚜虫在烟草丛顶病染病烟株上饲毒繁殖数代后,用毛笔从患病烟株上挑取40~50头蚜虫于灭菌的培养皿中,用封口膜封好,室温下饥饿24 h。将饥饿后的蚜虫以单虫单苗的方式接到健康烟株上进行传毒试验,饲毒24 h后灭虫。2批处理共接种40株烟株,待接种植株产生症状后,对无症状接种烟株进行TBTV、 TVDV、TVDVaRNA和 Sat-TBTV的检测。
方法B:用毛笔挑取无毒蚜于灭菌的培养皿中,用封口膜封好,室温下饥饿2~4 h。再将蚜虫接到烟草丛顶病自然发病的烟株上饲毒48 h,然后按单虫单苗的方式将饲过毒的蚜虫接到健康烟株上进行传毒试验,24 h后灭虫。8批处理共接种212株烟株,待接种植株产生症状后,随机挑取无症状接种植株进行TBTV、 TVDV、TVDVaRNA和 Sat-TBTV的检测。
方法C:挑取无毒蚜虫于烟草丛顶病自然发病的烟株上取食48 h,之后将蚜虫按单虫单苗转接到健康植株上传毒24 h,此后每隔24 h将蚜虫转接到另一健康烟株上进行传毒,直至蚜虫死亡,7批处理共接种47株烟株,待接种植株产生症状后,对无症状接种烟株进行TBTV、 TVDV、TVDVaRNA和 Sat-TBTV的检测。
1.6 烟草丛顶病4种病原物检测及鉴定
接种植株总RNA的提取参照TRIpure Reagent产品的步骤进行。RT 反应体系参照 TaKaRa 的Reverse Transcriptase M-MLV(RNase H-)试剂盒说明进行操作。50 μL PCR反应体系包括 1st strand cDNA 0.5 μL, 正反向引物(10 μmol)各2 μL、dNTPs (2.5 mmol)4 μL、TaqDNA 聚合酶(5U/μL)0.25 μL、10×PCR Buffer (Mg2+Plus)5 μL、ddH2O 36.25 μL。PCR 反应循环如下:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环扩增35 次;最后72 ℃延伸10 min。
挑取只检测到TVDV的PCR产物,采用天根通用型DNA纯化回收试剂盒回收目标片段,回收产物送深圳华大基因公司测序,测序经DNASTAR软件处理后在NCBI数据库中进行比对。
2 结果与分析
2.1 TVDV分离结果
通过以上3种不同的单虫单苗传毒方式,只有方法A和方法B分离到了只含TVDV的烟株。方法A接种一周后,其中的28株接种烟株表现出典型的烟草丛顶病症状,12株无症状表现(见表2)。随机挑取几株表现烟草丛顶病症状的烟株叶片,提取核酸并进行4种病原物的检测,检测结果显示在表现丛顶症状的烟株中都能检测到4种病原物,因此直接将表现出丛顶病症状的烟株清理掉。采集没有明显症状的烟株叶片,提取核酸并检测TBTV、 TVDV、TVDVaRNA和 Sat-TBTV。检测结果显示12株无症状的烟株中有4株只感染了TVDV,另外8株同时感染了TVDV和TVDVaRNA。对只检测到TVDV和同时感染了TVDV和TVDVaRNA的烟株用健康蚜虫传代保存。
表2方法A分离TVDV结果
Table2ResultsofTVDVisolationinmethodA
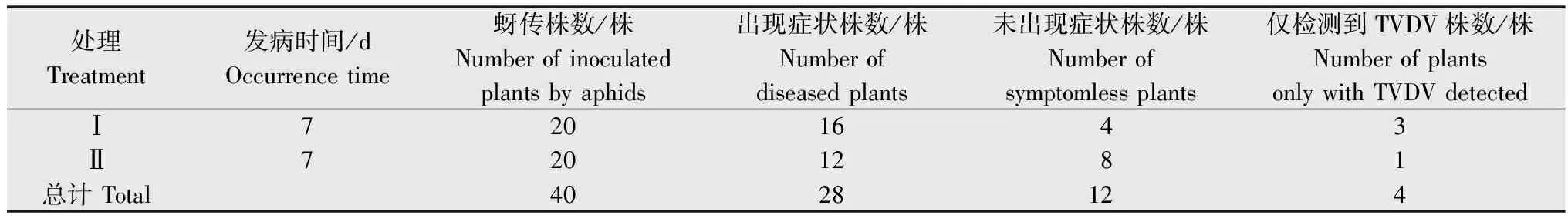
处理Treatment发病时间/dOccurrencetime蚜传株数/株Numberofinoculatedplantsbyaphids出现症状株数/株Numberofdiseasedplants未出现症状株数/株Numberofsymptomlessplants仅检测到TVDV株数/株NumberofplantsonlywithTVDVdetectedⅠ7201643Ⅱ7201281总计Total4028124
方法B中8批接种的212株烟株中有77株表现出烟草丛顶病症状,135株无症状表现,结果见表3。从没有表现症状的135 株烟株中,每一批随机挑取几株,共挑取 31 株烟株提取总核酸,检测TBTV、 TVDV、TVDVaRNA和 Sat-TBTV 4种病原物。在这31株中只有1株只检测到TVDV,对只检测到TVDV的烟株用无毒蚜虫传代保存。
表3方法B分离TVDV结果
Table3ResultsofTVDVisolationinmethodB
方法C中7批处理接种的47株烟株,其中33株烟株表现出丛顶病症状,14株无明显症状。将未表现症状的烟株提取总核酸检测4种病原物,检测结果显示所有未表现症状的14株烟株都没有检测到单独感染 TVDV 的烟株(见表4)。该方法没有获得 TVDV 单独侵染的植株,但从该试验结果可以看出,蚜虫获毒后的最长持毒期为 9 d,蚜虫一旦获毒后可以连续传毒数天,偶尔会出现间歇性不传毒现象。
表4方法C单株单虫连续传毒试验结果1)
Table4Continuoustransmissionofthefourcasualagentsoftobaccobushytopdiseasestosingletobaccoplantsbysingleaphid

处理Treatment传毒天数Daysafterinoculation第1天The1stday第2天The2ndday第3天The3rdday第4天The4thday第5天The5thday第6天The6thday第7天The7thday第8天The8thday第9天The9thday第10天The10thday第11天The11thdayⅠ+++++++++-/Ⅱ-+---/Ⅲ++---/Ⅳ---/Ⅴ++++++-++/Ⅵ++++++-+/Ⅶ+++-+++/
1) “+”表示出现症状,“-”表示未出现症状,“/”表示蚜虫死亡。
“+”indicates symptoms,“-”indicates symptomless,“/”indicates death of the aphid.
对比2种获得单独TVDV的分离方法发现,方法A从两批传毒的40株烟株中分离到4株单独感染TVDV的烟株,分离到8株同时感染TVDV和TVDaVRNA的烟株,其余28株烟株都表现出了烟草丛顶病症状,说明方法A中蚜虫传播烟草丛顶病复合病原物的效率非常高。方法B在处理的212株烟株中只有77株出现了烟草丛顶病症状,从135株无症状的烟株中随机挑取的31株进行检测,只有1株是只感染了TVDV,表明利用方法B分离获得单独的TVDV的效率不如方法A。方法A操作更为简单、试验周期短。
2.2 TVDV在烟株上引起的症状
单独感染TVDV的烟株没有表现出明显的丛顶病症状,只是在TVDV侵染的早期,靠近叶片主脉附近有轻微皱缩现象,到侵染后期叶片变得细长,叶片轻微扭曲。而同时感染了TVDV和TVDVaRNA的烟株,早期症状与单独感染TVDV的烟株没有明显的区别,生长后期叶片也会发生扭曲,但扭曲程度比单独感染TVDV的烟株相对要重。单独感染TVDV或同时感染TVDV和TVDVaRNA的烟株都能正常开花结果,与典型的丛顶病症状烟株相比,整个生长过程中没有出现坏死、叶片变圆、变小及节间缩短等现象,也不出现丛顶的症状。说明单独感染TVDV或同时感染TVDV和TVDVaRNA的烟株症状较轻,对烟草的生长影响不大。
3 讨论
本文根据蚜虫传播TBTV和TVDV的特性,摸索出了2种能分离获得单一TVDV的方法。对比方法A和方法B,方法A分离TVDV的效率高,操作相对简单且试验周期短。而方法B虽然能分离到单一的TVDV,但很多传毒烟株中都检测不到烟草丛顶病的4种病原物。TBTV主要在TVDV的帮助下以非持久性的方式进行蚜虫传播,因此蚜虫的获毒、持毒及传毒时间对蚜虫的传毒效率有极大的影响。方法B中蚜虫的饲毒时间不够长,可能是导致获毒率低而使得传毒效率降低。而方法A中蚜虫在感病烟株上繁殖数代,饲毒时间较长,使得蚜虫体内带毒率达到相当高的水平,容易获得与病毒有高亲和性的蚜虫群体。类似的现象在灰飞虱传播水稻条纹病毒(Ricestripevirus,RSV)中也有报道[10]。因此即使在传毒之前将蚜虫饥饿24 h,蚜虫体内的带毒率还是能维持在一定的水平。但由于TBTV主要存在于蚜虫的口针中,在饥饿过程中随着蚜虫不断地向外吐唾液使得TBTV的含量不断降低,而TVDV可能主要存在于蚜虫的食道中,从而能将TBTV和TVDV分开。方法C的设计是基于4种病原物在蚜虫体内持毒时间可能存在差异的推测,希望利用这种差异获得单一的TBTV、TVDV、Sat-TBTV及TVDVaRNA。虽然这种方法没能将4种病原物分开,但是从中我们发现蚜虫一旦获毒可在数天内连续传毒,偶尔会出现间歇性不传毒。因此生产上要严防蚜虫的出现,在蚜虫未出现之前即采取防护措施。
本文的分离方法也获得了同时感染TVDV和TVDVaRNA的烟株,但未能获得单独感染TVDVaRNA的植株,TVDVaRNA总是与TVDV共同存在于烟株中,但TVDV可以独立于丛顶病的其他病原物而在烟株中复制增殖。同时感染TVDV和TVDVaRNA的烟株在症状上与单独感染TVDV的烟株没有特别明显的差异,唯一不同的是同时感染TVDV和TVDVaRNA的烟株在开花结果时期,叶脉扭曲相对要重,因此我们推测TVDVaRNA有加重感病烟株叶片扭曲的作用,但这还需要进一步的验证。另外还发现,同时感染TVDV和TVDVaRNA的烟株在用无毒蚜虫进行传代保存的过程中TVDVaRNA有丢失的现象。到目前为止还没有TVDVaRNA生物学功能的相关报道,这也为以后的研究提供了一定的理论基础。通过以上3种分离方法,我们只获得了单独感染TVDV 的烟株,没有获得单独感染TBTV、TVDVaRNA及Sat-TBTV的烟株,也没能获得同时感染TBTV和Sat-TBTV的烟株。在摩擦接种的烟株中,Sat-TBTV总是伴随着TBTV出现(数据另文发表),而在蚜虫传毒接种的烟株中,TVDVaRNA只在感染TVDV的烟株中出现。由此看来,TBTD中复合病原物之间的相互关系比较复杂,值得进一步研究。因此分离获得单独的TVDV,对研究烟草丛顶病中多种病原物在侵染烟草及蚜虫传播中的相互作用就显得非常重要。同时这也为分离病原物复合体中的单一病毒提供了一定的参考。
在自然条件下幽影病毒总是与黄症病毒复合侵染引起植物病害[11]。例如胡萝卜斑驳病毒(Carrotmottlevirus,CMoV)或胡萝卜拟斑驳病毒(Carrotmottlemimicvirus,CMoMV)与胡萝卜红叶病毒(Carrotredleafvirus,CtRLV)复合侵染引起胡萝卜杂色矮化病[12],豌豆耳突花叶病毒2号(Peaenationmosaicvirus-2,PEMV-2)与豌豆耳突花叶病毒1号(Peaenationmosaicvirus-1,PEMV-1)复合侵染引起豌豆耳突花叶病[13],花生丛簇病毒(Groundnutrosettevirus,GRV)与花生丛簇辅助病毒(Groundnutrosetteassistorvirus,GRAV)复合侵染引起花生丛簇病[14],TBTV与TVDV复合侵染引起烟草丛顶病[1],而烟草丛顶病也是目前为止我国唯一报道的一种由幽影病毒属成员引起的病害。幽影病毒通常是被辅助病毒编码的CP异源包裹后通过蚜虫传播,因此辅助病毒在病害的发生及流行中起了重要的作用。但TVDV同其他的辅助病毒不同,不能在TBTV的帮助下进行摩擦接种传播,而其他黄症病毒如PEMV-1可以在PEMV-2的帮助下从植物的韧皮部进入叶肉组织从而可以通过机械摩擦接种传播;另一种黄症病毒——甜菜西方黄化病毒(Beetwesternyellowsvirus,BWYV)在莴苣小斑驳病毒(Lettucespecklesmottlevirus,LSMV)的存在下也可以有限地通过机械摩擦接种传播[15]。烟草丛顶病病汁液通过摩擦接种可以分离到仅含TBTV和Sat-TBTV的烟株,这种烟株在症状上与典型的烟草丛顶病症状极为相似,侵染前期会出现严重的过敏性坏死现象,随后长出的叶片坏死现象逐渐减弱至消失,叶片褪绿变小,侧枝提前萌发(数据另文发表)。但与典型的烟草丛顶病症状不同的是,被TBTV和Sat-TBTV感染的烟株节间没有明显的缩短现象。因此我们推测虽然单独的TVDV不能引起烟株矮缩,但可能具有与丛顶病其他病原物相互作用后引起植株矮缩的作用。这些都值得开展进一步的研究加以验证。
[1]Gates L F. A virus causing axillary bud sprouting of tobacco in Rhodesia and Nyasaland[J]. Annals Applied Biology,1962,50:169-174.
[2]Cole J S. Isolation ofTobaccoveindistortingvirusfrom tobacco plants infected with aphid-transmissible bushy top[J]. Phytopathology,1962,52:1312.
[3]Davis D L,Nielsen M T. Tobacco:production,chemistry and technology[M].Oxford:Blackwell Science,1999:196-215.
[4]李凡,陈海如. 云南西部烟区的一种新的烟草病害——烟草丛枝症病害[J].植物保护,2001,27(4):50-51.
[5]李凡,吴建宇,陈海如. 烟草丛顶病研究进展[J]. 植物病理学报,2005,35(5):385-391.
[6]Mo X H,Chen Z B,Chen J P. Complete nucleotide sequence and genome organization of a Chinese isolate ofTobaccoveindistortingvirus[J]. Virus Genes,2010,41:425-431.
[7]Andrew M Q K,Michael J A, Eric B C,et al. Virus taxonomy:classification and nomenclature of viruses. Ninth report of the international committee on taxonomy of viruses[C]. New York:Elsevier Academic Press,2012.
[8]Smith K M. Tobacco resette:a complex virus disease[J]. Parasitology,1946,38:121-124.
[9]Dawson W O,Beck D L,Knorr D A,et al. cDNA cloning of the complete genome ofTobaccomosaicvirusand production of infectious transcripts[J]. Proceedings of the National Academy of Sciences of the United States of America,1986,83:1832-1836.
[10]李小力. 灰飞虱与RSV亲和性相关的分子标记及RSV对灰飞虱生活力的影响[D]. 南京:南京农业大学,2008.
[11]李凡,林奇英,陈海如,等. 幽影病毒引起的几种主要植物病害[J].微生物学通报,2006,33(3):151-156.
[12]Gibbs M J,Ziegler A,Robinson D J,et al.Carrotmottlemimicvirus(CMoMV),a second umbravirus associated with carrot motley dwarf disease recognized by nucleic acid hybridization[J/OL]. Molecular Plant Pathology On-line,1996. http:∥www.bspp.org.uk/mppol/1996/1111 gibbs.
[13]Steven A,Demler,Deborah G,et al. Replication of the satellite RNA ofPeaenationmosaicvirusis controlled by RNA 2-encoded functions[J]. Journal of General Virology,1994,75:1399-1406.
[14]Taliansky M E,Robinson D J,Murant A F. Groundnut rosette disease virus complex:biology and molecular biology[J]. Advances in Virus Research,2000,55:357-400.
[15]Murant A F,Robinson D J,Taliansky M E,et al. Genus umbravirus[C]∥van Regenmortel M H V, Fauquet C M,Bishop D H L,et al. Virus taxonomy:classification and nomenclature of viruses. Seventh report of the international committee on taxonomy of viruses. San Diego:Academic Press,2000,785-790.
MethodsfortheisolationofTobaccoveindistortingvirusfromtobaccobushytopdiseaseviruscomplex
Liu Fang1,2, Ma Kunling3, Lan Pingxiu4, Miao Yudong2, Li Xiaojing1, Li Fan1
(1.CollegeofPlantProtection,YunnanAgriculturalUniversity,Kunming650201,China; 2.CollegeofAgricultureandBiotechnology,YunnanAgriculturalUniversity,Kunming650201,China; 3.DaliBranchofDaliTobaccoCompany,Yunnan671000,China; 4.CollegeofAnimalScienceandTechnology,YunnanAgriculturalUniversity,Kunming650201,China)
Tobacco bushy top disease (TBTD) is caused by a complex agents comprisingTobaccobushytopvirus(TBTV),Tobaccobushytopvirussatellite-like RNA (Sat-TBTV),Tobaccoveindistortingvirus(TVDV) andTobaccoveindistortingvirus-associated RNA (TVDVaRNA). The roles of each agent played on tobacco for disease symptom development and disease transmission are still unclear. Based on the differences of aphid transmission characteristics among the complex agents, three biological methods were tested to isolate TVDV from tobacco bushy top disease virus complex. In method A, aphids were firstly fed on the diseased tobacco plants for dozens of days to gain the complex pathogens, and then the aphids were starved for 24 h. The single starved aphid was transferred to a single tobacco plant for agent transmission, and the aphids were killed by pesticide 24 h later. In method B, virus-free aphids were firstly starved for 2-4 h, then fed on the diseased tobacco plant for 48 h. The single aphid was transferred to a single plant for agent transmission for 24 h. In method C, virus-free aphids were fed on the diseased plant for 48 h, and then single aphid was transferred to a single healthy tobacco plant for disease complex pathogen transmission for 24 h. The aphid was moved to another healthy tobacco plant every 24 h till the aphid was dead. The results showed that TVDV could be separated by methods A and B from tobacco bushy top disease virus complex, and method A was more simple and effective than method B.No bushy top disease symptoms could be observed from the tobacco plants infected with TVDV except shrinking in the area near the main vein of the leaf. The leaves of the infected plants tended to be longer and thinner, and the upper leaves showed vein-distorting at the later growth stage. The single TVDV isolated by using these methods could provide useful experimental material for studying the interaction among TVDV with other agents of TBTD, with host plants, or transmission vectors. The methods also might provide a guide for aphid-transmitted virus isolation from complex agent.
tobacco bushy top disease; complex agent;Tobaccoveindistortingvirus; aphid; biological isolation
2013-08-07
:2013-09-23
国家自然科学基金(30660101);云南省科技创新团队(2011HC005);云南省高校科技创新团队(云教科[2011]14号)
S 432.41
:ADOI:10.3969/j.issn.0529-1542.2014.04.020
* 通信作者 Tel:0871-65227096;E-mail: fanlikm@126.com
# 并列第一作者
