寒区昆虫病原线虫冷冻储存条件优化
2014-08-10李春杰谭国忠许艳丽
李春杰, 谭国忠, 王 义, 许艳丽*
(1.中国科学院东北地理与农业生态研究所,黑土区农业生态院重点实验室, 哈尔滨 150081;2. 美国Rutgers大学, 新泽西 08901)
寒区昆虫病原线虫冷冻储存条件优化
李春杰1, 谭国忠1, 王 义2, 许艳丽1*
(1.中国科学院东北地理与农业生态研究所,黑土区农业生态院重点实验室, 哈尔滨 150081;2. 美国Rutgers大学, 新泽西 08901)
以我国高寒地区分离、筛选出的高致病力昆虫病原线虫嗜菌异小杆线虫(Heterorhabditisbacteriophora-HBN)为研究对象,对其冷冻储存条件进行优化。结果显示,介质中不同含水量对线虫HBN的冷冻存活率有着显著的影响;其中含水量为50%的蛭石中线虫回收率最高,为87.4%;冷冻储存后的线虫经4 ℃ 24 h+室温1 h解冻利于线虫冷冻休眠后复苏;线虫经阶段性降温较直接降温至-4 ℃的冷冻存活率提高31.6百分点;储存介质蛭石中采用灭菌自来水较适于HBN线虫在-4 ℃冷冻存活;7 d内冷冻储存增强了HBN线虫对寄主昆虫的侵入能力。
昆虫病原线虫; 冷冻储存; 存活率; 侵入力
昆虫病原线虫(entomopathogenic nematode,EPN)是指体内携带具有病原性的共生细菌能引起寄主昆虫致病的一类寄生性线虫,是昆虫的重要天敌类群,对200多种昆虫有致病作用[1],这种新型生物杀虫剂具有广阔的应用前景。但该线虫常温储存货架期短,是其推广应用的主要障碍因素之一。该线虫在低温下处于静止休眠状态,新陈代谢速度减慢、体能消耗减少,从而可延长线虫货架期。所以,当今学者们对低温储存尤为感兴趣,但适于低温储存的材料和储存技术尚未解决。
李春杰等[2]根据寒区昆虫病原线虫在黑龙江省越冬的自然环境条件调查结果,对其室内低温储存条件进行了初步筛选,但如何提高线虫冷冻后的存活率仍需进一步研究。储存介质种类和湿度、解冻方法、降温速度和介质中的溶液均影响着冷冻储存后线虫的存活和线虫对寄主的侵染能力。不同种线虫对降温速度表现出明显的差异,芜菁夜蛾斯氏线虫(Steinernemafeltiae)经过直接降温后,低温存活率显著提高;而嗜菌异小杆线虫(Heterorhabditisbacteriophora)经过阶段性降温驯化后,其低温存活率较直接降温后的存活率明显增加[3]。Grewal等[4]的研究表明,阶段性降温使斯氏线虫S.carpocapsae和S.riobrave所获得的耐寒性好于直接降温。适宜的渗透压可使线虫慢速脱水,有利于线虫的储存[5-6]。杨秀芬等[7]的试验证实了低温诱导有助于培育斯氏线虫适应0 ℃以上的低温特性,但返回25 ℃培养2个侵染循环后这种特性有不同程度的丧失。
很多研究者通过多种方法可提高昆虫病原线虫在0 ℃以上暂时的耐寒性,而作者以我国高寒地区分离、筛选的高致病力线虫为研究对象,该线虫对寒冷地区生态适应能力强。根据该线虫能在黑龙江省越冬的自然现象及其低温储存潜力挖掘[2,8],其耐寒性和室内储存温度、介质的种类和线虫的储存浓度等已得到初步探索[9-11],通过进一步对线虫冷冻储存条件进行优化,试图提高冷冻后的存活率,以挖掘冷冻储存潜力,为改善昆虫病原线虫储存技术提供依据,从而加快我国寒区高致病力线虫的开发应用速度。
1 材料与方法
1.1 试验材料
1.1.1 供试线虫
从黑龙江省哈尔滨市松树下土壤中分离得到的高致病力的昆虫病原线虫,由加拿大线虫博物馆鉴定,为嗜菌异小杆线虫哈尔滨品系[H.bacteriophora-HBN(HBN)]。供试寄主昆虫为大蜡螟(Galleriamellonella)幼虫,从天津中垦进出口公司购买。
1.1.2 试验仪器和器皿
DHP-9162 a恒温培养箱(天津市泰斯特仪器有限公司)、BCD-226 sTV控温冰箱(青岛海尔股份有限公司)、S633069冷光源解剖镜(麦克奥迪实业集团有限公司)、LDZX-40 sCI高压灭菌器(上海市申安医疗器械厂)、200 mL玻璃瓶、直径60 mm的塑料培养皿、直径90 mm的玻璃培养皿和12孔细胞培养板。
1.2 试验方法
1.2.1 储存介质对线虫的冷冻存活及回收率的影响
选择蛭石、海绵、沙土(沙和土质量比为1∶1)和珍珠岩4种介质。试验所用的昆虫病原线虫HBN采用White-Trap繁殖法[12-13],新繁殖出来的线虫于10 ℃保存7 d备用。称取不同介质各10 g装在200 mL玻璃瓶内,根据目前该实验室对不同储存介质含水量初筛结果[8],每种介质设4个不同含水量(按介质和水的质量比),蛭石含水量设40%、50%、60%、70%,海绵含水量设20%、30%、40%、50%,沙土含水量设8%、10%、12%、14%,珍珠岩水量设80%、90%、100%、110%,共16个处理,每个处理6瓶,每瓶分别加入105条HBN侵染期线虫。将所有处理直接于-4 ℃储存5 d,然后拿出玻璃瓶于室温1 h后收集介质中线虫。介质为蛭石、海绵和珍珠岩的用80目和500目套筛过滤,收集500目上的线虫悬浮液,悬液再用蔗糖梯度离心法[14],收集各处理中的线虫,沙土中的线虫直接用蔗糖梯度离心法收集。每种介质中选择线虫存活率最高的1个含水量,计算回收到的线虫占起初存放介质中线虫量的比例,即回收率。在解剖镜下调查收集到线虫的存活率。
1.2.2 解冻方法对线虫冷冻存活的影响
向含水量为50%的10 g蛭石中加入105条HBN侵染期线虫,共18瓶。-4 ℃直接冷冻5 d,然后按不同方法解冻,(1)室温解冻24 h:把冷冻后的样品直接放在室温下解冻24 h;(2)水中直接解冻:室温下直接加水、浸泡1 h解冻;(3)4 ℃解冻24 h:把冷冻后的样品放在4 ℃冰箱中解冻24 h,然后再置于室温1 h。6瓶为一个处理,分别采用不同方法解冻,收集解冻后样品中的线虫,显微镜下记录线虫的存活情况,计算冷冻后经不同方法解冻后线虫的存活率。
1.2.3 降温方式对介质中线虫冷冻存活的影响
称取蛭石、沙土(1∶1)、海绵和珍珠岩各10 g装在玻璃瓶内,每种中介质线虫储存浓度均为104条/g,选择4种介质中线虫存活率最高的含水量分别为12%、50%、30%和100%。每个处理12瓶,共48瓶,平均分成两组,一组降温方式为直接降温法,即直接于-4 ℃储存5 d,另一组为阶段式降温,以1 ℃/10 min速度降温,于-1 ℃存放1 h,然后再以1 ℃/10 min速度降温至-4 ℃储存5 d[10-11]。然后升温至4 ℃保持24 h,于室温放置1 h后调查其存活率。
1.2.4 介质中溶液对线虫冷冻存活的影响
介质中溶液设置灭菌蒸馏水(SDW)、非灭菌自来水(ATW)、灭菌自来水(SATW)、0.1 mol/L的NaCl和M9 Buffer 5种不同溶液进行-4 ℃储存5 d,降温方式采用阶段式降温法,解冻方法采用4 ℃解冻24 h再室温1 h的方式,显微镜下记录线虫的存活情况,计算不同溶液中冷冻后线虫的存活率。
M9 Buffer:Na2HPO46 g, KH2PO43 g, NaCl 5 g, MgSO40.128 g, DDW 1 L,121 ℃湿热灭菌20 min。
1.2.5 冷冻对线虫侵入寄主能力的影响
将大蜡螟末龄幼虫放入12孔细胞培养板中,每孔一头幼虫,孔内垫有2层湿润滤纸。将冷冻3、5和7 d后收集的活线虫与大蜡螟幼虫按5∶1接种,以未经冷冻处理的线虫HBN作为对照,共5个处理,每个处理3个板。接种后于25 ℃恒温培养箱中,48 h从细胞培养板中取出死亡大蜡螟幼虫,用清水冲洗。置于25 ℃培养箱中,48 h后解剖死亡大蜡螟幼虫,解剖镜下检查大蜡螟幼虫体内的雌虫数量,雌虫是由侵入大蜡螟幼虫体内的侵染期线虫发育而成,从而可计算出线虫的侵入率。
侵入率(%)=侵入大蜡螟体内的雌虫数/侵染每头大蜡螟所用的线虫数×100。
1.3 数据统计与分析
所有试验重复3次,调查的原始数据经Excel处理和SPSS 11.5软件分析,计算所得百分数经反正弦平方根转换,然后采用单因素0.05水平方差分析(One-Way ANOVA)和LSD多重比较检验各处理间的差异显著性。
2 结果与分析
2.1 储存介质对线虫的冷冻存活及回收率的影响
2.1.1 介质含水量对线虫冷冻存活率的影响
不同种储存介质中的线虫冷冻后存活率存在差异,其中珍珠岩中的最高存活率显著低于其他3种介质中的最高存活率。不同含水量介质对HBN线虫低温储存后的存活率也有着明显影响。含水量为50%的蛭石中线虫存活率最高,为47.6%,含水量为70%的蛭石中线虫存活率最低,为27.9%(图1a);含水量30%的海绵中线虫存活率最高,为41.5%,含水量50%时线虫存活率最低,为15.6%(图1b);含水量12%的沙土中线虫存活率最高,为50.3%,含水量14%时线虫存活率最低,为20.9%(图1c);含水量100%的珍珠岩中线虫存活率最高,为34.3%,含水量80%时线虫存活率最低,为13.7%(图1d)。可见4种介质中线虫最高存活率和最低存活率之间差异均显著(P<0.05),并且除珍珠岩外其他3种介质中含水量最高的线虫存活率最低。

图1 介质含水量对线虫冷冻存活率的影响
2.1.2 储存介质对线虫回收率的影响
选择4种介质中存活率最高的一种含水量,计算介质中HBN线虫的回收率,结果显示(图2),含水量50%蛭石中的线虫回收率最高,为87.4%,其次是含水量12%的沙土为75%,含水量100%珍珠岩为58.3%,含水量30%的海绵为14.7%。只有回收率高才有利于线虫的高效应用,即应用时从介质中释放线虫效率高。因为含水量为50%蛭石中的线虫存活率和回收率均最高,所以含水量为50%的蛭石较适合HBN的-4 ℃冷冻储存。可能是由于不同介质的结构不同使线虫向外游离时所受阻力不同,导致线虫游离速度不同。

图2 不同储存介质对H. bacteriophora-HBN回收率的影响
2.2 解冻方法对线虫存活的影响
含水量为50%蛭石中的HBN线虫于-4 ℃直接冷冻5 d后,分别经过不同方法解冻。其中,4 ℃解冻24 h后再置于室温1 h后线虫存活率最高,为59.8%(图3),于室温解冻24 h后线虫存活率次之,为45.5%,水中直接解冻线虫存活率最低,为37.4%。试验表明线虫在冷冻后需要一定的解冻条件,才能恢复其活性,但不同的解冻条件对线虫复苏后的存活率有一定影响。可以看出3种解冻方式中,4 ℃24 h的解冻方式有利于线虫HBN的冷冻存活,直接于室温解冻和水中直接解冻线虫存活率较低。
2.3 降温方式对介质中线虫冷冻存活的影响
2.3.1 最佳含水量的不同介质对线虫冷冻存活的影响
两组线虫于-4 ℃冷冻5 d后,回收4种介质中的线虫HBN,显微镜下线虫存活率调查结果显示(图4),不同储存介质对HBN冷冻存活的影响很明显。经过阶段性降温后再-4 ℃储存的一组,含水量为50%的蛭石中HBN存活率最高,为79.2%,其次含水量30%的海绵中HBN存活率为77.2%,含水量12%的沙土为70.1%,含水量100%珍珠岩为35.6%。复苏后镜下观察蛭石和海绵中的线虫活动较沙土和珍珠岩中的线虫活跃很多,分析原因可能是沙土和珍珠岩中储存的线虫因缺氧而窒息,尤其是珍珠岩中的线虫活动能力很差。可以看出含水量50%的蛭石中和含水量30%的海绵宜于HBN的冷冻储存。

图3 解冻方式对HBN线虫存活率的影响

图4 介质和降温方式对H. bacteriophora-HBN 冷冻存活率的影响
2.3.2 降温速度对线虫冷冻存活的影响
降温速度对线虫HBN在-4 ℃下储存5 d的冷冻存活有着明显的影响(图4)。除了含水量100%珍珠岩外,采用阶段性降温法的3种储存介质中的线虫冷冻存活率显著高于直接降温法(P<0.05)。含水量为50%的蛭石中HBN较直接降温的存活率高出31.6百分点,在含水量为30%的海绵中较直接降温的存活率高出35.7百分点,在含水量为12%的沙土中较直接降温的存活率高出19.8百分点,在含水量为100%珍珠岩中HBN较直接降温的存活率仅高出1.3百分点。可以看出采用逐步缓慢降温法有利于含水量为50%的蛭石、30%的海绵和12%的沙土中HBN线虫体内脱水休眠,提高其冷冻存活率。
2.4 介质中溶液对线虫冷冻存活的影响
含50%灭菌自来水的蛭石中线虫HBN存活率最高,为79.2%,显著高于未灭菌自来水(图5),但与M9 Buffer、0.1 mol/L NaCl和灭菌蒸馏水差异不显著。

图5 不同液体渗透压对H. bacteriophora-HBN冷冻存活的影响
2.5 冷冻储存后对线虫侵入寄主能力的影响
冷冻后HBN线虫侵入大蜡螟体内的比例较未冷冻的明显增加(图6)。-4 ℃冷冻3、5和7 d后线虫侵入率均达40%以上,差异不显著,但均显著高于未冷冻(CK)的侵入率(P<0.05),并较未冷冻的侵入率高出10百分点以上。
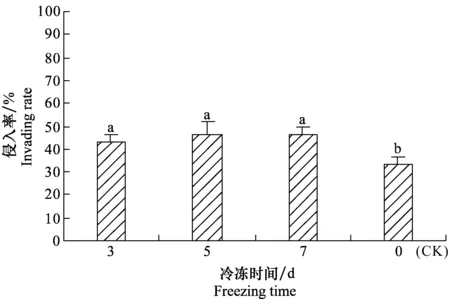
图6 冷冻后HBN线虫对大蜡螟的侵入率
3 讨论
从昆虫病原线虫分布来看,嗜菌异小杆线虫在加拿大、丹麦、爱尔兰和俄罗斯等地均有分布[1],可以看出昆虫病原线虫能够忍受0 ℃以下的低温,并在这些寒冷地区长期生存。而在中国曾在广东、山东和河北分离到嗜菌异小杆线虫[15-16],笔者虽然在黑龙江省已经分离到了嗜菌异小杆线虫[2],但对其耐寒性的利用值得探讨。该研究表明寒区昆虫病原线虫HBN于-4 ℃的最佳储存介质为含水量50%的蛭石,该介质利于线虫的冷冻存活和应用时的释放;采用阶段性降温和冷冻后采用4 ℃ 24 h再置于室温的解冻方法,冷冻过程中介质中的溶液采用灭菌自来水,这些条件较适合线虫在低温下脱水和解冻时复原,更利于线虫HBN的冷冻存活,并且-4 ℃下冷冻储存7 d内线虫对寄主昆虫的侵染活性增强。该研究结果将为寒区昆虫病原线虫实行低温储存提供可靠依据,为该线虫的研发及今后当地害虫防治打下良好基础。
线虫的脱水能力在其冷冻存活过程中起着重要的作用,低湿休眠状态极利于无脊椎动物的冷冻存活[17]。低湿休眠利于线虫的长期储存,可提高Steinernemacarpocapsae的存活率,延长寿命3个月,也提高了它对不利环境的适应性[3]。储存介质及介质含水量对线虫的脱水速度有着很大的影响。因为介质中含水量大,不利于线虫冷冻过程中体内向外脱水进入休眠,线虫体内较大的含水量使线虫体内迅速结冰,细胞体积膨大至破裂,最终导致线虫死亡。由于不同介质的结构不同使其蓄水能力和含氧量不同,影响了线虫的冷冻存活。提高病原线虫存活率有多种方法,通过利用甘油和离子溶液混合可增强线虫S.carpocapsae‘All’的耐寒性[5]。Chen和Glazer[18]通过逐渐增加溶液渗透压提高线虫的存活率。该研究中0.1 mol/L的NaCl中的HBN于-4 ℃冷冻5 d的存活率稍高于人工自来水中的HBN,但又稍低于灭菌人工自来水。可能是M9 Buffer和0.1 mol/L NaCl中的离子浓度偏高,使得线虫体内脱水过多而干死,灭菌蒸馏水中离子浓度太低,不利于线虫体内的冷冻脱水,使得线虫冷冻过程中体内结冰致死。
Wharton等[19]认为线虫的低温存活率与冷却速率有关。在快速结冰环境中,部分线虫由于不断增长的冰晶而受到机械损伤,造成体内物质从皮层伤口处流出,而较慢的冷却速率可以抑制接种性结冰,有助于线虫低温存活。同时,缓慢降温使线虫产生保护性脱水,进行低湿休眠。试验中阶段性降温利于线虫体内脱水进入低湿休眠,也证实了以前学者的观点。同样,线虫的冷冻存活率也受到解冻速度的影响。由于线虫在经历低温后进入休眠状态,低温过程中线虫脱去体内多余的水,以防止发生结冰造成伤害,而迅速升温后线虫吸水,细胞急剧膨胀,破坏了细胞膜的弹性,最终细胞膜破裂导致线虫死亡,存活率降低。所以缓慢升温利于细胞的复原。
通过蒸发胁迫[20]和高渗脱水[21],侵染期小卷蛾斯氏线虫(S.carpocapsae)安全脱水休眠,加水后脱水休眠的线虫在1 h 内复苏后侵染力没有受到不良影响。Brown等[22]报道了S.riobravis、S.carpocapsae和S.glaseri3种线虫经低温处理后,线虫的侵染力没有显著变化。通常情况下,昆虫病原线虫无论接种量多少,由于线虫间的相互竞争,只有一部分个体表现出较强的侵染能力,而其他的线虫处于非活跃状态。该试验中0 ℃以下的低温储存过程中线虫消耗了体能,解冻后线虫处于饥渴状态,侵入寄主取食的欲望更加强烈,所以短期冷冻储存增强了HBN线虫的侵染活性。
本研究利用耐寒性很强的寒区昆虫病原线虫,对其冷冻储存条件的进一步筛选,得到了适宜的储存介质、介质中的溶液和降温方式,但是关于该昆虫病原线虫的耐寒机制还不清楚,如受低温胁迫线虫体内产生的一系列生理生化反应,包括胁迫脱水、改变代谢酶活性、饱和脂肪酸转换为非饱和脂肪酸、累积海藻糖以及合成新同工酶等[23]。受低温胁迫时还涉及一系列相关基因的激活与沉默,最终体现为线虫对环境胁迫的耐受能力,这是一个错综复杂的网络式调控体系,需要逐步探索。
[1]Gaugler R. Entomopathogenic nematology[M]. Wallingford: CABI Publishing, 2002.
[2]李春杰,谭国忠,王义,等.黑龙江省昆虫病原线虫资源和越冬情况调查初报[J].植物保护,2011,37(2):120-123.
[3]Brown I M,Gaugler R. Cold tolerance of Steinernematid and Heterorhabditid nematodes[J].Journal of Thermal Biology,1996,21(2):115-121.
[4]Grewal P S.Enhanced ambient storage stability of an entomopathogenic nematode through anhydrobiosis[J].Pest Management Science,2000,56(5):401-406.
[5]Glazer I,Salame L.Osmotic survival of the entomopathogenic nematodeSteinernemacarpocapsae[J].Biological Control,2000,18:251-257.
[6]Feng S P,Han R C,Qiu X H,et al.Storage of osmotically treated entomopathogenic nematodeSteinernemacarpocapsae[J].Insect Science,2006,13:263-269.
[7]杨秀芬,杨怀文,简恒,等.低温诱导培养对夜蛾斯氏线虫A54品系适低温特性的影响[J].植物保护,1999,25(3):8-10.
[8]谭国忠.北方寒区昆虫病原线虫越冬条件研究[D].哈尔滨:东北农业大学,2008.
[9]王丽芳.寒区昆虫病原线虫耐寒性和生存策略[D].哈尔滨:中国科学院东北地理与农业生态研究所,2010.
[10]李春杰,许艳丽.一种用于寒区嗜菌异小杆昆虫病原线虫冷冻储存方法:中国,ZL 200910071751.1[P].2009-04-09.
[11]李春杰.寒区昆虫病原线虫低温储存条件及耐寒机制研究[D].哈尔滨:东北农业大学,2011.
[12]White G F. A method for obtaining infective nematode larvae from cultures[J].Science,1927,66:302-303.
[13]Dutky S R,Thompson J V,Cantwell G E. A technique for the mass propagation of the DD-136 nematode[J].Journal of Invertebrate Pathology,1964,6:417-422.
[14]Saunders L M,Tompkins D M,Hudson P J. Spatial aggregation and temporal migration of free-living stages of the parasitic nematodeTrichostrongylustenuis[J].Functional Ecology,2000,14:468-473.
[15]陈书龙,李秀花,Maurice Moens.河北省异小杆类昆虫病原线虫种类鉴定[J].华北农学报,2005,20(5):89-95.
[16]韩日畴.中国昆虫病原斯氏和异小杆线虫的研究概况[J].昆虫学报,1994,1(4):346-364.
[17]Masahiko W.Anhydrobiosis in invertebrates[J].Applied Entomology and Zoology,2006,41(1):15-31.
[18]Chen S B,Glazer I. Effect of rapid and gradual increase osmotic stress to survival of entomopathogenic nematodes[J].Phytoparasitica,2004,32(5):486-497.
[19]Wharton D A,Goodall G,Marshall C J.Freezing rate affects the survival of a short-term freezing stress inPanagrolaimusdavidi,an Antarctic nematode that survives intracellular freezing[J].Cryoletter,2002,23:5-10.
[20]陈松笔,杨怀文,蒋书楠. 脱水休眠对斯氏线虫BJ品系活力的影响[J].中国生物防治,1998,14(3):112-115.
[21]Womersley C Z. Dehydration survival and anhydrobiotic potential[M]∥Gaugler R, Kaya H K, eds. Entomopathogenic Nematodes in Biological Control. Boca Raton:CRC Press, 1990:117-137.
[22]Brown I M,Gaugler R. Survival of Steinernematid nematodes exposed to freezing[J]. Journal of Thermal Biology,1998,23:75-80.
[23]Grewal P S,Bornstein-Forst S,Burnell A M, et al.Physiological, genetic, and molecular mechanisms of chemoreception, thermobiosis and anhydrobiosis in entomopathogenic nematodes[J].Biological Control,2006,38:54-65.
OptimizingfreezingstorageconditionsfortheentomopathogenicnematodeisolatedfromthecoldregioninChina
Li Chunjie1, Tan Guozhong1, Wang Yi2, Xu Yanli1
(1.KeyLaboratoryofMollisolsAgroecology,NortheastInstituteofGeographyandAgroecology,ChineseAcademyofSciences,Harbin150081,China; 2.RutgersUniversity,NewJersey08901,USA)
One high-virulence strain of EPNs,Heterorhabditisbacteriophora-HBN (HBN) with cold tolerance isolated from Harbin City was used in the laboratory in this study. Storage substance species and moisture, cooling rate, thawing ways and osmotic pressure of solution in the substances were optimized. The results showed that freezing survival of HBN were significantly affected by the substances with different water contents. Recycling coefficient ofH.bacteriophora-HBN in the vermiculite with water content of 50% was the highest (87.4%). The way of freezing HBN at room temperature for 1h following 4 ℃ for 24h was in favor of thawing of freezing dormancy. Freezing survival rate of HBN by phasic cooling pattern was increased by 31.6 percent than by direct cooling to -4 ℃. Sterilized artificial tap water in vermiculite was conducive to anhydrobiosis of HBN. The ability of HBN infectingGalleriamellonellawas enhanced in the short-term freezing storage in seven days.
entomopathogenic nematode; freezing storage; survival rate; infective ability
2013-10-15
:2014-01-25
国家科技计划农业成果转化项目(2007GB24910482);中国科学院知识创新工程重要方向项目(KSCX2-YW-N-092);黑龙江省青年科学基金项目(QC2010070);哈尔滨市科技创新人才项目(2009RFQYN092)
S 476.15
:ADOI:10.3969/j.issn.0529-1542.2014.05.009
致谢:感谢加拿大线虫博物馆郁庆馆长在线虫鉴定工作方面给予的帮助。
* 通信作者 E-mail: xyll@neigaehrb.ac.cn
