杜仲内生真菌中抗玉米纹枯病活性菌株的筛选
2014-08-10孙微微江海洋
丁 婷, 孙微微, 王 帅, 江海洋
(1.安徽农业大学植物保护学院,合肥 230036; 2.安徽省作物生物学重点实验室, 合肥 230036)
杜仲内生真菌中抗玉米纹枯病活性菌株的筛选
丁 婷1, 孙微微1, 王 帅1, 江海洋2*
(1.安徽农业大学植物保护学院,合肥 230036; 2.安徽省作物生物学重点实验室, 合肥 230036)
对杜仲植物中的内生真菌进行分离纯化,共得到 32株菌株。以玉米纹枯病菌为指示菌,对杜仲内生真菌进行对峙培养法、菌丝生长速率法以及盆栽控病试验等研究。研究结果显示,内生真菌DZGS08对玉米纹枯病菌具有较好的拮抗作用,抑菌带宽度大于10 mm;其菌丝生长速率试验显示DZGS08的发酵液抑菌率达到50.44 %;且玉米盆栽试验结果表明,菌株DZGS08发酵液对玉米纹枯病的防治效果为34.03%。显微观察结果表明,拮抗菌株DZGS08能造成病原菌菌丝扭曲、畸形等现象。随后,对该菌株的ITS 序列进行测定分析,序列分析和聚类结果表明该菌株为梭孢壳属(Thielavia)的真菌。
玉米纹枯病菌; 杜仲; 抑菌机理
玉米纹枯病(maize sheath blight)又称玉米尖眼点病,于1966年在我国吉林省首次发现,随着玉米种植面积的扩大,高产密植技术的应用、玉米主产区的多年连作以及防治措施的不恰当,使得玉米纹枯病的发病率逐渐增加[1-4],成为我国玉米产区的重要病害之一。迄今为止,对玉米纹枯病的防治主要以抗病品种选育和化学药剂防治为主[5-6]。然而化学农药在使用过程中容易造成环境污染、药害、农产品农药残留超标、农田生态平衡与生物多样性被破坏等问题。因此,运用生物防治手段控制玉米纹枯病已成为研究的热点和重点。植物内生真菌通常是指一类全部或部分生活史是在健康植物体的根、茎及叶等组织中的细胞间隙或者细胞内度过的真菌,其在植物体内的存在不引起植物组织明显的感染症状,是植株整个微生态系统的重要组成部分[7]。相关研究表明,部分植物内生菌本身及其次生代谢产物不仅可以促进宿主植物的生长发育[8-9],提高植物抗逆、抗虫、抗病的能力[10-11],且能增强植物对病原菌的抗性[12-14]。因此,围绕植物内生真菌及其代谢物所开展的研究正在兴起,在此基础上开发新型生物源农药也成为农药研发工作的重点。
杜仲(EucommiaulmoidesOliv.)是我国名贵的中药材之一。本研究利用组织分离法对杜仲的健康组织进行内生真菌的分离纯化,并以玉米纹枯病菌为指示菌,通过平板对峙培养、菌丝生长速率检测等离体方法,结合玉米盆栽活体试验,进行杜仲内生真菌中抗玉米纹枯病菌活性菌株的分离、筛选以及鉴定等研究,研究结果将为植物病害的防治提供新型的生防资源,对药用植物杜仲的深度开发提供理论基础。
1 材料与方法
1.1 材料
1.1.1 植物材料
杜仲叶、茎、果实等健康组织,均采自于安徽农业大学校园种植的杜仲。
1.1.2 供试玉米品种及植物病原真菌
玉米品种为‘郑单958’;玉米纹枯病菌(Rhizoctoniasolani),菌株编号Ywk-3,均由安徽农业大学植物保护学院病理教研室提供。
1.1.3 培养基
内生真菌分离培养基:WA-抗生素培养基(马铃薯200 g,葡萄糖20 g,琼脂粉15 g,氨苄青霉素200 mg,链霉素200 mg,水1 000 mL,pH自然);玉米纹枯病菌培养以及内生真菌纯化培养基:马铃薯葡萄糖培养基(PDA);内生真菌发酵培养基:PD培养液。
1.1.4 主要试剂
NaClO、CTAB提取液、氯仿、异戊醇、2×EasyTaqPCR SuperMix(TaKaRa)、10×Loading Buffer(TaKaRa)、DNA Marker(TaKaRa)、PCR产物回收试剂盒(TaKaRa)、通用引物ITS1和ITS4(南京金斯瑞);75%百菌清可湿性粉剂(先正达(苏州)作物有限公司)。
1.2 试验方法
1.2.1 内生真菌的分离和纯化
取杜仲的健康组织(叶、茎和果实),参照帖卫芳等[15-16]的组织分离法,进行内生真菌的分离,并采用组织印迹法对消毒效果进行验证:将涂布有最后1次无菌水冲洗液的PDA平板置于28 ℃培养箱中避光培养3~5 d,观察有无菌落产生,若平板表面无真菌生长,则表明杜仲组织表面灭菌彻底,所分离获得的是杜仲内生真菌而不是表面附生菌,否则,不能使用。平板培养2~3 d后,待培养组织边缘有菌丝长出时,采用尖端菌丝挑取法,挑取形态不同的菌落转移到新的培养基上继续培养,直至产生单一菌落。经过2~3次纯化,得到纯化菌株,对已纯化的菌株编号,转至 PDA 斜面培养基上,于25 ℃培养箱中培养5~7 d,然后放入4 ℃的冰箱内保藏备用。
1.2.2 杜仲拮抗内生真菌的筛选
1.2.2.1平板对峙法
采用平板对峙培养法[17],用内径为6 mm的打孔器分别在培养5~7 d的内生真菌和玉米纹枯病菌的新鲜菌落边缘打取菌饼,沿培养平板(直径90 mm)直径接种同质等量的内生真菌和病原菌的菌饼各一块,两点距中心均为35 mm。同时以只接病原菌的平板作为对照,每处理均设3个重复,置于25 ℃下黑暗恒温培养。观察各内生真菌与病原菌菌落边缘之间是否有抑菌圈产生,待对照长满皿时,测量抑菌带宽度(抑菌带宽度为内生真菌菌落边缘与玉米纹枯病菌菌落边缘之间的距离),根据抑菌带宽度评价其拮抗效果。
1.2.2.2带毒平板法
用内径为6 mm的打孔器在内生真菌新鲜菌落边缘打取菌饼,分别接种10个菌饼于装有200 mL PD培养液的锥形瓶中,置于25 ℃、180 r/min的摇床,黑暗培养10 d。发酵结束后,发酵产物经5 000 r/min离心10 min,取上清液真空冻干,冻干粉用无菌水配制成2 mg/mL的母液,经0.22 μm微孔滤膜过滤后置于4 ℃冰箱中保存备用。
内生真菌发酵液的抑菌试验:采用菌丝生长速率法测定内生真菌代谢产物的抑菌活性, 在装有10 mL PDA培养基的无菌培养皿中加入发酵母液若干(内生真菌发酵液冻干粉的最终含量为1 mg/皿),并迅速混匀, 制成含药培养基,冷却后在每个平板中央放置直径5 mm的供试菌的菌饼,以添加PD培养液作为阴性对照、以加入75%百菌清可湿性粉剂(100 μg /皿)作为抑菌试验的阳性对照。每处理和对照均设3个重复,置于25 ℃培养箱避光培养7 d,待阴性对照皿长满菌后,十字交叉法测量菌落直径,按下面的公式计算发酵滤液对菌丝生长的抑制率:
菌落生长距离=菌落平均直径-5 mm;
抑制率(%)=(对照菌落生长距离-处理菌落生长距离)/对照菌落生长距离×100。
1.2.3 菌株DZGS08对玉米纹枯病菌拮抗作用的显微观察
灭菌载玻片中央放置15 mm×10 mm的无菌PDA薄膜一块,然后挑取等量的DZGS08和玉米纹枯病菌菌丝分别接种于PDA薄膜两平行边的中点,将其放置于25 ℃恒温培养箱内黑暗保湿培养,逐天镜检两菌的相互作用并显微拍照。
1.2.4 菌株DZGS08对玉米纹枯病的防效评价
将玉米种子播种于盆钵中(盆钵口径为30 cm),每盆2株,进行常规管理,待其进入拔节期的10~12叶期,进行玉米纹枯病防治试验,参照1.2.2.1中的方法打取玉米纹枯病菌菌饼,在每株玉米植株近地面的第1叶鞘内嵌入3 块菌饼,接种后,保持盆钵土壤湿润,3 d后进行不同处理,每处理10株玉米,处理①:喷清水;处理②:喷DZGS08发酵液(发酵液处理方法同1.2.2.2,浓度为2 mg/mL,并经孔径0.22 μm的细菌过滤器过滤除菌)50 mL;处理③:喷百菌清溶液50 mL(75%百菌清可湿性粉剂先用少量丙酮溶解,再用无菌水配成200 mg/L的溶液)。在玉米蜡熟期,病情基本稳定后,逐株调查记载病情级别。玉米纹枯病的病级记载采用国际小麦玉米改良中心(CIMMYT)提供的病级分级标准[18]。按照以下公式计算各处理的病情指数并计算防效:
病情指数=

1.2.5 活性菌株DZGS08分子鉴定
CTAB法提取DZGS08菌株的基因组DNA,利用真菌核糖体基因转录间隔区(ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCGTTATTGATATGC-3′)扩增菌株的ITS和5.8 S rDNA序列。参照Kim[19]的PCR反应采用50 μL反应体系[16],反应条件为:94 ℃预变性3 min;94 ℃变性 30 s、55 ℃退火 30 s、72 ℃延伸 45 s,35个循环;最后 72 ℃延伸 5 min。PCR产物经1.0%琼脂糖凝胶电泳检测后,送上海生工生物工程技术服务有限公司测序。
所得菌株的ITS序列在NCBI网站上利用BLAST软件与GenBank中已知属种的ITS进行序列比对和同源性分析,选取比对后指标靠前的相似序列和分类比较相近的种属序列,利用MEGA 4.1软件对所获菌株DZGS08的ITS部分序列进行多重序列比对,并采用邻接法(neighbor-joining, NJ)构建系统发育树,用Bootstrap软件对进化树进行1 000次可信度分析,根据系统发育树中的组群关系对菌株进行分类。
2 结果与分析
2.1 杜仲内生真菌的分离和鉴定
从杜仲的健康叶、茎和果实中共分离到32株内生真菌,其中叶部14株,占分离总株数的43.74%;茎9株,占分离总株数的28.13%;果实9株,占分离总株数的28.13%(表1),即:内生真菌在杜仲叶部分布最多,茎部居中,而果实内较少。此外,杜仲内生真菌在种群组成上具有多样性,分离纯化获得的32株内生真菌在种群类别及杜仲不同组织中的分布数量如图1所示,32株内生真菌共归为9个属,其中,在杜仲3个部位中均有分布的为黑孢霉属(Nigrospora)、拟茎点霉属(Phomopsis)、炭疽菌属(Colletotrichum)3个属,且炭疽菌属的菌株数量最多,在分离得到的32株内生真菌中有12株属于炭疽菌属,占分离菌株总数的37.50%;此外,一些属在杜仲组织中有着特异专化性,如仅在叶中分布的拟盘多毛孢属(Pestalotiopsis)、肉座菌属(Hypocrea),仅在杜仲果实中有所分布的梭孢壳属(Thielavia)、葡萄座腔属(Botryosphaeria)。
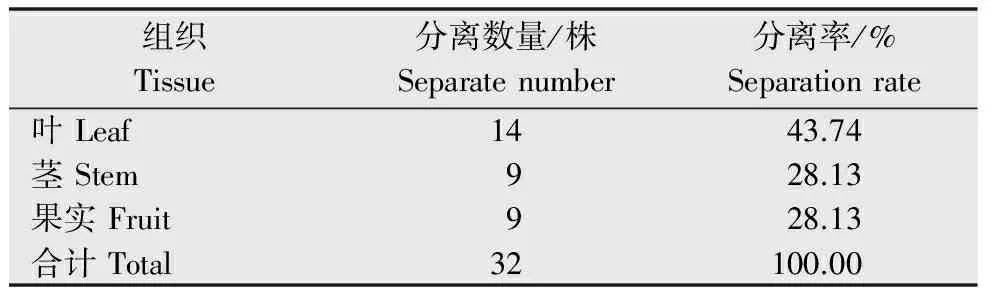
表1 杜仲不同组织内生真菌的分离结果Table 1 Isolation of endophytic fungi fromdifferent tissue of E.ulmoides
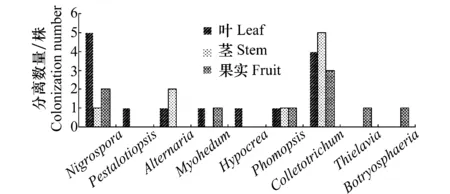
图1 杜仲组织中分离的内生真菌数量及种类Fig.1 The number and taxa of endophytic fungi isolatedfrom leaves, stems and fruits of E.ulmoides
2.2 玉米纹枯病拮抗菌株筛选
以玉米纹枯病菌为指示菌,对32株杜仲内生真菌进行平板对峙筛选试验,结果如表2所示,有22株内生真菌显示出对玉米纹枯病菌的抑制作用,占分离得到的内生真菌总数的68.75%,其中,12株内生真菌的抑菌带宽度在0~5 mm之间,9株内生真菌的抑菌带宽度在5~10 mm之间,仅有菌株DZGS08抑菌带宽度为13.06 mm,对玉米纹枯病菌的抑菌效果最好。
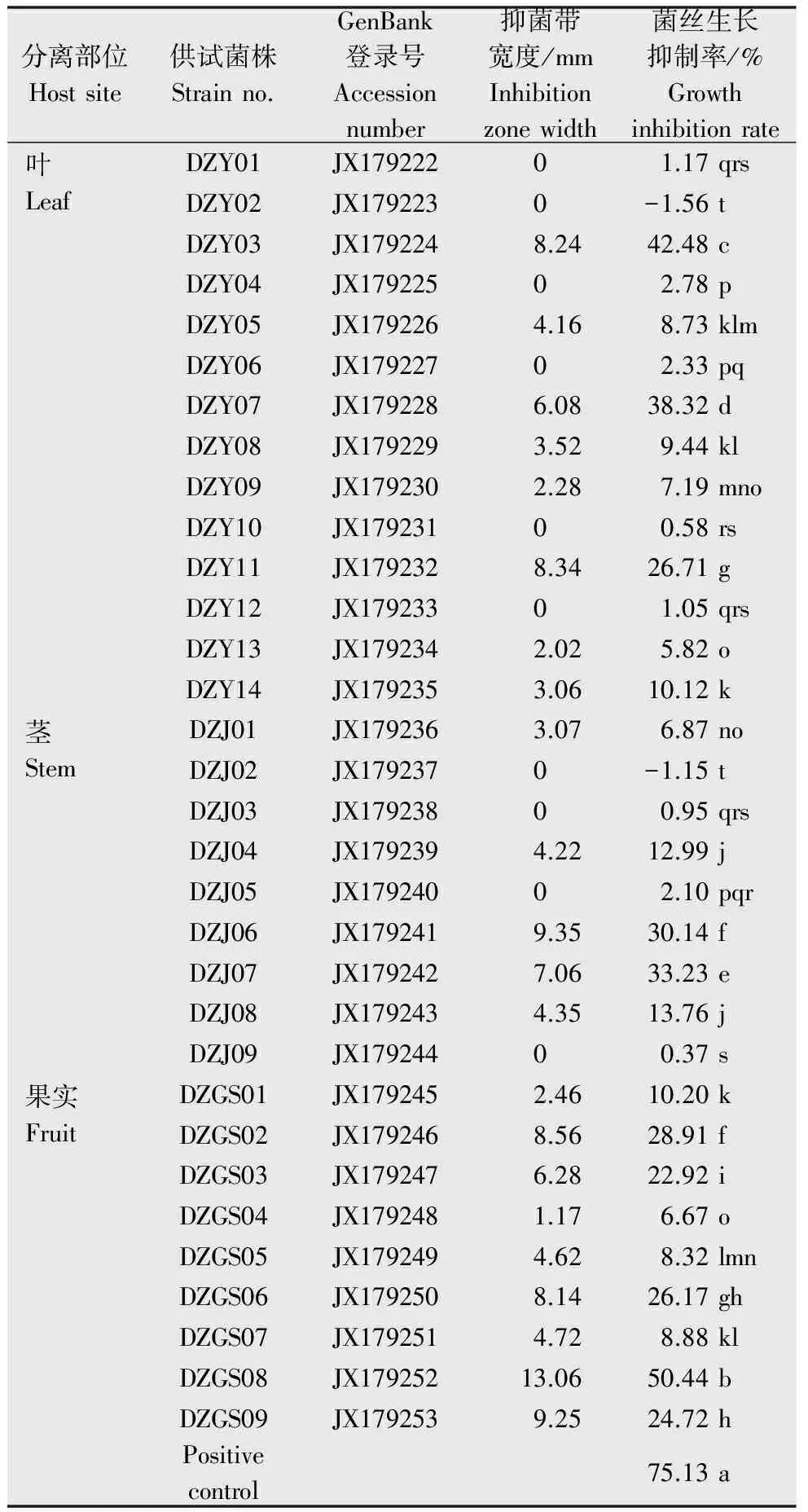
表2 杜仲内生真菌对玉米纹枯病菌菌丝生长的抑制作用1)Table 2 Antifungal activities of endophytic fungifrom E.ulmoides against R.solani
1) 同列数字后不同英文字母表示在P=0.05水平上差异显著(Duncan多重比较法)。
The data followed with different letter in the same column are significantly different atP=0.05 by Duncan′s test.
采用菌丝生长速率法,以玉米纹枯病菌为指示菌,对32株杜仲内生真菌的发酵液进行抑菌活性的筛选。结果表明杜仲内生真菌中含有着丰富的抗玉米纹枯病菌资源,在32株内生真菌发酵液中,有30株内生真菌次生代谢产物(即发酵液)对玉米纹枯病菌有不同程度的抑制效果(见表2),抑制率在0.37 %~50.44 %之间,其中菌株DZGS08发酵液对玉米纹枯病菌有较好的抑制效果(图2),其抑制率达到50.44%,但仍低于阳性对照75%百菌清可湿性粉剂对玉米纹枯病菌的抑制率(75.13%)(表2)。由以上试验可知,杜仲中分离的多数菌株对玉米纹枯病菌均具有较好的抗菌活性,并以DZGS08的抑菌效果最佳。

图2 菌株DZGS08发酵液对玉米纹枯病菌的抑制效果Fig.2 Inhibitory effect of the fermentation liquid of strain DZGS08 on R.solani
2.3 菌株DZGS08对玉米纹枯病菌拮抗作用的显微观察
2.3.1 菌株DZGS08对玉米纹枯病菌菌丝生长的抑制
逐日观察两菌的相互作用,发现接种3 d后,菌株DZGS08与病原菌开始互作, 随着DZGS08菌丝的生长、扩展,其展现出较强的空间竞争能力,使对峙面的玉米纹枯病菌菌丝生长受到明显的抑制(图3a)。培养7 d后,DZGS08内生菌菌落覆盖大部分培养基平板,且在对峙培养的过程中产生明显的抑菌带(图3 b),究其原因,可能是菌株DZGS08菌株在生长过程中产生抗生素等相关的代谢产物,从而在后期的对峙培养中产生抑菌带。此外,玉米纹枯病菌在对峙培养后期(培养第5天)菌丝体出现明显的老化萎缩现象,且生长后期玉米纹枯病菌菌落与DZGS08菌落均未出现明显的颜色变化。
2.3.2 菌株DZGS08与玉米纹枯病菌对峙培养的显微观察结果
显微观察抑菌带边缘生长受阻的玉米纹枯病菌菌丝,结果表明,对峙培养中的玉米纹枯病菌的菌丝生长之所以受到抑制,主要是由于和正常的玉米纹枯病菌菌丝相比,发生了畸形,节间缩短、菌丝变粗,且菌丝顶端和分支处有膨大现象(图3f),而正常的玉米纹枯病菌菌丝体细长、光滑而均匀(图3e)。

图3 菌株DZGS08与玉米纹枯病菌的对峙培养Fig.3 The results of confronting culture experiment in strain DZGS08 and R.solani
2.4 DZGS08防治玉米纹枯病的盆栽试验
拮抗菌DZGS08对玉米纹枯病的盆栽防治试验结果如表3 所示, 菌株DZGS08发酵液对玉米纹枯病菌的防治效果为34.03%,虽低于75%百菌清WP对玉米纹枯病菌的防治效果(50.74 %),但试验结果仍表明,拮抗菌DZGS08发酵液对玉米纹枯病有一定的防效。

表3 DZGS08发酵液对玉米纹枯病菌的防效Table 3 Control effect of the fermentation broth of DZGS08 on R.solani in maize pot experiment
2.5 DZGS08菌株系统发育分析
将菌株DZGS08 ITS序列的测序结果在NCBI上进行BLAST比对,发现在亲缘关系相近的前100个菌株中,DZGS08与Thielaviasp.B27的相似性最高,同源性达99%,利用邻接法构建系统发育树(图4),DZGS08菌株与Thielaviasp.B27亲缘关系最近,单独构成一个分支,表明DZGS08菌株可能属于梭孢壳属(Thielavia)。DIGS08 ITS序列在GenBank中的登录号为JX179252。随后,结合菌株形态学观察,DZGS08菌株在PDA培养基平板上形成圆形菌落,菌落正面边缘灰白色,中央墨绿色,没有气生菌丝,在PDA培养基上也不产孢(见图3d),参考ITS序列分析结果,最终将DZGS08菌株初步鉴定为梭孢壳属(Thielavia)的未知种。

图4 菌株DZGS08 ITS碱基序列的聚类分析Fig.4 The neighbor-joining phylogeny of ITS sequence of strain DZGS08
3 讨论
通过组织分离法,本试验从杜仲的健康组织中共分离得到32株内生真菌,分别归为9个属。已有相关研究表明,药用植物杜仲中含有种群类型丰富的内生真菌,如田从丽等人从杜仲中分离得到链格孢属、青霉属、曲霉属、茎点霉属等共15个属的种群[20];霍娟等人则从杜仲健康组织中分离得到蜜孢霉属、刺孢壳属、交链孢属、刺盘孢属等共9属的内生真菌[21]。将本试验的分离鉴定结果与已报道的杜仲健康组织中的内生真菌种群[20-22]相比,发现仅有链格孢属(Alternaria)等少数种群一致。究其原因,可能是杜仲内生真菌的类群组成及分布与其宿主所处地理位置不同有关。本课题组仅就安徽农业大学校园内的杜仲样品进行了采集研究,后续试验将采集不同地域环境中的样品,通过多次重复分离来获得更多可培养内生真菌,从而更好地分析其种属分布特性及遗传多样性,准确了解杜仲内生真菌种群分布,为筛选杜仲内生真菌中具有抑菌活性的有益菌株提供基础。此外,本研究分离到的拟茎点霉属(Phomopsis)、炭疽菌属(Colletotrichum)等菌株既是重要的植物病原菌,也是广谱内生菌,在多种植物体内都有发现[22-24],目前,炭疽菌属和拟茎点霉属的部分菌种在农业生产中已成为重要的生防资源,如从植物黄花蒿和雷公藤的茎内分离到的2株内生炭疽菌,可产生一系列对植物病原真菌和细菌都有良好抑制作用的化合物[25-26];且PhomopsisB3对水稻的生长及其产量起到明显的促进作用[27]。由此可见,炭疽菌属及拟茎点霉属的部分真菌具有的抑菌及促生长等活性,在植物病害防治及增产等方面具有一定应用潜力。
拮抗微生物之所以能够防治植物病害,抑菌机理主要体现在拮抗微生物具有较强的空间和营养竞争能力,能够产生抗菌物质抑制植物病原菌的生长,在植物遇到病原菌侵袭时,能够诱导植物产生抗病性等多方面。本研究中,内生菌DZGS08可抑制玉米纹枯病菌菌落生长,产生较为明显的抑菌带,且显微观察的结果表明,在两者对峙培养过程中,生长受到抑制的玉米纹枯病菌菌丝部分发生畸形。这些现象可能是因为DZGS08菌株在培养过程中如枯草芽胞杆菌一样产生活性抗菌蛋白造成植物病原菌的菌丝扭曲、折叠,达到抑制植物病原菌生长的目的[28],又或是菌株在生长中能分泌抗生素类物质,从而抑制玉米纹枯病菌的生长,有待于作进一步的深入研究。
通过带毒平板法对杜仲内生真菌的发酵液抑菌活性进行测定,发现DZGS08菌株发酵液(1 mg/皿)对玉米纹枯病菌的生长抑制率达到了50%以上;但在玉米盆栽防治试验中,DZGS08 菌株发酵液对玉米纹枯病的防治效果较低,防效为34.03%,可能是由于实际的玉米盆栽试验中,玉米活体在生长过程中受到外界环境因素以及一些人为因素的影响而造成的。此外,本试验仅在在玉米蜡熟期对不同处理的玉米植株进行了病害调查,得到的数据仅反映出截至玉米蜡熟期,拮抗菌DZGS08对玉米纹枯病的防治效果为34.03%,但是随着玉米生长以及玉米纹枯病的扩展,拮抗菌DZGS08发酵液对玉米纹枯病的防效是否能够保持稳定,或呈上升又或是下降趋势,还有待于持续跟踪调查。
长久以来,化学农药在病虫害综合防治,保证农林作物稳产、高产等方面均起到了重要作用。然而,随着科学技术的快速发展,化学农药的副作用所造成的一系列问题越来越突出,如化学农药的过度施用引起的“3R”问题,对生物多样性的破坏以及对人体造成的间接伤害等。因此,利用生物防治,尤其是筛选和利用有益微生物防治植物病害在农业生产中得到了广泛的关注。目前,国内外对玉米纹枯病生防菌的筛选研究主要集中在枯草芽胞杆菌(Bacillussubtilis)[29]、木霉(Trichodermaspp.)[30-31]、绿色黏帚霉(Gliocladiumvirens)[32]等菌群。本研究中,获得1株对玉米纹枯病菌有较好抑菌活性的杜仲内生真菌DZGS08,利用形态学观察以及分子生物学方法鉴定其为梭孢壳属(Thielavia)真菌。梭孢壳属(Thielavia)真菌在多种植物内存在[33-34],相关研究[33]表明梭孢壳属真菌对金黄色葡萄球菌等医学病原菌的生长具有较好的抑制作用,但对植物病原菌的抑制作用则鲜有报道,本试验中, DZGS08菌株发酵液对玉米纹枯病的防治效果为34.03%,和文献报道的枯草芽胞杆菌菌悬液对玉米纹枯病的防治效果(43.01%)[29]以及木霉发酵液对玉米纹枯病的防治效果(40.07%)[35]比较接近,因此,在玉米纹枯病害的防治中可作为一株有较好开发应用前景的生防真菌。在后续研究中,将利用绿色荧光蛋白(GFP)标记,对该菌株的内生性进行深入验证,并对菌株对玉米植株促生性等方面展开研究,以期为DZGS08菌株在农业生产中的开发利用奠定理论基础。
[1]唐海涛, 荣延昭, 杨俊品. 玉米纹枯病研究进展[J]. 玉米科学,2004,12(1):93-96.
[2]高立起, 王占廷, 梁秋华, 等. 玉米纹枯病对种子产量及质量性状的影响[J]. 作物杂志,2004(4):17-19.
[3]赵茂俊, 张志明, 李晚忱, 等. 玉米纹枯病研究进展及分子标记辅助选择策略[J]. 玉米科学,2006,14(1):161-164.
[4]崔丽娜, 李晓, 杨晓蓉, 等. 玉米纹枯病研究进展[J]. 西南农业学报,2009,22(4):1181-1183.
[5]林海建, 刘昌林, 沈亚欧, 等. 基于RIL群体的玉米纹枯病抗性QTL分析[J]. 核农学报,2013,27(7):895-903.
[6]陈化保, 张晋康, 杨春平, 等. 增效剂加倍杀对井冈霉素防治玉米纹枯病的增效作用[J].四川农业大学学报,2011,29(1):80-83.
[7]Stone J K, Bacon C W, White J F. An overview of endophytic microbes:endophytism defined[M]∥Microbial Endophytes. New York:Marcel Dekker,2000:3-29.
[8]Wäli P R, Helander M, Saloniemi I, et al. Variable effects of endophytic fungus on seedling establishment of fine fescues[J]. Oecologia,2009,152(1):49-57.
[9]Ghimire S R, Charlton N D, Craven K D. The mycorrhizal fungus,Sebacinavermifera, enhances seed germination and biomass production in switchgrass(PanicumvirgatumL.)[J]. BioEnergy Research,2009,2:51-58.
[10]Caruso M, Colombo A L, Fedeli L, et al. Isolation of endophytic fungi andActinomycetestaxaneproducers[J]. Annals of Microbiology, 2000,50:3-13.
[11]Waller F, Achatz B, Bcltruschat H, et al. The endophytic fungusPiriformosporaindicareprograms barley to salt-stress tolerance, disease resistance, and higher yield[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102(38):13386-13391.
[12]Istifadah N, Saleeba J A, McGee P A.Isolates of endophyticChaetomiumspp.inhibit the fungal pathogenPyrenophoratritici-repentisinvitro[J]. Canadian Journal of Botany, 2006,84(7):1148-1155.
[13]Dingle J, McGee P A.Some endophytic fungi reduce the density of pustules ofPucciniareconditef. sp.triticiin wheat[J]. Mycological Research, 2003,107:310-316.
[14]Istifadah N, McGee P A.EndophyticChaetomiumglobosumreduce development of tan spot in wheat caused byPyrenophoratritici-repentis[J]. Australasian Plant Pathology,2006,35(4):411-418.
[15]帖卫芳, 胡鸢雷, 祝建波, 等. 甘草内生真菌的分离及鉴定[J]. 生物技术通报,2010(9):149-153.
[16]孙微微, 丁婷. 杜仲内生真菌中抗苹果炭疽病活性菌株的筛选[J]. 安徽农业大学学报,2013,40(6):981-987.
[17]李社增, 鹿秀云, 马平, 等. 小麦纹枯病拮抗细菌的筛选和应用[J]. 植物病理学报,2005,35(6):95-98.
[18]李石初, 唐照磊, 张培坤. 广西玉米自交系纹枯病抗病性鉴定[J]. 作物杂志,2006(2):69-70.
[19]Kim W K, Mauthe W, Hausner G, et al. Isolation of high molecular weight DNA and double-stranded RNAs from fungi[J]. Canadian Journal of Botany, 1990,68:1898-1902.
[20]田从丽.杜仲植物内生真菌EL09次生代谢产物的研究[D]. 西安:陕西科技大学,2011.
[21]霍娟. 杜仲内生真菌资源和活性菌株生物学的初步研究[D]. 南京:南京师范大学,2004.
[22]Murali T S,Suryanarayanan T S,Geeta R. EndophyticPhomopsisspecies:Host range and implication for diversity estimates[J].Canadian Journal of Microbiology,2006,52(7):673-680.
[23]Lin X, Lu C H, Shen Y M. One new ten-membered lactone fromPhomopsissp. B27,an endophytic fungus ofAnnonasquamosaL.[J].Chinese Journal of Natural Medicine,2008,6(5):391-394.
[24]武汉琴. 茶树内生真菌与宿主植物相互作用的初步研究[D]. 福州:福建师范大学,2009.
[25]Lu H, Zou W X, Meng J C, et al. New bioactive metabolites produced byColletotrichumsp., an endophytic fungus inArtemisiaannua[J]. Plant Science,2000,151(1):67-73.
[26]Zou W X, Meng J C, Lu H, et al. Metabolites ofColletotrichumgloeosporioides,an endophytic fungus inArtemisiamongolica[J]. Journal of Natural Products,2000,63(11):1529-1530.
[27]Dai C C,Yuan Z L, Yang Q Y, et al. The effects of increasing production of endophytesPhomopsisB3 on rice[J]. Agricultural Science &Technology, 2008,9(1):39-42,48.
[28]郭景旭. 胡麻枯萎病生防菌的筛选及其拮抗活性的研究[D]. 呼和浩特:内蒙古大学,2011.
[29]辜运富,张云飞,张小平. 一株抗玉米纹枯病内生细菌的分离鉴定及其抗病促生作用[J]. 微生物学通报,2008,35(8):1240-1245.
[30]张广志. 木霉对玉米纹枯病生物防治的初步研究[D]. 雅安:四川农业大学,2005.
[31]李琳. 棘孢木霉菌的分离及其生防作用的评价与应用[D]. 长春:吉林大学,2013.
[32]唐贵群. 绿色粘帚霉生物学特性及其对玉米纹枯病生防潜能的初步研究[D]. 雅安:四川农业大学,2006.
[33]李冬霞,武海燕, 张猛, 等. 枣树内生真菌的分离、鉴定及其多样性分析[J]. 果树学报,2010,27(6):975-979.
[34]陈基萍. 疯草内生真菌种属鉴定及次生代谢产物研究[D]. 杨凌:西北农林科技大学,2012.
[35]张广志, 文成敬. 木霉对玉米纹枯病的生物防治[J]. 植物保护学报,2005,32(4):354-356.
ScreeningofendophyticfungiisolatedfromEucommiaulmoidesOliv.withantimicrobialactivityagainstmaizeRhizoctoniasolani
Ding Ting1, Sun Weiwei1, Wang Shuai1, Jiang Haiyang2
(1.CollegeofPlantProtection,AnhuiAgriculturalUniversity,Hefei230036,China; 2.AnhuiProvincialKeyLaboratoryofCropBiology,Hefei230036,China)
In this study, thirty-two strains of endophytic fungi were isolated from the leaves, stems and fruits ofEucommiaulmoides. And the antimicrobial activity of endophytic fungi was examined against maizeRhizoctoniasolaniusing confront antibiotic culture experiment, growth inhibition measurements, disease-control pot experiment. The results indicated the strain DZGS08 had strong inhibit against maizeRhizoctoniasolaniwith more than 10 mm inhibition zone, and the fermentation broth of DZGS08 had a strong inhibitory effect on the pathogenic fungi, its inhibitory rates onRhizoctoniasolani; was 50.44%, Moreover, the control efficacy of the fermentation broth of the DZGS08 was 34.03% by pot experiment. It was revealed microscopically the strain DZGS08 could cause the abnormity and tortuosity of mycelial of phytopathogen and so on. Then, the strain DZGS08 was identified of molecular, the results showed that the strain DZGS08 belonged toThielavia.
Rhizoctoniasolani;Eucommiaulmoides; antimicrobial mechanism
2013-12-09
:2014-03-27
国家自然科学基金青年科学基金项目(31371980);安徽省高校省级优秀青年人才基金项目(2010SQRL063);安徽农业大学稳定和引进人才科研资助研究项目
S 482.292
:ADOI:10.3969/j.issn.0529-1542.2014.06.006
* 通信作者 E-mail:jd1998@gmail.com
