不同时机给药对原发性痛经模型小鼠雌激素受体、缩宫素受体的影响
2014-08-09蒲宝婵李爱主
蒲宝婵,李爱主,方 玲
(天津中医药大学,天津 300193)
近年来,原发性痛经发病率逐年升高,临床上开始用经前3~7 d给药来代替传统的生理周期用药[1-3],且以连续治疗3个月经周期为1疗程[4-5]。本文根据这一临床治疗方法,在前期工作基础上[6-7],通过动物实验来观察不同时机给药对原发性痛经模型小鼠雌激素受体(ER-α)和缩宫素受体(OTR)表达的影响。
1 实验材料
经前3剂止痛方JQF(当归、益母草、川芎、赤芍、桂枝),购自天津保康医院,并经生药学鉴定;元胡止痛片,天津同仁堂集团股份有限公司(30 mg/片)。给药剂量均参考了临床用药剂量,并根据体表面积折算成小鼠每日给药剂量所得。KM小鼠,雌性未孕,18~22 g,SPF级,购自北京华阜康实验动物技术有限公司,实验动物许可证:SCXK(京)2013-0004。苯甲酸雌二醇注射液,宁波市三生药业有限公司(2 mL∶4 mg,生产批号:120904);缩宫素注射液,上海禾丰制药有限公司(1 mL∶10 u,生产批号:130115)。OTR和ER-α均购自北京博奥森生物技术有限公司,RT-PCR 试剂盒,美国Promega公司;BCA蛋白定量试剂盒,碧云天生物技术公司;凝胶成像分析仪(Cuene Genins);实时定量PCR仪(Linegene9620),杭州博日科技有限公司。
2 实验方法
2.1 造模与给药 60只小鼠按体质量分层随机分为JQF整个动情周期给药组(以下简称JQF动情周期给药组)、JQF每个周期的第4天给药组(以下简称JQF第4天给药组)、元胡止痛片组、模型组和正常组,每组12只。根据小鼠动情周期天数[8],将造模时间定为6 d,除正常组外各组小鼠每日皮下注射苯甲酸雌二醇0.2 mg/只。JQF动情周期给药组(0.218 g/kg)和元胡止痛片组(0.1 g/kg)每日灌胃给以相应药物(0.2 mL/10 g),连续6 d,JQF第4天给药组(0.218 g/kg)小鼠每个周期的第4天开始给药至周期结束(共3 d),正常组和模型组每日灌胃相应体积的生理盐水。待6 d造模给药结束后,从各组中随机抽取6只小鼠检测1周期给药治疗对ER-α和OTR表达的影响,剩余小鼠按上述方法连续造模给药18 d(3个周期)后,再检测3周期连续给药治疗后的实验结果。
2.2 取材 动物处死后,立即开腹暴露子宫,将子宫周围脂肪和系膜剥离干净,按左右位置分为两段取出子宫,使子宫内组织液流出,用滤纸吸净后称重,取同只同位段子宫组织用锡纸包裹,放- 80 ℃冰箱保存备用。
2.3 Western blot检测ER-α和OTR蛋白的表达 用含有蛋白酶抑制剂混合物的裂解液提取子宫组织中的蛋白,根据蛋白含量检测试剂盒说明进行蛋白质定量。取10 μL蛋白在5%浓缩胶、10%分离胶的SDS-PAGE凝胶上样,经过电泳、转膜后4 ℃过夜保存,孵育相应一抗。取出后于室温下用TBST清洗5次,每次5 min。室温下孵育二抗1 h,再次洗涤后进行ECL曝光,应用Bio imaging system图像处理系统分析条带光密度值。
2.4 Real-time PCR检测ER-α和OTR mRNA的表达 ER-α和OTR引物序列如下:OTR:sense:5’ GAT GTC GCT CGA CCG CTG TCT 3’;anti-sense:5’ CGC CCA GCA ATC GAA GAC TCC 3’(172 bp);ER-α:Sense:5’ CAC ACC AAA GCC TCG GGA ATG 3’,anti-sense:5’ TAG TTG AAC ACA GTG GGC TTG 3’(146 bp);β-actin:sense:5’ TCA GGT CAT CAC TAT CGG CAA 3’;anti-sense:5’A GC ACT GTG TTG GCA TAG AGG 3’(169 bp)。用变性缓冲液(Trizol)一步法提取子宫组织中的总RNA,按试剂盒说明逆转录为cDNA,在预变性95 ℃ 10 min,变性94 ℃ 20 s,退火延伸59 ℃ 20 s,共40个循环的反应条件下完成基因的扩增。用2—△△Ct来表示每个目的基因的相对表达量[9]。
3 实验结果
3.1 ER-α和OTR蛋白的表达情况 从图1和图2中可以看出,正常组与模型组比较差异有统计学意义(P<0.01)。与模型组比较,JQF第4天给药组、JQF动情周期给药组和元胡止痛片组1周期给药治疗后小鼠子宫组织中ER-α、OTR蛋白的表达显著降低(P<0.01),且第4天给药组和动情周期给药组组间比较无差异。从图中也可以看出,3周期连续造模给药实验结果与1周期一致,且对ER-α和OTR蛋白表达的抑制作用更加显著。
3.2 ER-α和OTR mRNA的表达情况 从图3和图4中可以看出,正常组与模型组比较差异有统计学意义(P<0.01)。与模型组比较,JQF第4天给药组和JQF动情周期给药组1周期给药治疗后小鼠子宫组织中ER-α、OTR mRNA的表达显著降低(P<0.01),且2组组间比较无差异,3周期连续造模给药实验结果与1周期一致。元胡止痛片组给药后ER-α mRNA的表达1周期实验结果与3周期一致,均呈显著性降低(P<0.01),而OTR mRNA的表达1周期给药治疗后明显降低(P<0.05),3周期连续造模给药后结果显著(P<0.01)。
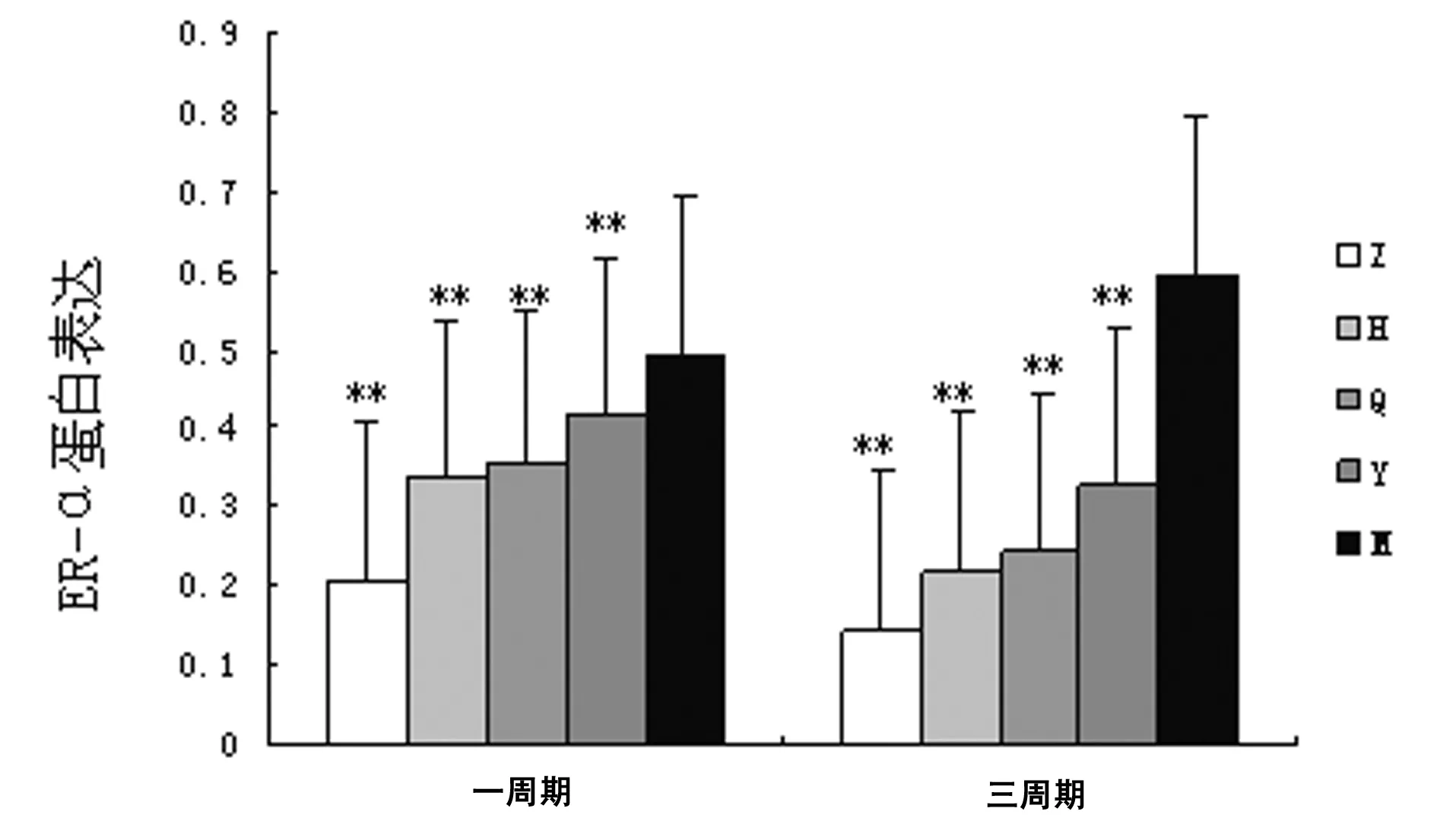
Z:正常组;H:JQF第4天给药组;Q:JQF动情周期给药组;Y:元胡止痛片组;M:模型组。**表示与模型组比较,P<0.01。图1

Z:正常组;H:JQF第4天给药组;Q:JQF动情周期给药组;Y:元胡止痛片组;M:模型组。**表示与模型组比较,P<0.01。图2

Z:正常组;H:JQF第4天给药组;Q:JQF动情周期给药组;Y:元胡止痛片组;M:模型组。**表示与模型组比较,P<0.01。图3

Z:正常组;H:JQF第4天给药组;Q:JQF动情周期给药组;Y:元胡止痛片组;M:模型组。**表示与模型组比较,P<0.01。图4
4 讨论
经前3剂止痛方(JQF)是临床治疗原发性痛经的有效方剂,在前期研究结果中发现在患者的黄体退化期用药治疗效果更为显著[10]。本研究根据这一结果提示,选取相当于人体黄体退化期的雌性小鼠动情周期后3 d用药[8](即从每个周期的第4天开始给药)作为另一给药时机,与整个动情周期用药作比较来观察这两组不同时机给药对原发性痛经模型小鼠子宫组织中ER-α和OTR表达的影响。
现代研究认为,原发性痛经的发生主要是由于雌激素(E2)和缩宫素(OT)水平的异常升高,所导致的子宫痉挛性收缩、缺血而引起的[11]。E2的生物学效应强弱与靶细胞内雌激素受体(ER)的水平密切相关[12]。ER-α作为ER的主要亚型之一,在子宫中起主导作用,可以通过对子宫蠕动的调节来改变子宫收缩强度,以减轻痛经程度。OT与OTR结合后可以通过作用于子宫平滑肌细胞,引起子宫收缩而致痛,还可通过引发子宫小动脉持久而强烈的收缩,使子宫肌层组织缺血而致痛[13],所以痛经程度的大小与OTR 的表达密切相关。 实验结果显示,小鼠原发性痛经模型复制成功,实验结果有效。与模型组比较,JQF周期的第4天给药与整个动情周期给药均可以显著抑制ER-α和OTR蛋白、mRNA的表达,3周期连续造模给药与1周期结果一致,且两组组间比较均无差异,说明周期的第4天给药与整个动情周期给药对原发性痛经模型小鼠ER-α和OTR蛋白、mRNA具有相同的治疗作用,且3个周期连续造模给药后结果依然有效,从动物实验初步体现了临床上月经来潮前开始用药与整个生理周期用药治疗原发性痛经具有相同的治疗效果。
[1]罗晶.痛经方周期性治疗寒瘀型原发性痛经临床观察[J].上海中医药杂志,2011,45(1):57-59.
[2]王娟,王佩娟.痛经的中医病机及治疗时机把握[J].吉林中医药,2012,32(1):45-47.
[3]顾仁艳,景博琼,周文涛,等.中药周期疗法治疗原发性痛经疗效观察[J].四川中医,2012,30(12):90-92.
[4]郭秀丽,夏阳.少腹逐瘀汤加减治疗寒凝血瘀型痛经46例[J].吉林中医药,2013,33(9):916-917.
[5]李西云.中药周期疗法治疗原发性痛经临床观察[J].中国中医急症,2008,17(8):1075-1076,1078.
[6]方玲,朱新冰,祝诚诚,等.经前三剂止痛方治疗原发性痛经的机制研究[J].中草药,2010,41(4):615-617.
[7]方玲,尹菊,赖晓艺,等.经前三剂止痛方治疗原发性痛经疗效观察[J].中华中医药学刊,2011,29(11):2480-2481.
[8]陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2011:83.
[9]PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR[J].Nucleic Acids Research,2001,29(9):45.
[10]方玲,姜国云,代娜,等.黄体退化期用药治疗原发性痛经的临床疗效观察[J].天津中医药大学学报,2012,31(2):77-79.
[11]关永格,李坤寅.化瘀止痛方及其拆方对人子宫腺肌病细胞OTR mRNA、ERαmRNA的影响[J].中药新药与临床药理,2013,24(1):28-33.
[12]OEHLER M K,GRESCHIK H,FISCHER D C,et al.Functional characterization of somatic point mutations of the human estrogen receptor alpha (hERalpha) in adenomyosis uteri[J].Molecular Human Reproduction,2004,10(12):853-860.
[13]MAGALHAES J K,CARVALHO J C,PARKES R K,et al.Oxytocin pretreatment decreases oxytocin-induced myometrial contractions in pregnant rats in a concentration-dependent but not time-dependent manner[J].Reproductive Sciences,2009,16(5):501-508.
