低氧复合运动对大鼠骨骼肌线粒体含量的影响*
2014-08-09秦永生
薄 海, 彭 朋, 秦永生, 张 勇
(1天津武警后勤学院军事训练医学教研室,天津 300309; 2天津体育学院天津市运动生理学与运动医学重点实验室,天津 300381)
低氧是心力衰竭、慢性阻塞性肺疾病、贫血等疾病的主要病理生理特征,也是高原医学和航天医学的重要研究命题。骨骼肌是机体主要的工作器官和氧耗器官,低氧导致骨骼肌形态与功能异常,表现为肌肉萎缩及工作能力降低,严重影响机体生活质量。线粒体是细胞主要的能量供应和活性氧(reactive oxygen species, ROS)的来源。研究表明,慢性低氧暴露导致骨骼肌线粒体含量及呼吸链复合体表达进行性降低,伴随肌肉质量及耐力进行性降低[1]。保护线粒体数量和质量是提高骨骼肌低氧耐受能力的有效措施[2]。
线粒体含量(mitochondrial content)与线粒体新生和降解的动态平衡相关,主要取决于线粒体生物合成(mitochondrial biogenesis)和线粒体自噬(mitophagy)两个相反生物学机制的协同。两者生物效应失衡导致损伤线粒体积累增加或线粒体增殖障碍,从而影响线粒体功能及细胞稳态,与衰老、神经退行性疾病、心血管疾病等的发生相关[3]。研究表明,低氧复合运动可增加骨骼肌血管内皮生长因子表达及毛细血管密度,提高低氧状态下肌组织氧的运输和摄取[4]。我们前期也证明低氧复合运动可促进大鼠低氧习服,提高骨骼肌线粒体呼吸链氧化磷酸化效率及能量输出水平[5]。本研究中,我们拟探讨低氧及低氧复合运动对线粒体生物合成和自噬的调控,及其对线粒体含量的影响。
材 料 和 方 法
1 动物及分组
健康雄性Sprague-Dawley大鼠32只,体重191~220 g,购于北京维通利华实验动物技术有限公司,动物合格证书为SCXK(京)2009-0004。大鼠随机分为4组,每组8只,即常氧对照(normoxia control, NC)组、常氧运动(normoxia+training, NT)组、低氧对照(hypoxia control, HC)组和低氧复合运动(hypoxia+ training, HT)组。HC和HT组大鼠饲养于常压低氧帐篷(Hypoxic System),模拟11.3%氧浓度(相当于海拔5 000 m氧浓度),持续低氧暴露4周。HT组大鼠于低氧帐篷内的动物跑台上进行跑台训练(5°,15 m/min),60 min/d,每周5 d,共4周。低氧及运动训练条件与我们前期工作一致[5]。NC与NT组大鼠于常氧环境饲养,NT组大鼠于常氧环境跑台训练,运动训练条件与HT组相同。各组动物均于末次低氧后即刻断头处死,快速分离双侧股四头肌,部分于-80 ℃冻存备用,其余即时制备线粒体。
2 骨骼肌线粒体提取
采用差速离心法提取骨骼肌线粒体[6]。肌肉组织剪碎、匀浆。加入提取介质(1 mmol/L EDTA,0.12 mol/L KCl,5 mmol/L MgCl2,20 mmol/L HEPES,pH 7.4),600×g离心10 min,取上清液于17 000×g离心10 min。取沉淀悬浮于20 mL提取介质中,7 000×g离心10 min。取沉淀悬浮于1 mL提取介质中。线粒体蛋白定量用考马斯亮蓝法检测。
3 线粒体膜电位测定
采用JC-1荧光探针检测线粒体膜电位[7]。在线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物,产生红色荧光;在线粒体膜电位较低时,JC-1不能聚集在线粒体基质中,此时JC-1为单体,产生绿色荧光。将线粒体加入0.9 mL JC-1染色工作液(碧云天生物技术研究所),37 ℃避光水浴10 min。加入3 mmol/L苹果酸和8 mmol/L谷氨酸启动态4呼吸(不存在ADP时线粒体缓慢摄氧建立跨膜膜电位的呼吸态),荧光分光光度计测定红色荧光(激发波长525 nm,发射波长590 nm)与绿色荧光(激发波长490 nm,发射波长530 nm),以红色荧光强度/绿色荧光强度表示线粒体膜电位。
4 线粒体ATP合成能力测定
采用萤光素-萤光素酶发光法[8]。在反应介质(0.5 μmol/L EDTA,3.0 μmol/L HEPES, 0.25 mol/L 蔗糖,0.1 mmol/L苹果酸,1 mmol/L谷氨酸)中顺序加入0.05 mg线粒体和20 μmol/L萤光素酶(Sigma),记录本底发光强度,继而加入4 μmol/L ADP启动反应,记录发光强度的变化。
5 蛋白表达测定
Western blotting法检测骨骼肌相关蛋白表达量,包括调控线粒体生物合成的过氧化物酶体增殖物激活受体γ辅激活因子1(peroxisome proliferator-activated receptor gamma cofactor 1 alpha, PGC-1α)和线粒体转录因子A(mitochondrial transcription factor A, Tfam)、调控线粒体自噬的Bcl-2/腺病毒E1B 19 kD相互作用蛋白3(Bcl-2/adenovirus E1B 19 kD-interacting protein 3,Bnip3)和苄氯素1(beclin-1)、反映线粒体含量的细胞色素C氧化酶亚基IV(cytochrome C oxidase IV, COXIV)和电压依赖性阴离子通道1(voltage-dependent anion channel 1, VDAC-1),以β-微管蛋白(β-tubulin)作为内参照。将提取蛋白样品加入2× SDS上样缓冲液,混合液 100 ℃加热5 min,冰浴冷却。在垂直电泳仪上用10 μg蛋白质样品经12% SDS-PAGE分离后,转移致PVDF膜上。Ⅰ抗(Abcam)4 ℃静置孵育过夜,洗涤3次,再以1∶1 000辣根过氧化物酶标记的对应Ⅱ抗(中杉金桥生物技术公司)室温孵育1 h,充分洗涤后,使用ECL试剂盒发光显影,X光胶片压片曝光,扫描定量各条带的相对灰度值。各组以NC组条带灰度值为100%,其灰度值与NC组条带灰度值的比值,即为其相对表达量(%)。
6 统计学处理
数据用均数±标准差(mean±SD)表示,使用SPSS 13.0统计软件处理,采用双因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 低氧复合运动对骨骼肌线粒体膜电位和ATP合成能力的影响
与NC组比较,HC组中线粒体膜电位和ATP合成能力显著降低(P<0.05,P<0.01),NT组和HT组中线粒体ATP合成能力显著升高(P<0.05)。HT组与HC组比较,线粒体膜电位和ATP合成能力显著升高(P<0.05,P<0.01),见图1。
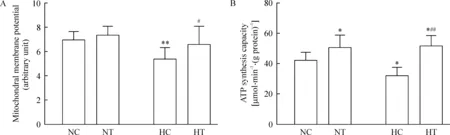
Figure 1. Mitochondrial membrane potential (A) and ATP synthesis capacity (B) in skeletal muscle. NC: normoxia control; NT: normoxia+training; HC: hypoxia control; HT: hypoxia+training.Mean±SD. n=8.*P<0.05,**P<0.01 vs NC group; #P<0,05, ##P<0.01 vs HC group.
2 低氧复合运动对骨骼肌线粒体含量的影响
与NC组比较,NT组中COXIV 和VDAC-1蛋白表达显著升高(P<0.01),HC组中COXIV 和VDAC-1蛋白表达显著降低(P<0.05)。HT组与HC组比较,COXIV 和VDAC-1蛋白表达显著升高(P<0.05),见图2。
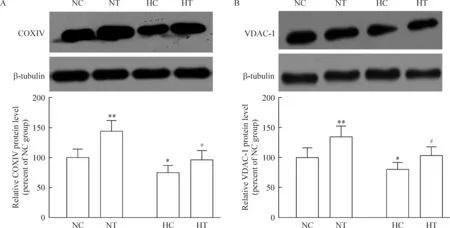
Figure 2. COXIV (A) and VDAC-1 (B) protein expression in skeletal muscle.Mean±SD. n=8.*P<0.05, **P<0.01 vs NC group; #P<0.05 vs HC group.
3 低氧复合运动对骨骼肌线粒体生物合成的影响
与NC组比较,NT组和HT组中Tfam蛋白表达显著升高(P<0.05或P<0.01),NT组中PGC-1α蛋白表达显著升高(P<0.01),HC组中PGC-1α和Tfam蛋白表达显著降低(P<0.05或P<0.01)。HT组与HC组比较,PGC-1α和Tfam蛋白表达显著升高(P<0.01),见图3。
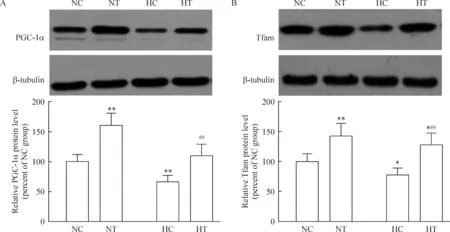
Figure 3. PGC-1α (A) and Tfam (B) protein expression in skeletal muscle.Mean±SD. n=8.*P<0.05,**P<0.01 vs NC group; ##P<0.01 vs HC group.
4 低氧复合运动对骨骼肌线粒体自噬的影响
与NC组比较,NT组、HT组和HC组中Bnip3和beclin-1蛋白表达均显著升高(P<0.05或P<0.01)。HT组与HC组比较,Bnip3和Beclin-1蛋白表达显著升高(P<0.05或P<0.01),见图4。
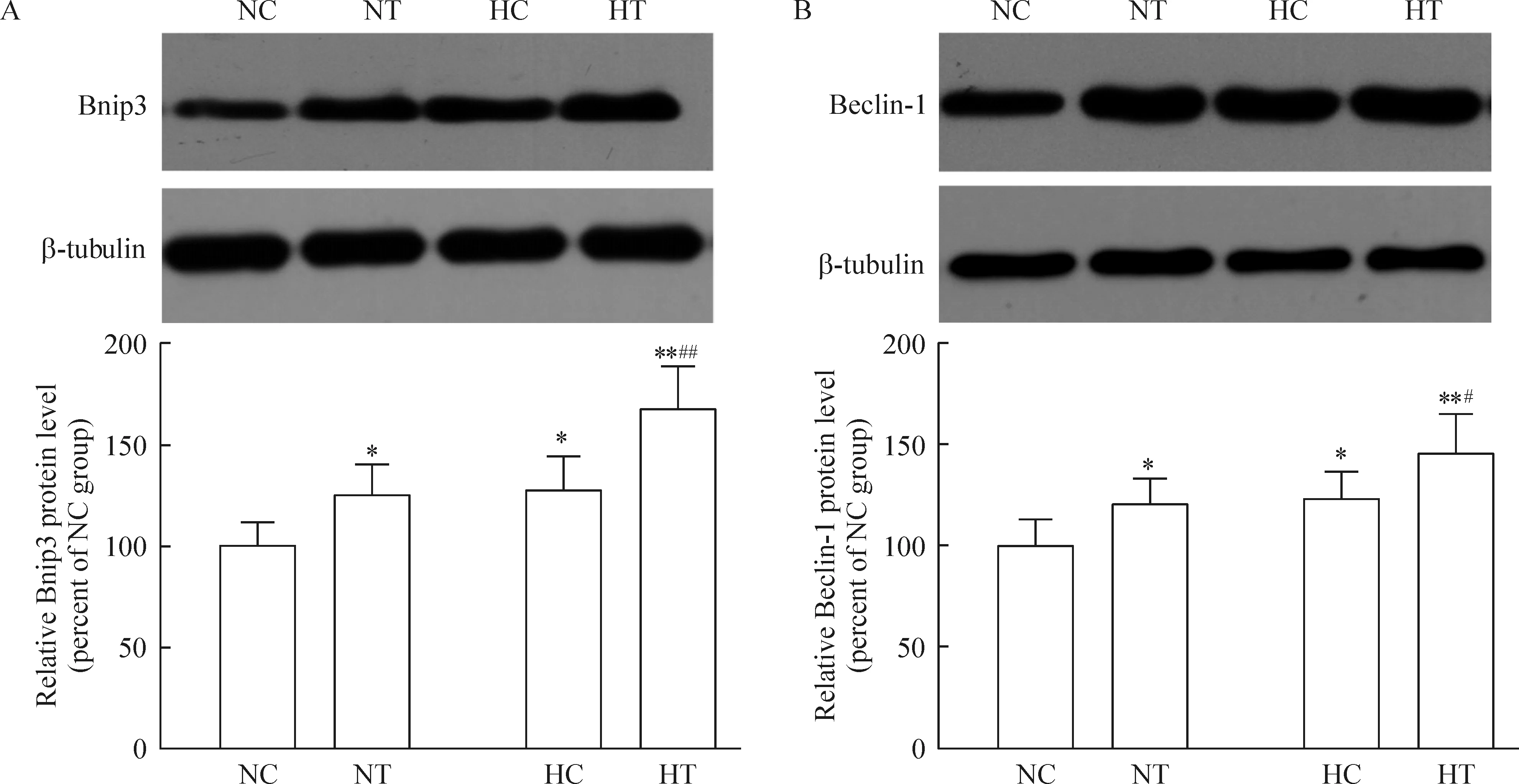
Figure 4. Bnip3 (A) and beclin-1 (B) protein expression in skeletal muscle.Mean±SD.n=8.*P<0.05,**P<0.01 vs NC group; #P<0.05,##P<0.01 vs HC group.
讨 论
为了更客观地反映线粒体含量变化,我们分别选取线粒体呼吸链标志蛋白COXIV和线粒体外膜标志蛋白VDAC-1表达量作为衡量指标。结果表明,4周低氧暴露后骨骼肌COXIV和VDAC-1蛋白表达均明显降低,提示慢性低氧减少了骨骼肌线粒体含量。Gamboa等[9]利用形态学研究表明,伴随低氧暴露时间延长,小鼠膈肌线粒体数密度和体密度进行性降低。此外,低氧状态下线粒体分布更趋向于肌膜下,以减少毛细血管氧扩散距离,这可能是对线粒体含量减少的代偿机制之一[9]。
PGC-1α是线粒体生物合成最主要调控因子。我们发现4周低氧暴露后,PGC-1α及其下游Tfam蛋白表达均显著降低。Levett等[10]报道世居平原人群移居高原,骨骼肌PGC-1α表达和线粒体密度均进行性降低,且二者显著正相关,提示PGC-1α表达降低是低氧抑制线粒体生物合成的重要机制。PPARγ是PGC-1α重要的结合配体,并正性调控后者表达。Regnault等[11]报道,低氧暴露各时程PPARγ和PGC-1α表达同时降低,PPARγ激动剂罗格列酮可抑制低氧对PGC-1α表达的下调作用。这可能是慢性低氧抑制线粒体生物合成的机制之一。
线粒体损伤程度超过其修复能力时,线粒体自噬启动以清除异常线粒体,是细胞的一种保护机制。本研究中4周低氧诱导线粒体自噬增加,表现为Bnip3和beclin-1蛋白表达显著升高。Bnip3蛋白通过羧基端跨膜区锚定于线粒体外膜,并减少Bcl-2对Beclin-1的抑制作用,从而激活线粒体自噬。Zhang等[12]发现慢性低氧可诱导小鼠胚胎成纤维细胞中线粒体自噬,低氧诱导因子1α(hypoxia-inducible factor 1α, HIF-1α)诱导的Bnip3和beclin-1表达是这个进程的必要条件。值得注意的是,本研究中低氧明显抑制线粒体膜电位和ATP合成能力,表明线粒体损伤明显。以上提示,4周低氧造成线粒体功能障碍,虽启动线粒体自噬但不足以清除受损线粒体,同时低氧抑制了线粒体生物合成,因而线粒体含量减少。
本研究中,4周低氧复合运动训练提高了低氧环境中骨骼肌线粒体含量,同时线粒体生物合成中PGC-1α/Tfam通路明显上调。研究表明,运动可提高慢性阻塞性肺疾病患者骨骼肌PPARγ表达[13]。这可能是低氧复合运动上调PGC-1α及其调控的线粒体生物合成的机制之一。此外,我们前期证明低氧复合运动通过一氧化氮途径提高激活转录因子 1(activating transcription factor 1, ATF-1)表达及活性[14]。ATF-1可与HIF-1 DNA识别位点相互作用,与HIF-1协同调控多种低氧应答基因的表达。Akimoto等[15]利用活体基因成像技术证明,运动可通过ATF1途径促进PGC-1α表达。提示ATF-1可能亦是低氧复合运动上调线粒体生物合成的潜在途径。
我们还发现,4周低氧复合运动训练后Bnip3和beclin-1蛋白表达进一步升高,伴随线粒体膜电位和ATP合成能力明显升高, 提示低氧复合运动促进了低氧诱导的Bnip3和beclin-1介导的线粒体自噬保护机制,有效清除损伤线粒体。He等[16]报道8周跑台训练可提高高脂饮食小鼠骨骼肌Bcl-2介导的线粒体自噬,抑制胰岛素抵抗造成的血糖升高。Kim等[17]发现,衰老小鼠骨骼肌线粒体自噬明显减少,而8周跑台训练显著提高了线粒体自噬水平。以上表明,线粒体自噬是实现运动健康效应的途径之一。Hagan等[18]证明,低氧状态下PGC-1α过表达可促进HIF-1α及其下游靶基因表达。我们推测,低氧复合运动可能通过上调PGC-1α表达,刺激HIF-1α依赖性Bnip3介导的线粒体自噬。
总之,慢性低氧暴露提高了线粒体自噬但抑制了线粒体生物合成,导致线粒体含量减少。低氧复合运动促进低氧状态下骨骼肌线粒体自噬,以有效清除损伤线粒体,并促进线粒体生物合成,产生健康线粒体以维持线粒体数量阈值和功能。
[参 考 文 献]
[1] Gamboa JL, Andrade FH. Muscle endurance and mitochondrial function after chronic normobaric hypoxia: contrast of respiratory and limb muscles[J]. Pflugers Arch, 2012, 463(2): 327-338.
[2] Meyer A, Zoll J, Charles AL, et al. Skeletal muscle mitochondrial dysfunction during chronic obstructive pulmonary disease: central actor and therapeutic target[J]. Exp Physiol, 2013, 98(6): 1063-1078.
[3] Zhu J, Wang KZ, Chu CT. After the banquet: mitochondrial biogenesis, mitophagy, and cell survival[J]. Autophagy, 2013, 9(11): 1663-1676.
[4] Vogt M, Hoppeler H. Is hypoxia training good for muscles and exercise performance?[J]. Prog Cardiovasc Dis, 2010, 52(6): 525-533.
[5] 薄 海, 张红英, 李海英, 等. 低氧复合运动对大鼠骨骼肌解偶联蛋白3表达及线粒体功能的影响[J]. 中国康复医学杂志, 2012, 27(1): 16-21.
[6] 王 静, 李东野, 夏 勇, 等. 转染Akt1基因对缺血再灌注大鼠心肌线粒体通透性转换的影响[J]. 中国病理生理杂志, 2010,26(1): 80-85.
[7] 叶 薇, 陈赛慧, 郝东杰, 等. 衰老过程中线粒体顺乌头酸酶活性变化对能量合成的影响[J]. 中国病理生理杂志, 2013,29(7): 1275-1282.
[8] Bo H, Jiang N, Ma G, et al. Regulation of mitochondrial uncoupling respiration during exercise in rat heart: role of reactive oxygen species (ROS) and uncoupling protein 2[J]. Free Radic Biol Med, 2008, 44(7): 1373-1381.
[9] Gamboa JL, Andrade FH. Mitochondrial content and distribution changes specific to mouse diaphragm after chronic normobaric hypoxia[J]. Am J Physiol Regul Integr Comp Physiol, 2010, 298(3): R575-R583.
[10] Levett DZ, Radford EJ, Menassa DA, et al. Acclimatization of skeletal muscle mitochondria to high-altitude hypoxia during an ascent of Everest[J]. FASEB J, 2012, 26(4): 1431-1441.
[11] Regnault TR, Zhao L, Chiu JS, et al. Peroxisome proliferator-activated receptor -beta/delta, -gamma agonists and resveratrol modulate hypoxia induced changes in nuclear receptor activators of muscle oxidative metabolism[J]. PPAR Res, 2010, 2010: 129173.
[12] Zhang H, Bosch-marce M, Shimoda LA, et al. Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia[J]. J Biol Chem, 2008, 283(16): 10892-10903.
[13] Remels AH, Gosker HR, Schrauwen P, et al. Peroxisome proliferator-activated receptors: a therapeutic target in COPD?[J]. Eur Respir J, 2008, 31(3): 502-508.
[14] 薄 海, 张红英, 李海英, 等. 低氧复合运动通过NO-ATF1通路上调大鼠骨骼肌线粒体解偶联蛋白3表达[J]. 中国组织工程研究与临床康复,2010, 14(41): 7643-7648.
[15] Akimoto T, Li P, Yan Z. Functional interaction of regulatory factors with thePgc-1αpromoter in response to exercise byinvivoimaging[J]. Am J Physiol Cell Physiol, 2008, 295(1): C288-C292.
[16] He C, Bassik MC, Moresi V, et al. Exercise-induced BCL2-regulated autophagy is required for muscle glucose homeostasis[J]. Nature, 2012, 481(7382): 511-515.
[17] Kim YA, Kim YS, Oh SL, et al. Autophagic response to exercise training in skeletal muscle with age[J]. J Phy-siol Biochem, 2013, 69(4): 697-705.
[18] Hagan K, Cocchiglia S, Zhdanov AV, et al. PGC-1α is coupled to HIF-1α-dependent gene expression by increasing mitochondrial oxygen consumption in skeletal muscle cells[J]. Proc Natl Acad Sci U S A, 2009, 106(7): 2188-2193.
