参松养心胶囊对糖尿病大鼠心室电生理特性及结构功能变化的影响*
2014-08-09陈世健胡建华
陈世健, 胡建华, 刘 韬
(1湖北民族学院附属民大医院心内科, 湖北 恩施 445000; 2武汉大学人民医院心内科, 湖北 武汉 430060)
糖尿病(diabetes mellitus,DM)患者在疾病进展的终末期易发生多种心血管并发症,这些心血管并发症在很大程度上增加了DM患者致死率和致残率[1-2]。对糖尿病患者心血管并发症的预防和治疗一直是心血管病研究的重要课题。本研究采用一次性链脲佐菌素腹腔注射制备大鼠DM模型,观察参松养心胶囊(Shensongyangxin capsule,SSYX)对DM模型大鼠电生理特性及结构功能变化的影响,为SSYX防治DM的心血管并发症提供理论和实验依据。
材 料 和 方 法
1 动物DM模型制备及分组
雄性SD大鼠45只,体重250~300 g,由武汉大学医学部实验动物中心提供。动物随机分为对照组(CTL组,n=15)、DM组(n=15)和SSYX组(n=15)。DM组和SSYX组采用一次性腹腔注射链脲佐菌素(streptozotocin,STZ; 60 mg/kg)制备糖尿病模型,CTL组则给予腹腔注射生理盐水(1 mL/kg)。大鼠禁食12 h,不禁水,第2天将2%的STZ溶液(溶于柠檬酸缓冲液,pH 4.5, 0.05 mol/L),每只大鼠按65 mg/kg剂量腹腔一次性快速注射[3-4],注射完1 h后给予食物和充足的水;72 h后尾静脉采血检测血糖以评价造模结果,血糖在16.7 mmol/L以上的大鼠视作造模成功[3-4],纳入本研究。DM造模成功后立即开始药物干预,参照文献[5]SSYX组连续6周给予SSYX灌胃 (1 g·kg-1·d-1)治疗,DM组和CTL组则给予生理盐水灌胃(2 mL·kg-1·d-1)。
2 主要方法
2.1血浆内皮素1(endothelin-1,ET-1)水平的检测 对3组动物分别于药物干预前、干预后第1、2、4及6周检测血浆的ET-1水平。大鼠眼球内眦静脉采血1 mL,置于含乙二胺四乙酸的抗凝管,室温放置1 h后,3 000 r/min离心10 min,分离血浆,置于EP管内,置于-80 ℃冰箱保存待用。采用放射免疫法检测血浆ET-1水平,ET-1检测试剂盒购自Assaypro,按试剂盒上的说明进行具体操作。
2.2心脏超声检查 完成药物干预后,对所有动物行超声心动图检查评价心功能。大鼠以3%戊巴比妥钠溶液(60 mg/kg; Sigma)行腹腔注射麻醉,胸部脱毛后仰卧位固定,连接肢体导联心电图,使用心脏超声诊断系统(Vivid 7型,GE)行心脏超声检查,S4线控探头,图像深度调制3.0~5.0 cm,频率为7.5 MHz,尽量减少扇扫角度。通过M型超声获得左室后壁厚度(left ventricular posterior wall dimension, LVPWD);在心尖四腔心切面测量左室舒张末期内径(left ventricular end-diastolic diameter, LVEDD)及左室收缩末期内径(left ventricular end-systolic diameter, LVESD);左室射血分数(left ventricular ejection fraction, LVEF)及左室短轴缩短率(left ventricular fractional shortening, LVFS)根据改良的Simpon公式计算获得。
2.3体表心电图的记录 在3组动物完成药物干预后进行体表心电图的记录。以3%戊巴比妥钠溶液(60 mg/kg)行腹腔注射麻醉,随后将大鼠固定于实验动物台上,通过温控电热毯将动物体温维持在37 ℃,采用16导电生理系统(埃德公司,澳大利亚)记录30 min模拟肢体II导联心电图,同时使用Chart 7.0 软件对心电图进行分析。测量心电图心率、RR间期、QRS波宽度、QT间期、QTc等指标。QTc计算采用公式[6]:QTc = QT/(RR/100)1/2。
2.4离体电生理研究 动物麻醉后开胸,随后立即取出心脏连接于Langendorff心脏灌流装置(专利号为200820191402.4),经主动脉逆行灌流,所有动物均给予普通Tyrode’s液灌流,灌流液保持37 ℃恒温,灌流速度10~12 mL/min,从取出心脏到实现灌流在2 min内完成。具体操作步骤及灌流液要求参照文献[7-8]。
2.5记录单相动作电位(monophasic action potential,MAP) 将刺激电极置于左室前游离壁(left anterior free wall,LAF)心外膜行基础周长为300 ms的S1S1刺激(脉宽2 ms,刺激强度为舒张期起搏阈值的2倍),记录电极置于刺激电极周围1~2 cm处,记录MAP。待MAP图形稳定后选择5个连续的MAP波形,应用Chart 7.0软件测量20%、50%及90%单相动作电位时程(MAPD20、MAPD50及MAPD90)。
2.6测量有效不应期(effective refractory period, ERP) 刺激电极置于LAF行程控电刺激,记录电极置于刺激电极周围1~2 cm测定ERP。在连续发放8个起搏刺激波S1后发放早搏刺激波S2(S1S1=300 ms,S1S2=300 ms,刺激强度为舒张期起搏阈值的2倍),S1S2间期自300 ms开始每次减少20 ms直至S1S2=100 ms,随后以每次减少10 ms的幅度降低S1S2间期,如S2能诱发出动作电位,则继续降低S1S2间期10 ms;如S2不能诱发出动作电位,则将S1S2增加10 ms,然后以-1 ms反扫直至S2不能诱发出动作电位。此时的S1S2间期即基础周长为300 ms时LAF的VERP。
2.7室性心律失常(ventricular arrhythmia,VA)的诱发 行Burst刺激诱发VA,将刺激电极置于LAF,给予50 Hz持续时间2 s的Train刺激,总刺激时间小于2 min。VA持续时间超过2 s即记为VA可诱发,超过30 s即记为持续性VA[9]。
2.8Masson染色评价心肌纤维化 离体电生理实验完成后,剪除心脏周围结缔组织和血管,滤纸吸干水分,取左室心肌组织,立即将心脏置于10%中性甲醛溶液中固定,8~12 h后行乙醇梯度脱水,并常规石蜡包埋切片,行Masson染色。光镜下心肌细胞呈红色,胶原纤维呈蓝绿色,观察心肌细胞及胶原纤维染色情况,拍照并电脑存储。采用Image Pro-Plus 4.5 软件对心肌纤维化分析,以心肌间质胶原容积百分比(collagen volume fraction, CVF)对心肌纤维化进行定量。每组各取6个心脏进行Masson染色评价心肌纤维化。
3 统计学处理
使用SPSS 17.0统计软件分析,正态分布计量资料多组间比较用单因素方差分析,数据以均数±标准差(mean±SD)表示;计数资料采用2检验,结果以率和构成比表示,以P<0.05为差异有统计学意义。
结 果
1 动物一般情况
DM组和SSYX组的所有动物在造模72 h后随机血糖均大于16.7 mmol/L,全部纳入本次研究。在给予普通饲料和充足饮水喂养6周后,DM组死亡2只和SSYX组死亡1只动物,最终纳入本研究的动物只数为:CTL组15只,DM组13只,SSYX组14只。
2 各组大鼠血浆ET-1水平动态变化
DM组大鼠血浆ET-1水平呈时间依赖性升高,明显高于其它2组,提示DM大鼠的ET-1在血液中的浓度随着病变程度的加重而升高。SSYX干预后ET-1水平有明显下降,但依然高于CTL组,见图1。

Figure 1. The plasma levels of ET-1 in the rats with different treatments for 6 weeks.Mean±SD.**P<0.01 vs CTL; ##P<0.01 vs DM.
3 各组大鼠超声检测结果
与CTL组相比,DM组的LVEF、LVFS及E/A均明显减小(均P<0.01),而LVEDD、LVESD及LVPWD则明显增大(均P<0.01),表明DM组动物的心脏收缩及舒张功能均较CTL组明显下降,且心脏结构重构明显。与DM组相比,SSYX组大鼠的LVEF、LVFS及E/A较DM组明显增大,而LVEDD、LVESD及LVPWD则较DM组明显减小(均P<0.01)。虽然CTL组和SSYX组的上述超声指标在组间比较仍存在统计学差异(均P<0.05),但与DM组相比,SSYX组的超声指标更接近CTL组,表明用SSYX治疗可以改善DM大鼠的心功能及减轻心脏结构的重构,见表1。

表1 3组动物药物干预6周后的超声指标比较
4 各组动物心电图的结果
与CTL组相比,DM组的心率减慢,RR间期、QRS波宽度、QT间期及QTc均延长(均P<0.01);SSYX组的RR间期、QRS波宽度、QT间期及QTc虽较CTL组延长(均P<0.05),但明显短于DM组(均P<0.01),此外,SSYX组的心率虽较CTL组减慢但快于DM组(均P<0.05),见表2。
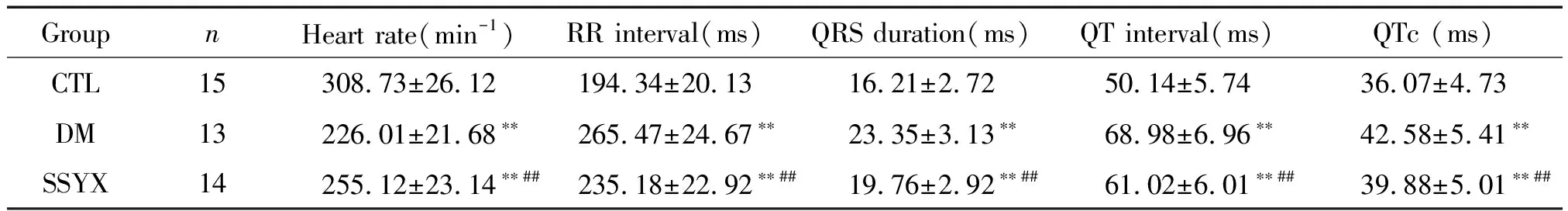
表2 各组动物心电图指标的比较
5 各组动物离体电生理研究结果的比较
与CTL组相比,DM组的VERP、MAPD20、MAPD50、MAPD90及VA诱发率均增大(均P<0.05);与CTL组相比,SSYX组的VERP、MAPD20、MAPD50、MAPD90及VA诱发率均增大(均P<0.05);与DM组相比,SSYX组的VERP、MAPD20、MAPD50、MAPD90及VA诱发率均减小(均P<0.01),见图2及表3。
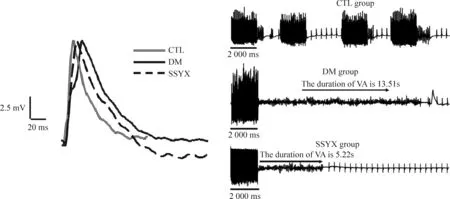
Figure 2. The examples of monophasic action potential and ventricular arrhythmia (VA) in the rats with different treatments.

表3 各组动物离体电生理指标的比较
*P<0.05,**P<0.01vsCTL;#P<0.05,##P<0.01vsDM.
6 各组动物Masson染色及心肌胶原纤维定量分析结果
CTL组的心肌纤维呈束状分布,排列整齐、致密,断裂不明显,胶原纤维堆积少;DM组的心肌纤维呈现进行性排列紊乱、增粗甚至断裂,肌纤维间隙明显增宽,并可见大量异常胶原纤维堆积;SSYX组上述现象均明显减轻,心肌间质胶原减少。在随后进行的心肌胶原纤维定量分析中我们发现,DM组的心肌间质CVF显著高于CTL组(17.76±5.21vs4.76±1.23),而SSYX组的心肌间质CVF虽高于CTL组(10.23±3.45vs4.76±1.23,P<0.01),但较DM组明显减少(10.23±3.45vs17.76±5.21,P<0.01),见图3。以上结果说明SSYX治疗能明显改善DM引起的心肌胶原重构,减轻心肌纤维化程度。
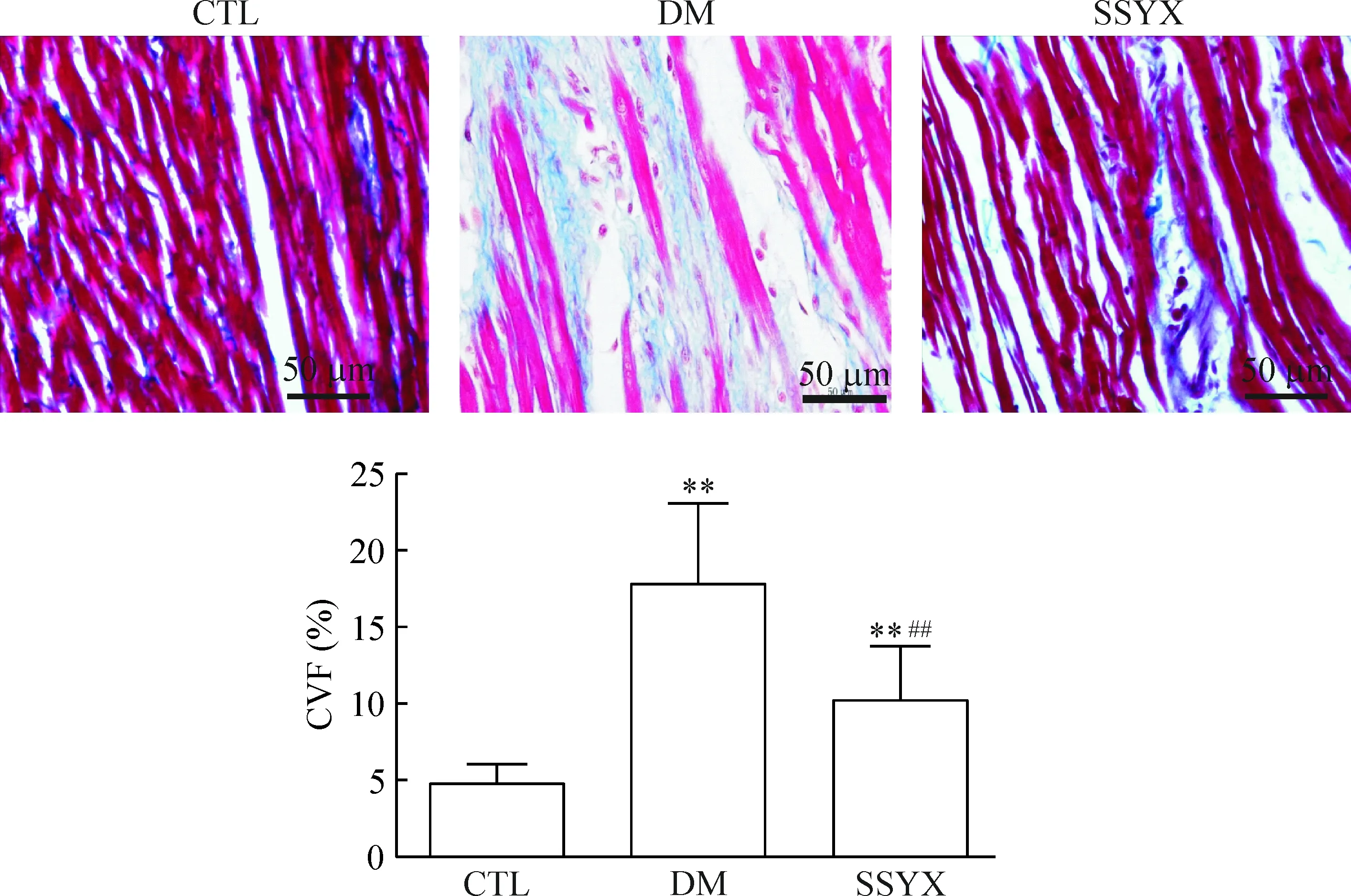
Figure 3. The results of myocardial Masson staining in the rats with different treatments (×400).Mean±SD.n=6.** P<0.01 vs CTL; ##P<0.01 vs DM.
讨 论
DM患者在疾病的进展过程中可出现心功能不全的表现,早期以心脏舒张功能障碍为特点,随后可合并心脏收缩功能障碍,这种并非由冠心病、高血压或瓣膜性心脏病导致的心力衰竭常被称为糖尿病心肌病[10-11]。鉴于DM可导致患者发生多种心血管病并发症,而这些并发症往往是患者死亡的重要原因,因此寻求预防和治疗这些心血管病并发症的药物显得尤为重要。SSYX是祖国医学中依据络病学理论研制而成的一种复方制剂。既往研究发现,SSYX在慢性心力衰竭模型中具有改善心功能及抑制电重构的作用[12]。据此我们推测SSYX对DM或许也具有上述作用,为验证这一猜测我们开展了本次实验。
本研究采用大剂量STZ腹腔注射制备DM大鼠模型,利用了STZ具有选择性破坏胰岛β细胞引起胰岛素分泌减少,进而导致血糖升高和糖尿病发生的作用。在本研究中,未经药物干预的DM大鼠经6周喂养后出现心脏收缩和舒张功能均发生障碍、心肌间质胶原蛋白堆积、QT间期和APD均延长及室性心律失常诱发率增加的改变。而在给予SSYX干预的DM大鼠中,我们发现SSYX能显著改善DM大鼠心功能、降低心肌纤维化程度及抑制电重构及室性心律失常的发生。针对SSYX发挥上述作用的机制我们推测与其降低DM大鼠血浆ET-1水平有关。高血糖可导致心肌发生缺血缺氧[13-15],而心肌缺血缺氧又可导致ET-1持续分泌[16]。既往研究在DM患者和DM动物模型中均发现血浆ET-1水平持续升高及心肌组织ET受体表达的增加[17-19]。这些研究还证实升高的ET-1水平与DM动物心肌结构重构与电重构的发生及心功能下降密切相关,而ET-1受体阻滞剂却对这些改变具有治疗作用[17-22]。在本研究中,我们同样观察到随着DM的进展,DM组大鼠血浆ET-1水平呈现明显升高的趋势,而在给予SSYX干预后,SSYX组的DM大鼠血浆ET-1水平较DM组显著下降,SSYX降低DM大鼠血浆ET-1水平作用可能发挥与ET-1受体阻滞剂相似的作用。此外,SSYX治疗降低DM大鼠血浆ET-1水平具体机制可能与SSYX具有扩张冠状动脉,增加血流,从而改善心肌缺血缺氧的作用有关[23-24]。
总之,SSYX具有减轻DM大鼠心室电重构和结构重构及改善心功能的作用,其机制可能与SSYX降低DM大鼠血浆ET-1水平有关。
[参 考 文 献]
[1] Gallego M, Alday A, Urrutia J, et al. Transient outward potassium channel regulation in healthy and diabetic hearts [J]. Can J Physiol Pharmacol, 2009, 87(2):77-83.
[2] Battiprolu PK, Cillette TG, Wang ZV, et al. Diabetic cardiomyopathy: mechanisms and therapeutic targets[J]. Drug Discov Today Dis Mech, 2010, 7(2):e135-e143.
[3] 金可可,林艳红,王万铁,等. 血糖波动对糖尿病大鼠肾小球内皮细胞和肾小管上皮细胞凋亡的影响[J]. 中国病理生理杂志, 2007, 23(3):570-573.
[4] Tschöpe C, Walther T, Königer J, et al. Prevention of cardiac fibrosis and left ventricular dysfunction in diabetic cardiomyopathy in rats by transgenic expression of the human tissue kallikrein gene[J]. FASEB J, 2004, 18(7):828-835.
[5] 杨 军,周先令,褚 春,等. 参松养心胶囊改善心力衰竭大鼠QT离散度及缝隙连接蛋白43的表达[J]. 中国动脉硬化杂志, 2011,19(3):197-201.
[6] Zhang Z, He YX, Dipika T, et al. Functional roles of Cav1.3(1D) calcium channels in atria insights gained from gene- targeted null mutant mice[J]. Circulation, 2005, 112(13):1936-1944.
[7] 刘 韬,秦 牧,胡 河,等. 激活蛋白激酶C对心室电整复性及心室心律失常的影响[J]. 中华心血管病杂志, 2012, 40(9):780-785.
[8] 刘 韬,秦 牧,陈 阵,等. 慢性心力衰竭兔离体心室电整复性变化对室性心律失常的影响[J]. 中华心血管病杂志, 2012, 40(6):467-471.
[9] Ninio DM, Murphy KJ, Howe PR, et al. Dietary fish oil protects against stretch-induced vulnerability to atrial fibrillation in a rabbit model [J]. J Cardiovasc Electrophysiol, 2005, 16(11):1189-1194.
[10] Bell DS. Diabetic cardiomyopathy[J]. Diabetes Care, 2003, 26(10):2949-2951.
[11] Wichi R, Malfitano C, Rosa K, et al. Noninvasive and invasive evaluation of cardiac dysfunction in experimental diabetes in rodents[J]. Cardiovasc Diabetol, 2007, 6:14.
[12] 王 唏,段慧楠,胡 娟,等. 参松养心胶囊对心功能及心脏电生理影响的实验研究[J]. 中华心律失常学杂志,2012, 16(6):417-421.
[13] 任 骏. 糖尿病心肌病的基础与临床研究现状[J]. 心血管病学进展, 2001, 22(5):299-302.
[14] Joffe II,Travers KE,Perreault-Micale CL, et al. Abnormal cardiac function in the streptozotocin-induced non-insulin-dependent diabetic rat: Non-invasive assessment with doppler echocardiography and contribution of the nitric oxide pathway[J]. J Am Coll Cardiol, 1999, 34(7):2111-2119.
[15] Karamsetty MR, Klinger JR, Hill NS. Phytoestrogens restore nitric oxide mediated relaxation in isolated pulmonary arteries from chronically hypoxic rats [J]. J Pharmacol Exp Ther, 2001, 297(3):968-974.
[16] 刘 韬,秦 牧,陈 阵,等. 长期血浆内皮素-1水平升高对异丙肾上腺素慢性致室性心律失常作用的影响[J]. 中华心律失常学杂志,2013, 17(6):449-454.
[17] Chen S, Evans T, Mukherjee K, et al. Diabetes-induced myocardial structural changes: role of endothelin-1 and its receptors[J]. J Mol Cell Cardiol, 2000, 32(9):1621-1629.
[18] Erbas T, Erbas B, Kabakci G, et al. Plasma big-endothelin levels, cardiac autonomic neuropathy, and cardiac functions in patients with insulin-dependent diabetes mellitus[J]. Clin Cardiol, 2000, 23(4):259-263.
[19] Makino A, Kamata K. Elevated plasma endothelin-1 level in streptozotocin- induced diabetic rats and responsiveness of the mesenteric arterial bed to endothelin-1[J]. Br J Pharmacol, 1998, 123(6):1065-1072.
[20] Ding Y, Zou R, Judd RL, et al. Endothelin-1 receptor blockade prevented the electrophysiological dysfunction in cardiac myocytes of streptozotocin-induced diabetic rats[J]. Endocrine, 2006, 30(1):121-127.
[21] Verma S, Arikawa E, McNeill JH. Long-term endothelin receptor blockade improves cardiovascular function in diabetes [J]. Am J Hypertens, 2001, 14(7Pt1):679-687.
[22] Hileeto D, Cukiernik M, Mukherjee S, et al. Contributions of endothelin-1 and sodium hydrogen exchanger-1 in the diabetic myocardium[J]. Diabetes Metab Res Rev, 2002, 18(5):386-394.
[23] 陈国锋,王立成,杨 斌,等. 丹参酮Ⅱ-A磺酸钠注射液在体外循环中对心肌缺血/再灌注损伤保护作用的研究[J].中国心血管病研究, 2009, 7(11):812-816.
[24] 沈 贤,莫晓燕,杜晓阳. 赤芍总苷对大鼠缺血损伤心肌细胞凋亡的保护作用[J]. 中国药理学通报, 2007, 23(10):1300-1305.
