Transwell接触共培养促进单散iPSCs生长及分化*
2014-08-09郭永龙郭晓令连瑞玲陈建苏
刘 庆, 郭永龙, 郭晓令, 连瑞玲, 陈建苏, , 3△
(暨南大学 1附属第一医院眼科, 2再生医学教育部重点实验室, 3医学院眼科研究所,广东 广州 510632)
人诱导多能干细胞(induced pluripotent stem cells, iPSCs)拥有向各种人体细胞分化的潜能,且避免胚胎干细胞带来的伦理问题和免疫排斥反应,因此成为组织工程研究理想的细胞来源[1]。但目前iPSCs在克隆团较小或悬浮培养时活性降低,阻碍了分化研究的开展[2]。在临床工作中,因角膜内皮再生能力弱,角膜内皮损伤后修复成为治疗角膜内皮疾病的一大难题[3]。已有文献报道体细胞与干细胞共培养可以诱导干细胞向该种体细胞表型分化,接触共培养可以显著促进干细胞增殖及分化[4-5]。本实验通过建立单散iPSCs与牛角膜内皮细胞(corneal endothelial cells, CECs)的Transwell接触共培养模式,探讨Transwell接触共培养对单散iPSCs活性的影响及诱导iPSCs分化的表征变化,为进一步研究单散iPSCs培养及向CECs的分化提供实验依据。
材 料 和 方 法
1 材料与试剂
人脐带源iPSCs(中国科学院广州生物医药与健康研究院赠);mTeSR1培养基(STEMCELL); 低糖DMEM培养基, DMEM/F12培养基(HyClone);Y27632、Matrigel、Accutase和碱性磷酸酶(alkaline phosphatease,ALP)染色试剂盒(Sigma-Aldrich); 0.25%-Trypsin-EDTA和胎牛血清(Gibco);兔抗人Oct4和Nanog抗体(Cell Signaling);兔抗人水通道蛋白1(aquaporin 1,AQP1)抗体、鼠抗人CD34抗体和羊抗鼠IgG抗体(Santa Cruz);鼠抗人CD133 抗体(Miltenyi Biotec);兔抗人CD31 抗体(博奥森);鼠抗兔IgG抗体(Chemicon);RNA提取试剂盒(Biomiga);逆转录试剂盒和PCR试剂盒(Toyobo);死活细胞染色试剂盒(Biotium); 过滤器(Biologix);荧光显微镜(Leica);倒置显微镜(Olympus); 6孔培养板(Corning); Transwell(1 μm)及配套的6孔板(BD); RS-1300 型超净工作台(苏净集团安泰公司);二氧化碳培养箱(Alpha)。
2 方法
2.1牛CECs的分离与培养 取屠宰场死亡6 h内的牛眼球,按照文献报道方法[3]分离牛CECs,1 200 r/min离心5 min,用含10%胎牛血清的低糖DMEM重悬细胞后按1×107/L 接种到6孔板上,放入37 ℃、5% CO2培养箱中孵育。48 h后换液,以后隔天换液。细胞融合至80%时传代。本实验中所用细胞均为第1代或第2代细胞。
2.2人iPSCs 的扩增培养 提前30 min用DMEM/F12培养基稀释的体积分数1% Matrigel铺板,37 ℃水浴箱解冻第40代人脐带源iPSCs系,迅速转移至15 mL离心管中,逐滴加入9 mL含体积分数0.1% Y27632的mTeSR1培养基,1 450 r/min、离心5 min,重悬细胞,注意不要将细胞吹散,转移至6孔板,放入37 ℃、5% CO2培养箱中孵育,24 h后改用不加Y27632的mTeSR1培养基换液。每天换液,及时挑除分化细胞。5~7 d后传代,提前30 min用Matrigel铺板,Accutase 37 ℃消化3 min,用2个1 mL枪头重叠后轻轻来回刮起克隆团,小心吹打5~10次至克隆团散开,注意不要吹散成单个细胞,按1∶3传代。每次传代后加入10 μmol/L Y-27632。
2.3单散iPSCs与牛CECs共培养 提前1 d将牛CECs细胞种到Transwell小室的底面培养8 h后,iPSCs克隆团消化后用枪头刮起克隆团,小心吹打30~50次至克隆团几乎散开成单个细胞,再用40 μm过滤器过滤去除未散开的iPSCs细胞。实验组将单散细胞按1×107/L直接种到已经接种牛CECs的Transwell小室内。设定共培养组为实验组,常规培养iPSCs组为对照组(一),非共培养iPSCs单散细胞组为对照组(二)。3组细胞前3 d使用mTeSR1培养基,第4天开始用含10%胎牛血清的低糖DMEM培养基。以后每2 d更换1次培养基。每天倒置显微镜下观察并拍照记录形态变化至第14天。
2.4iPSCs的鉴定 对共培养第3天的iPSCs单散细胞进行鉴定,对照组选用非共培养iPSCs单散细胞即对照组(二)。
2.4.1免疫荧光 吸弃培养基,PBS漂洗2遍,4%多聚甲醛室温固定15 min,PBS冲洗后加入含0.3% Triton X-100和3%牛血清蛋白混合液封闭30 min。分别加入1∶100稀释的兔抗人Oct4和Nanog Ⅰ抗孵育,4 ℃冰箱过夜,PBS漂洗3遍,加入鼠抗兔IgG Ⅱ抗,室温避光孵育1 h,PBS漂洗3遍,DAPI染色15 min后置于倒置荧光显微镜下观察,拍照。
2.4.2实时荧光定量PCR(qPCR) RNA提取按照试剂盒操作步骤进行,所得RNA样本检测其A值,A260/A280在1.8~2.1范围内表示RNA纯度较高,未降解;用逆转录试剂盒反应体系将所得RNA转录成cDNA,反应温度为37 ℃温浴15 min,98 ℃加热5 min;选用Premier 7.0进行引物设计,选用GAPDH为内参照,所得引物见表1。将cDNA加入PCR反应体系:SYBR Green Real-time Mix 12.5 μL,上游引物1 μL,下游引物1 μL,蒸馏水8 μL。反应温度依次为95 ℃ 4 min,30个循环(95 ℃加热10 s,58 ℃ 10 s,72 ℃ 20 s)。PCR反应过程由荧光定量PCR仪每隔5 s记录1次温度在60 ℃~90 ℃间的荧光值。
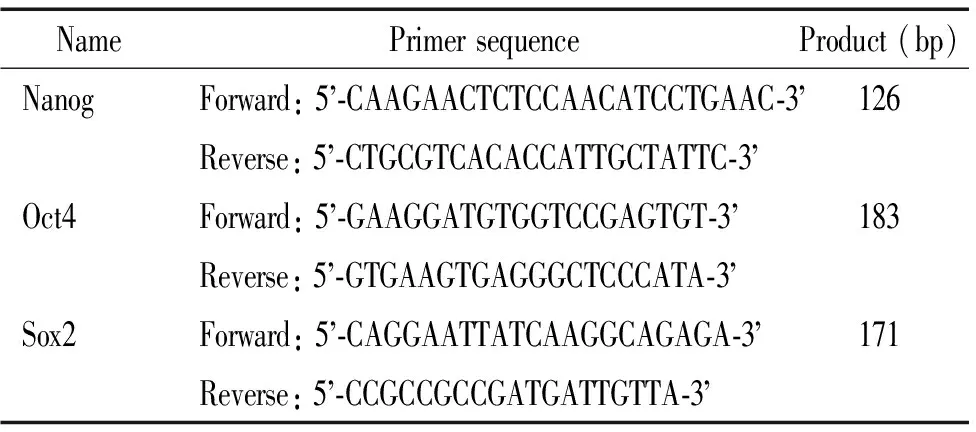
表1 引物序列
2.4.3死活细胞染色 对细胞进行Viability/Cytotoxicity Assay Kit for Animal Live & Dead Cells试剂盒染色,其中活细胞用钙黄绿素AM(Calcein AM)染色,死细胞用乙啶二聚体-III (EthD-III)染色。按试剂盒操作说明配制染色液,PBS清洗细胞3遍,加入已配好的染色液,室温避光孵育15 min后吸弃染液,PBS清洗2遍后倒置荧光显微镜下观察,拍照。运用ImageJ进行细胞计数。
2.5iPSCs诱导分化后的鉴定 对iPSCs共培养诱导分化14 d后的细胞进行鉴定。对照组选用进行常规培养的iPSCs细胞即对照组(一)。
2.5.1ALP染色 运用ALP染色试剂盒,使用前按照说明书预先配制染液,PBS漂洗细胞3遍,加入染液后常温避光孵育15 min后PBS漂洗3次,在倒置显微镜下观察,拍照。
2.5.2免疫荧光 固定封闭过程同前,分别加入1∶100稀释的兔抗人CD31抗体、兔抗人AQP1抗体、兔抗人ZO-1、鼠抗人CD133抗体和鼠抗人CD34抗体,4 ℃冰箱孵育过夜。PBS洗涤后,前三者加入鼠抗兔IgG抗体,后两者加入山羊抗鼠IgG 抗体,均常温孵育1 h,DAPI 染色后置于倒置荧光显微镜下观察,拍照。
2.5.3qPCR 操作步骤同2.4.2。
3 统计学处理
采用SPSS 17.0软件处理,数据以均数±标准差(mean±SD)表示,组间均数比较采用方差分析,以P<0.05为差异有统计学意义。
结 果
1 牛角膜内皮细胞形态
原代培养的牛角膜内皮细胞在分离培养24 h后大部分已贴壁,细胞爬行生长至第7天可以达90%融合成片,细胞呈多边形铺路石状,细胞间连接紧密。传代培养细胞4代以内增殖活跃,形态呈多角形;4代以后形态不规则,胞质增多,细胞间连接松散,见图1A。
2 iPSCs克隆生长形态及鉴定
iPSCs克隆生长迅速,核质比较一般细胞大,细胞排列紧密,克隆团边界清晰,约5~7 d克隆团开始与周边克隆团融合,见图1B。免疫荧光显示iPSCs的Oct4和Nanog均表达阳性,见图1E、F、G、H。
3 单散细胞iPSCs生长及分化形态及鉴定
实验组和对照组(二)细胞在种板后24 h大部分细胞贴壁,对照组(二)单散iPSCs在第1次换液后隔天观察细胞几乎全部不再贴壁,见图1C。实验组单散iPSCs换液后细胞贴壁生长,核质比减小,胞浆增多,见图1D。选用实验组第3天的单散iPSCs进行免疫荧光检测显示,iPSCs的Oct4和Nanog染色均表达阳性,见图1I、J、K、L。死活细胞染色活细胞被染成绿色,死细胞被染成红色,实验组较对照组(二)死细胞少,ImageJ死细胞计数后进行统计学分析,差异有统计学意义(P<0.01),见图2A。
qPCR检测单散iPSCs培养3 d的Oct4、Nanog和Sox2 mRNA表达量同对照组(一)比较差异无统计学意义(P>0.05),见图2B;但经过14 d共培养诱导后,单散iPSCs的Oct4、Nanog和Sox2 mRNA表达量同对照组(一)比较差异有统计学意义(P<0.01),见图2C。

Figure 1. The morphological characteristics of human iPSCs and bovine CECs. A: the morphology of bovine CECs cultured for 7 d; B: the morphology of iPSCs in control group 1 for 4 d; C: the morphology of single-dissociated iPSCs in control group 2 for 3 d; D: the morphology of single-dissociated iPSCs in experimental group for 3 d; Nanog was positively expressed in iPSCs of control group 1 (E and F), and experimental group (I and J) for 3 d; Oct4 was positively expressed in iPSCs of control group 1 (G and H), and experimental group (K and L) for 3 d. Scale bar=100μm.
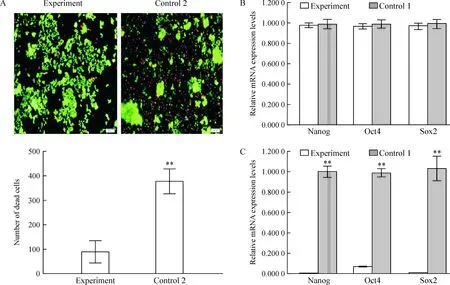
Figure 2. The live and dead cell staining (A; scale bar=100 μm) and qPCR detection (B: 3 d; C: 14 d) of human single-dissociated iPSCs. Mean±SD.n=3.**P<0.01 vs experiment.
经过14 d共培养,实验组诱导后细胞已达100%融合,细胞形态较均一,多边形,体积增大,胞浆增多,核浆比减小,无明显克隆团块,细胞间连接紧密,见图3A。对照组(一)细胞形态多样,细胞间可见多个散在已老化iPSCs克隆团块,见图3B。14 d共培养后,ALP染色实验组染色阴性,对照组(一)可见明显团块状着色,见图3C、D。免疫荧光染色ZO-1、AQP1和CD31表达阳性,CD34和CD133表达阴性,见图3E、F、G、H、I。
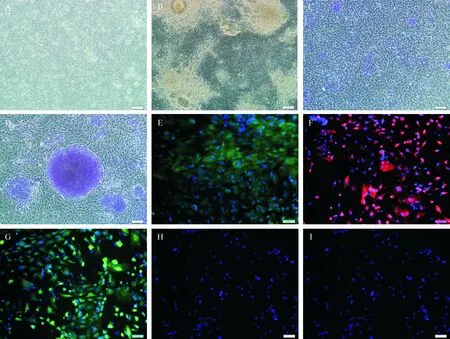
Figure 3. The morphological characteristics of single-dissociated human iPSCs after 14 d of co-culture with bovine CECs. A: the morphology of single-dissociated iPSCs in experimental group; B: the morphology of iPSCs in control group 1; C: alkaline phosphatase staining was negative in single-dissociated iPSCs in experimental group; D: alkaline phosphatase staining was positive in control group 1; immunofluorescence staining for ZO-1(E), AQP1(F) and CD31(G) was positive, while that for CD34 (H) and CD133(I) was negative in single-dissociated iPSCs after co-culture in experimental group. Scale bar=100 μm.
讨 论
目前,iPSCs细胞已成为组织工程细胞的理想来源,通过病毒转染、蛋白转导、添加小分子、共培养等方式iPSCs可被诱导为心肌细胞、血管内皮细胞、视网膜色素上皮细胞、神经嵴细胞等[6-9]。全球约半数的角膜移植术用于治疗CECs功能失代偿导致的角膜盲,CECs是角膜与组织工程角膜的关键细胞。将iPSCs细胞诱导分化为角膜内皮细胞,可以为解决眼科临床治疗角膜内皮疾病提供新的途径。然而,从其它细胞诱导分化为角膜内皮细胞一直是科研工作中的难题,仅有少量文献报道,其中Hatou等[10]报道运用神经嵴来源的角膜基质干细胞可诱导分化为功能性角膜内皮细胞。Ju等[11]报道运用条件培养基促进神经嵴细胞向角膜内皮样细胞分化。2篇文献都是由神经嵴细胞分化,从iPSCs向角膜内皮分化鲜有文献报道。通常iPSCs在单散细胞、克隆团较小或悬浮状态下活性明显降低,不利于分化研究的开展[2],而iPSCs呈克隆团样会使分化效率显著降低[12-14]。如何获得有利于细胞分化且活性好的单散iPSCs成为一个亟待解决的问题。有文献通过自配iPSCs培养基来实现单散iPSCs培养,再将单散细胞诱导分化为体细胞,取得了很好的效果,不仅无需细胞分选等复杂操作,而且缩短了诱导时间,诱导分化后细胞形态均一,无明显iPSCs克隆团存在[15]。也有文献通过运用小分子non-muscle myosin II增加iPSCs小克隆团、悬浮培养细胞及单散细胞活性[16]。
体细胞与干细胞共培养可以诱导干细胞向该种体细胞表型分化,接触共培养更可以显著促进干细胞增殖及分化。Perrier 等[4]报道,人胚胎干细胞与MS5细胞混合接触共培养后,可以使前者有效地分化为神经上皮样细胞。Yoshida等[5]发现,小鼠iPSCs与PA6细胞混合接触共培养后,表达早期外胚层标志KRT14 和 KRT18,出现上皮样细胞,经过其后的气液培养后,呈现多层上皮细胞层,底层细胞表达p63。本实验通过Transwell接触共培养模型,首次进行iPSCs与CECs共培养研究,有以下发现:(1)使iPSCs在单散状态下仍然保持较高的活性,与未进行共培养的单散iPSCs比较,死细胞数量显著减少。(2)使iPSCs在单散状态下仍然保持高潜能的未分化特性,免疫荧光染色多能性相关蛋白(Oct4和Nanog)表达阳性,Oct4、Nanog和Sox2 mRNA表达与iPSCs克隆团比较差异无统计学意义。(3)Transwell接触共培养模型既有利于2种细胞接触互相发挥作用,又使2种细胞分隔而不会混合,不影响细胞的纯化效果;因此,这种接触共培养模型既有利于iPSCs生长,也有利于其分化。(4)与CECs共培养2周促进iPSCs向CECs样细胞分化,细胞形态均一,呈多角形,表达部分内皮细胞表型(ZO-1、AQP1和CD31)。
本研究实验发现,Transwell接触共培养模型可以使单散iPSCs存活且维持iPSCs原有多能性,单散状态更利于iPSCs分化,通过与角膜内皮细胞共培养可以初步诱导iPSCs向内皮样细胞分化。我们将在下一步的实验中,添加促进CECs分化与CECs发育信号的培养液,使iPSCs通过Transwell接触共培养分化为更成熟稳定的CECs,并用于治疗角膜内皮细胞病变。
[参 考 文 献]
[1] Liu SP, Fu RH, Huang YC, et al. Induced pluripotent stem (iPS) cell research overview[J]. Cell Transplant, 2011, 20 (1):15-19.
[2] Rao M. Scalable human ES culture for therapeutic use: propagation, differentiation, genetic modification and re-gulatory issues[J]. Gene Ther, 2008, 15(2):82-88.
[3] 谭美华,陈建苏,招志毅,等. 共培养环境中兔角膜内皮细胞诱导人iPSCs分化[J]. 中国病理生理杂志, 2012, 28(8):1488-1493.
[4] Perrier AL, Tabar V, Barberi T, et al. Derivation of midbrain dopamine neurons from human embryonic stem cells[J]. Proc Natl Acad Sci U S A, 2004, 101(34):12543-12548.
[5] Yoshida S, Yasuda M, Miyashita H, et al. Generation of stratified squamous epithelial progenitor cells from mouse induced pluripotent stem cells[J]. PLoS One, 2011, 6(12): e28856.
[6] Zwi-Dantsis L, Mizrahi I, Arbel G, et al. Scalable production of cardiomyocytes derived from induced pluripotent stem (iPS) cells without c-Myc[J]. Tissue Eng Part A, 2011, 17(7-8):1027-1037.
[7] Kane NM, Xiao Q, Baker AH, et al. Pluripotent stem cell differentiation into vascular cells: a novel technology with promises for vascular regeneration[J]. Pharmacol Ther, 2011, 129 (1):29-49.
[8] Buchholz DE, Pennington BO, Croze RH, et al. Rapid and efficient directed differentiation of human pluripotent stem cells into retinal pigmented epithelium[J]. Stem Cells Transl Med, 2013, 2(5):384-393.
[9] Menendez L, Yatskievych TA, Antin PB, et al. Wnt signaling and a Smad pathway blockade direct the differentiation of human pluripotent stem cells to multipotent neural crest cells[J]. Proc Natl Acad Sci U S A, 2011, 108 (48):19240-19245.
[10] Hatou S, Yoshida S, Higa K, et al. Functional corneal endothelium derived from corneal stroma stem cells of neural crest origin by retinoic acid and Wnt/β-catenin signaling[J]. Stem Cells Dev, 2013, 22 (5):828-839.
[11] Ju C, Zhang K, Wu X. Derivation of corneal endothelial cell-like cells from rat neural crest cellsinvitro[J]. PLoS One, 2012, 7(7): e42378.
[12] Lee G, Chambers SM, Tomishima MJ, et al. Derivation of neural crest cells from human pluripotent stem cells[J]. Nat Protoc, 2010, 5(4):688-701.
[13] Jiang X, Gwye Y, McKeown SJ, et al. Isolation and characterization of neural crest stem cells derived frominvitro-differentiated human embryonic stem cells[J]. Stem Cells Dev, 2009, 18(7):1059-1070.
[14] Pomp O, Brokhman I, Ziegler L, et al. PA6-induced human embryonic stem cell-derived neurospheres: a new source of human peripheral sensory neurons and neural crest cells[J]. Brain Res, 2008, 1230(1):50-60.
[15] Menendez L, Kulik MJ, Page AT, et al. Directed diffe-rentiation of human pluripotent cells to neural crest stem cells[J]. Nat Protoc, 2013, 8(1):203-212.
[16] Walker A, Su H, Conti MA, et al. Non-muscle myosin II regulates survival threshold of pluripotent stem cells[J]. Nat Commun, 2010, 7(1):1038-1044.
