葛根素联用沙格列汀对2型糖尿病大鼠肾脏纤维化的影响*
2014-08-09丁伯平黄帧桧
金 鑫, 黄 华, 丁伯平, 黄帧桧
(皖南医学院药理学教研室及中药药理国家三级实验室,安徽 芜湖 241002)
肾脏纤维化是在损伤刺激作用下,肾脏固有细胞(包括纤维细胞、系膜细胞和上皮细胞等)被大量细胞外基质取代,分泌细胞因子和炎症介质等,破坏肾脏正常结构[1]。它是所有肾脏疾病发展到慢性肾衰竭的共同途径和主要病理基础,主要表现为肾小球硬化和肾间质纤维化。研究[2]表明,肾脏中固有细胞的活化和损伤,引起肾间质单核-巨噬细胞浸润,进而释放大量生长因子和趋化黏附因子等促纤维化因子,最终导致肾脏纤维化的形成和基质蛋白合成增多、沉积。糖尿病的产生和发展会引起一系列并发症,肾脏损伤是其中之一,据统计2010年全球糖尿病肾病患者已达到2.8亿,而且以每年2.2%的速度增长。而血糖水平的降低对延缓糖尿病并发症具有重要的作用[3]。
葛根素是从豆科植物野葛根的干燥根中提取的主要有效成分,其化学名称为4,7-二羟基-8-β-D葡萄糖异黄酮,属于异黄酮化合物。葛根素具有降低血糖[4]、血压与血脂[5],还能抑制炎症反应,对心肌梗死[6]、糖尿病肾病[7]患者起保护作用。在高血糖治疗方面,葛根素是一种胰岛素增敏剂[8]。沙格列汀是一种高效二肽基肽酶4(dipeptidyl peptidase 4, DPP-4)抑制剂,通过选择性抑制DPP-4来调节血糖[9],是一类新型降糖药。研究表明, 沙格列汀可以保护肾脏[10]。二甲双胍是双胍类降血糖药物[11],其机制是通过提高胰岛素敏感性而增加外周对葡萄糖的利用。二甲双胍联用沙格列汀治疗糖尿病优于各自单药治疗,并且对肾脏具有保护作用[12]。据此,我们推测葛根素联用沙格列汀对糖尿病肾病大鼠肾脏应具有保护作用,本实验旨在探讨这2种药物合用对糖尿病大鼠肾脏纤维化的影响及其可能机制。
材 料 和 方 法
1 动物、药品、试剂和仪器
健康雄性Wistar大鼠(n=50),体质量150~180 g,由南京青龙山动物实验中心提供,许可证号为SCXK(苏)2009-0001。大鼠在22~24 ℃、湿度60%~65%环境下分笼饲养,每笼1只,每日自由进食饮水。
链脲佐菌素(streptozotocin,STZ; Sigma);葛根素注射液(方明药业集团有限公司);沙格列汀片(中美上海施贵宝制药有限公司);二甲双胍(河北山姆士药业有限公司)。糖化血红蛋白(glycosylated hemoglobin 1c, HbA1c)测定试剂盒、大鼠巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)与TNF-α试剂盒、RT-PCR试剂盒均来自合肥安启生物科技有限公司。
JA5003N型电子天平(上海精密科学仪器有限公司);22R高速低温离心机(Beckman Coulter);ELx800自动酶标仪(Bio-TEK);电热干燥箱(上海精密试验设备有限公司);-20 ℃低温冰箱(Beckman Coulter);凝胶成像分析系统(江苏捷达科技发展有限责任公司);血糖测定仪(台欣)。
2 方法
2.1动物造模及分组 50只雄性Wistar大鼠,给予饲料适应性喂养1周后,随机抽取8只大鼠作为正常对照组(A组,n=8),其余大鼠制造2型糖尿病模型[13],即高糖高脂饲料喂养6周以后,腹腔1次注射STZ(45 mg/kg),72 h后尾静脉取血测血糖,血糖≥16.7 mmol/L说明造模成功。将造模成功的39只糖尿病大鼠随机分为糖尿病对照组(B组,n=8)、葛根素治疗组(C组,n=7)、沙格列汀治疗组(D组,n=8)、葛根素联用沙格列汀治疗组(E组,n=8)和二甲双胍联用沙格列汀治疗组(F组,n=8)。C组每天给予葛根素注射液80 mg/kg腹腔注射;D组每天给予沙格列汀10 mg/kg灌胃;E组每天给予葛根素注射液40 mg/kg腹腔注射和沙格列汀5 mg/kg灌胃;F组每天给予盐酸二甲双胍注射液50 mg/kg和沙格列汀5 mg/kg灌胃。A组和B组每天给予相应量的生理盐水腹腔注射。连续给药8周,期间每周测1次体重,根据体重调整给药剂量,每周使用1次血糖仪测量尾静脉血糖。
2.2样品采集 给药8周后禁食12 h测空腹血糖(fasting plasma glucose,FPG),将实验大鼠腹腔注射戊巴比妥钠40 mg/kg麻醉,立即抽取腹主动脉血,放置干燥管中,使用22R高速低温离心机离心,取上清液待测;取双侧肾脏,经生理盐水反复灌洗,去除包膜后称重,放置-80 ℃的冰箱中保存备用。
2.3生化指标测定 分离出的血清严格按照试剂盒说明操作,测定HbA1c。使用ELISA试剂盒测定TNF-α和MIF。
2.4肾脏切片染色 取部分肾脏用10%中性甲醛固定,常规脱水、浸蜡、包埋,将各组大鼠肾脏组织石蜡横断面连续切3片,厚度约每片5 μm,切片常规脱蜡去水。然后严格按照步骤进行HE和Masson染色,在光学显微镜下观察病理变化。以Masson染色结果为对象,用Image-Pro Plus 6.0软件对图像进行分析,计算高倍镜视野中被染成蓝色的纤维组织面积与视野总面积的比值,得到纤维化面积所占比率。再采用Katafuchi等[14]方法半定量分析肾间质纤维化程度:无纤维化,0分;纤维化面积所占比率<25%,1分;25%~50%,2分;<50%,3分。
2.5RT-PCR法检测肾脏组织TNF-α、MIF和CD68 mRNA的变化 进行半定量PCR分析,评估肾脏组织TNF-α、MIF和CD68 mRNA表达情况。以β-actin作为内参照,针对TNF-α、MIF和CD68特异性序列设计PCR引物(表1)。使用RNA提取试剂盒提取RNA,以各组肾脏总RNA逆转录的cDNA为模板,RT-PCR分析TNF-α、MIF和CD68 mRNA表达情况。

表1 引物序列
3 统计学处理
采用SPSS 13.0软件分析,数据用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠体重、肾重及肾重指数的变化
与A组比较,B组大鼠体重明显下降(P<0.01),肾重和肾重系数明显上升(P<0.01)。与B组比较,D组大鼠体重增加不明显(P>0.05), C、E和F组大鼠体重增加(P<0.01或P<0.05);C、D组大鼠肾重下降不明显(P>0.05),E、F组大鼠肾重下降(P<0.05);C、D、E和F组大鼠肾重系数下降(P<0.01或P<0.05)。与C、D两组单用药比较,葛根素联用沙格列汀组在增加体重和降低肾重、肾重系数方面更明显,见表2。
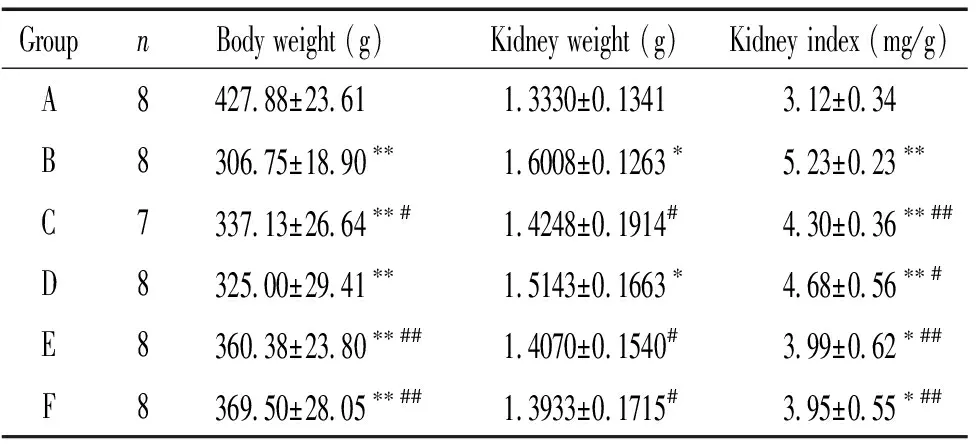
表2 各组大鼠体重、肾重及肾重指数
2 葛根素联用沙格列汀对大鼠血糖和HbA1c的影响
与A组比较,B组大鼠血糖和HbA1c明显升高(P<0.01)。与B组比较,各治疗组的血糖和HbA1c都有不同程度的下降(P<0.01或P<0.05)。葛根素联用沙格列汀可以有效降低血糖和HbA1c,比单用葛根素效果更好,但与沙格列汀联用二甲双胍组之间无显著差异,见表3。

表3 各组大鼠血糖和HbA1c
3 葛根素联用沙格列汀对大鼠血清中TNF-α和MIF的影响
与A组比较, B组大鼠血清中TNF-α和MIF水平都明显上升(P<0.01)。与B组比较,各治疗组大鼠血清中TNF-α和MIF水平下降(P<0.01或P<0.05)。与单给药组比较,葛根素联用沙格列汀降低TNF-α和MIF在血清中的含量更为明显。与二甲双胍联用沙格列汀治疗组相比,葛根素联用沙格列汀有进一步降低TNF-α和MIF含量的趋势,但差异没有统计学意义,见表4。
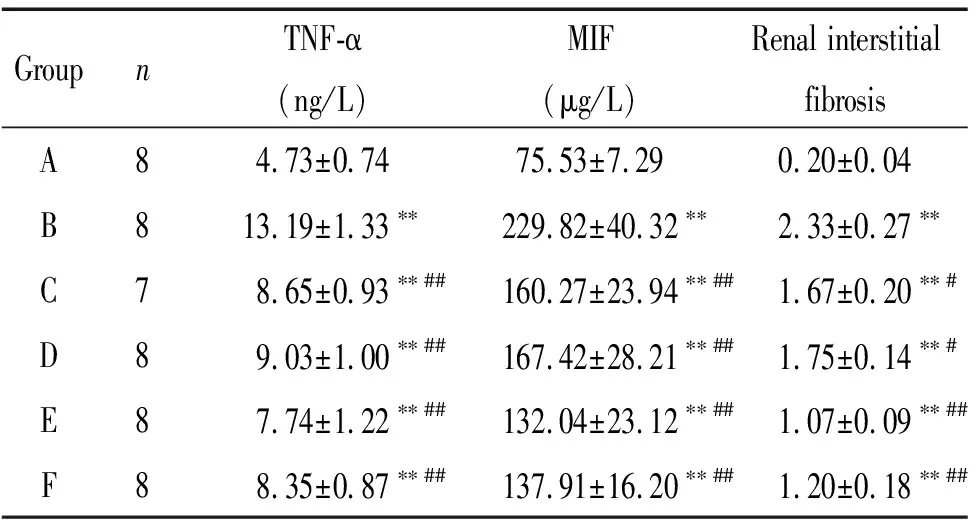
表4 各组大鼠血清中TNF-α和MIF的含量
4 各组大鼠肾组织的病理学观察
显微镜下,HE染色显示, A组大鼠肾小球体积正常,系膜细胞无增生。B组大鼠肾小球体积增大,肾小球内系膜细胞数增多,肾小管出现明显空泡和肿胀。各治疗组肾组织病理变化与B组比较均发生不同程度的减轻,葛根素联用沙格列汀与单用药物组比较,改善作用更加明显。Masson染色结果显示,A组大鼠肾间质未观察到明显的胶原纤维,肾小球、肾小管基底膜染成蓝色,染色较浅。B组大鼠肾间质中有明显的胶原纤维,基质增多,染色加深。与B组比较,各治疗组纤维化均有不同程度改善,其中,联合用药组较单用药组改善程度更加明显。半定量分析表明,B组肾间质纤维化积分值明显高于A组(P<0.01);与B组比较,各治疗组积分值降低(P<0.05或P<0.01)。相比于单用药,联合用药改善程度更加明显,但2个联合用药组之间差异不明显,见图1、表4。

Figure 1. Renal tissue with HE and Masson staining in all groups. A: normal control group; B: diabetic model group; C: puerarin treatment group; D: saxagliptin treatment group; E: puerarin combined with saxagliptin treatment group; F: metformin combined saxagliptin treatment group.
5 葛根素联用沙格列汀对肾脏TNF-α、MIF及CD68 mRNA表达的影响
RT-PCR结果显示,与A组大鼠相比,B组大鼠肾脏中TNF-α、MIF及CD68 mRNA都具有较高的表达。与B组大鼠相比,各治疗组大鼠TNF-α、MIF及CD68 mRNA表达均下降。与单用药组大鼠比较,葛根素联用沙格列汀组大鼠TNF-α、MIF及CD68 mRNA表达下降更显著,见图2。
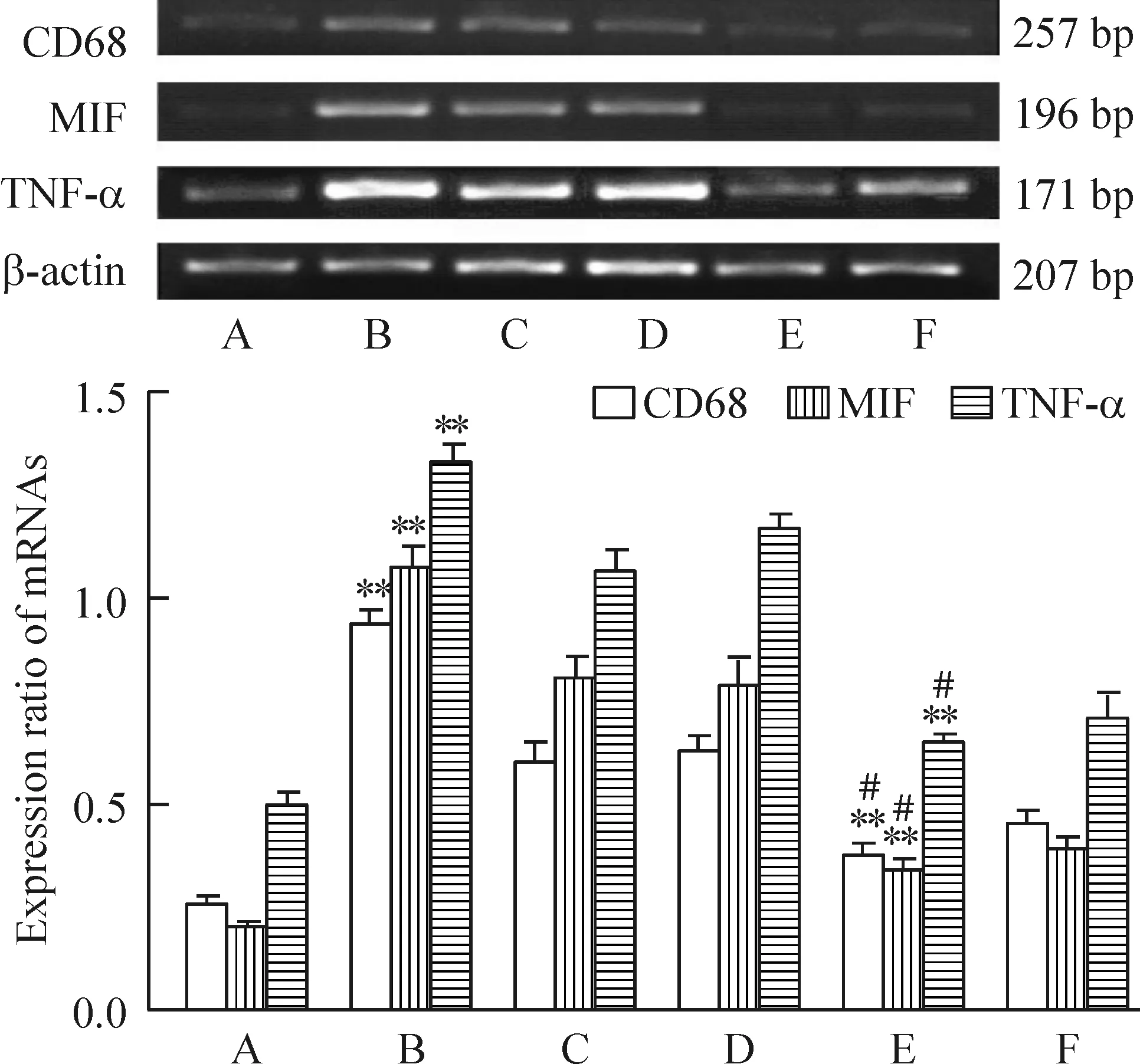
Figure 2. The mRNA expression of CD68, MIF and TNF-α in the kidneys of all groups. A: normal control group; B: diabetic model group; C: puerarin treatment group; D: saxagliptin treatment group; E: puerarin combined with saxagliptin treatment group; F: metformin combined with saxagliptin treatment group.Mean±SD.n=3. **P<0.01 vs A; #P<0.05 vs B.
讨 论
糖尿病肾病是糖尿病的严重并发症,也是导致慢性肾功能衰竭的主要原因之一。肾脏肥大是糖尿病肾病早期病理变化的主要表现[2],到晚期时发展为肾小球硬化、肾小管萎缩以及肾间质纤维化,最终导致肾功能衰竭。肾间质纤维化是几乎所有原发性和继发性肾病发展到终晚期肾衰竭的共同途径。因此,防止和缓解糖尿病肾病发生与发展,寻求有效控制糖尿病肾脏纤维化的药物成为研究重点。
TNF-α是引起肾脏损伤的重要因子之一,是与肾脏纤维化联系最密切的炎症因子。TNF-α是单核巨噬细胞等分泌产生的具有多种生物学功能的细胞因子,它导致糖尿病肾病的生物学特性有:(1) 刺激系膜细胞产生氧自由基、前列腺素、白三烯等炎症介质,导致微血管损伤从而引起肾脏纤维化的发生[15];(2) 间接刺激巨噬细胞,诱导其释放部分细胞炎症介质;(3) 抑制胰岛素信号传递,引起胰岛素抵抗[16]。这些变化都能够导致肾脏纤维化的发生与发展。
巨噬细胞是一种炎症细胞,它在肾组织部位聚集、浸润,能够分泌各种炎症因子,如TNF-α和IL-1,加剧炎症,进而导致肾间质纤维化和肾小球硬化[17]。MIF也是巨噬细胞释放的一种炎症细胞因子,并且能够反作用于巨噬细胞,抑制巨噬细胞的移动,使其固定在肾组织炎症部位,促使其增殖、释放更多的TNF-α 等炎症趋化因子。因此,在肾组织MIF增多的区域会发现大量巨噬细胞的堆积,进而促进肾间质纤维化[18]。
本实验采用高糖高脂+STZ诱导2型糖尿病大鼠模型,选用天然药物葛根素与沙格列汀联用。本研究显示,与正常组大鼠比较,模型组大鼠血清中MIF与TNF-α的含量显著升高,肾脏中TNF-α、MIF和CD68 mRNA表达显著升高。据此推测,TNF-α、MIF和CD68 mRNA表达在糖尿病大鼠肾脏中的上升可能是糖尿病肾病的发病机制之一,这也与相关研究发现的糖尿病肾病形成的分子机制相同[2]。沙格列汀是一种高效DPP-4抑制剂,通过选择性抑制DPP-4来调节血糖,是一类新的降糖药。本实验结果显示,沙格列汀降低血糖与HbA1c,这与Auqeri等[19]报道的结果一致。本实验结果还显示,沙格列汀可降低血清中的MIF和TNF-α含量,下调肾脏中的TNF-α、MIF和CD68 mRNA表达。当葛根素联用沙格列汀时,以上指标下降的程度更加明显。
总之,葛根素联用沙格列汀对糖尿病大鼠肾脏纤维化具有改善作用,其机制可能与降低血糖、下调肾脏中TNF-α、MIF和CD68 mRNA表达有关。
[参 考 文 献]
[1] 杨云华,艾 维. 慢性肾脏病与肾脏纤维化研究进展[J]. 实用医学杂志, 2009, 25(20):3357-3359.
[2] 张 军,陶立坚. 肾脏纤维化的研究进展[J]. 国外医学:生理、病理科学与临床分册, 2002, 22(6):593-595.
[3] 肖 菲, 李劲松. 饮食护理对糖尿病患者血糖控制的影响[J]. 中国医药指南, 2012, 10(10):325-326.
[4] 刘 扬, 庞妩燕, 苏东月, 等. 葛根素对实验性2型糖尿病小鼠血糖的影响[J]. 中国现代药物应用, 2011, 5(17):52-53.
[5] 黄帧桧, 张 培, 杨 帆, 等. 葛根素对肾性高血压大鼠apelin-12、AngⅡ及NO 含量与血压的影响[J]. 中国病理生理杂志, 2011, 27(12):2323-2327.
[6] 肖立中, 黄 志, 马绍椿, 等. 葛根素对急性心肌梗死患者梗死面积的影响及其机制探讨[J]. 中国中西医结合杂志, 2004, 24(9):790-792.
[7] 易月娥, 聂彦娜, 李姝玉, 等. 葛根素注射液对糖尿病KKAy小鼠肾小管上皮细胞的影响[J]. 中国病理生理杂志, 2013, 29(12):2263-2267.
[8] 刘蕴玲, 陈少华, 陈秀彬. 葛根素对II型糖尿病人胰岛素敏感性的影响[J]. 辽宁实用糖尿病杂志, 2000, 8(1):26-27.
[9] Nadkarni P, Chepurny OG, Holz GG. Regulation of glucose homeostasis by GLP-1[J]. Prog Mol Biol Transl Sci, 2014, 121:23-65.
[10] Boulton DW, Li L, Frevert EU, et al. Influence of renal or hepatic impairment on the pharmacokinetics of saxagliptin[J]. Clin Pharmacokinet, 2011, 50(4): 253-265.
[11] Nasri H, Baradaran A, Ardalan MR, et al. Bright renoprotective properties of metformin: beyond blood glucose regulatory effects[J]. Iran J Kidney Dis, 2013, 7(6):423-428.
[12] Scheen AJ. Saxagliptin plus metformin combination in patients with type 2 diabetes and renal impairment[J]. Expert Opin Drug Metab Toxicol, 2012, 8(3):383-394.
[13] 郭啸华,刘志红,李 恒,等. 实验性2型糖尿病大鼠模型的建立[J]. 肾脏病与透析肾移植杂志, 2000, 9(4):351-355.
[14] Katafuchi R, Kiyoshi Y, Oh Y, et al. Glomerular score as a prognosticator in IgA nephropathy its usefulness and li-mitation[J]. Clin Nephrol, 1998, 49(1):1-8.
[15] 喻 嵘, 张晓白, 闻晓东, 等. 肾复宁对肿瘤坏死因子诱导大鼠肾系膜细胞增殖的干预作用[J]. 湖南中医学院学报, 2006, 26(1):13-15.
[16] 李敏娟. 2型糖尿病肾病与肿瘤坏死因子-α及胰岛素抵抗的相关性分析[J]. 河北医药, 2010, 32(17):2341-2342.
[17] 李 静, 李荣山. 巨噬细胞在大鼠糖尿病肾病发病机制中的作用[J]. 中国中西医结合肾病杂志, 2005, 6(2):79-82.
[18] Rice EK, Tesch GH, Cao Z, et al.Induction of MIF synthesis and secretion by tubular epithelial cell: a novel action of angiotensin II[J]. Kidney Int, 2003, 63(4):1265-1275.
[19] Augeri DJ, Robl JA, Betebenner DA, et al. Discovery and preclinical profile of Saxagliptin (BMS-477118):a highly potent, long-acting, orally active dipeptidyl peptidase IV inhibitor for the treatment of type 2 diabetes[J]. J Med Chem, 2005, 48(15):5025-5037.
