Ir在La2O2CO3(001)表面吸附的理论研究
2014-08-08聂召敏潘金旺王子芫郑文旭
聂召敏,潘金旺,王子芫,郑文旭
(华南农业大学理学院,广东广州510642)
随着世界经济的发展,社会对能源的需求量日益增加.而矿物燃料的燃烧使用带来了严重的环境问题,同时矿物燃料带来的环境问题也日益加重.因此寻找可持续发展的替代能源成为当今世界迫切需要解决的问题.燃料电池作为新一代清洁能源受到了广泛的重视[1-3].燃料电池是一种通过电化学反应直接将化学能转化为电能的方式,只要向电极供给“燃料”(如氢气、甲醇和乙醇等)和氧化剂,就可连续地进行由化学能向电能的直接转化[4].燃料电池的能量转化效率高[5-6],中间不经过燃烧过程,因而不受卡诺循环的限制,燃料电池理论效率可以高达80%以上[4].燃料电池的理想燃料是高纯氢气,所以,燃料电池的关键技术之一就是氢气的制造[7-8].
近年来,醇类水蒸气重整制氢受到广泛关注,显示出较大的优越性[9].醇类水蒸气重整制氢反应中,高选择性,高稳定性,高活性催化剂是该领域的主要研究方向.目前,如何在较低温度的条件下以高转化率和高选择性制得氢气是乙醇制氢技术研究中的重点,众多研究表明,高效的活性组分和适当的载体都对催化剂的性能具有非常大的影响[10-15].
彭峰课题组在醇类水蒸气重整制氢方面设计了性能良好的Ir/La2O2CO3负载型催化剂,研究发现:在催化剂中掺杂Ca可以有效提高Ir的分散度,各种表征结果说明掺杂Ca之后载体和金属之间的相互作用增强,催化效果显著提高[16].但是,对于掺杂以后催化剂的结构及作用机理尚不明确.本文为研究Ca掺杂Ir/La2O2CO3催化剂结构与Ca对Ir吸附的影响及其机理,使用密度泛函(DFT)方法计算了La2O2CO3(001)表面上Ca掺杂前后Ir在各吸附位点上的吸附情况.
1 计算方法
本文运用第一性原理的密度泛函理论(DFT)和周期性平板模型相结合的方法,使用维也纳从头计算程序包(VASP)[17-18]对催化剂体系进行了模拟计算.在计算中,使用了超软赝势PAW方法[19],交换关联能部分使用了由J.P.Perdew等[20]提出的广义梯度近似.La2O2CO3晶体(图1)片层间真空层设置为1.5 nm,该层空层厚度足够保证片层间原子不发生相互作用.由于体系所取晶包足够大(1.4×1.4×2.1 nm3),所以计算中使用了Gamma点进行几何优化并使用(3×3×2)Monkhorst-Pack meshK点进行能量计算[21].
2 结果与讨论
2.1 未掺杂Ca载体对Ir的吸附为表征Ir在载体La2O2CO3(001)表面上的吸附强度,对不同吸附位点上的吸附能进行了计算,吸附能定义为
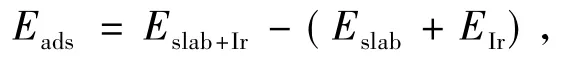
其中,Eslab+Ir为吸附 Ir后体系总能量,Eslab为载体(图1)总能量,EIr为 Ir总能量.如图 1,La2O2CO3(001)表面La原子与O原子呈La—O六元环结构,Ir原子在表面上可能的吸附位点有与氧原子作用的顶位垂直、桥位垂直、桥位平行与穴位倾斜,吸附后体系结构如图2所示.分别计算各个吸附位点的吸附能即可得到最佳吸附位点.同时,吸附能也能反映Ir在载体上相互作用情况,并可由此推断出Ir/La2O2CO3催化剂的一些性质.
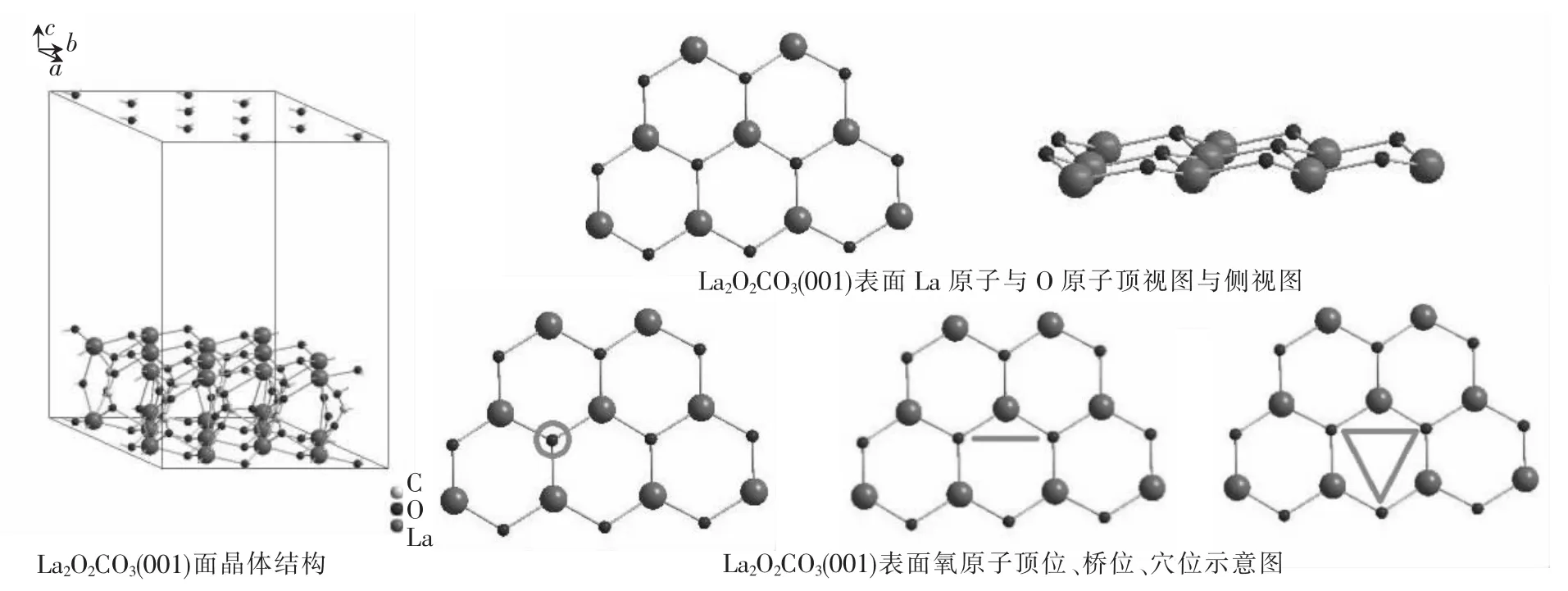
图1 La2O2CO3(001)面的优化结构Fig.1 Optimized structures of La2O2CO3(001)surface
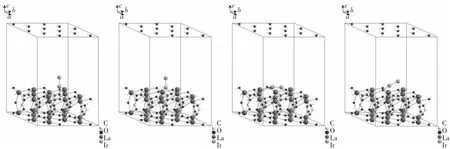
图2 Ir在La2O2CO3(001)表面吸附的优化结构Fig.2 Optimized structures for adsorption of Ir on La2O2CO3(001)surface
计算结果表明:Ir在La2O2CO3(001)上顶位垂直、桥位垂直、穴位倾斜、桥位平行等各位点吸附能分别 为 -400.978、-315.628、-449.433、-479.863 kJ/mol,Ir在 La2O2CO3(001)面上各位点处都与表面发生强相互作用,最弱的吸附位点垂直桥位吸附能也达到-315.628 kJ/mol,为化学吸附.最佳吸附位点平行顶位则达到-479.863 kJ/mol.有文献[22]指出,镧物种能与活性金属氧化物发生强相互作用,并与之形成M-La-O,M-La-C-O复合物种,计算结果与文献相符合.同时,Ir与La2O2CO3表面原子发生强相互作用意味着该催化剂中Ir的粒径将有效降低,由此可预见该体系X射线衍射图上没有Ir峰.杨光星在其工作中所制备的Ir/La2O3催化剂在XRD表征中没有出现Ir/IrO2物相峰,与计算结果相吻合[16].
对体系中吸附能最大两者(穴位倾斜、桥位平行)态密度(DOS)(如图3)计算表明,桥位平行与穴位倾斜两种吸附位点DOS整区间均为尖峰,说明d电子相对局域,对应能带相对较窄.同时,图中可见两种吸附作用在费米能级处态密度均为0,故两者均为绝缘体.两者对比发现两种吸附结果能带结构大致相当,而桥位平行吸附在-5 eV能级附近有一较窄d电子能带.
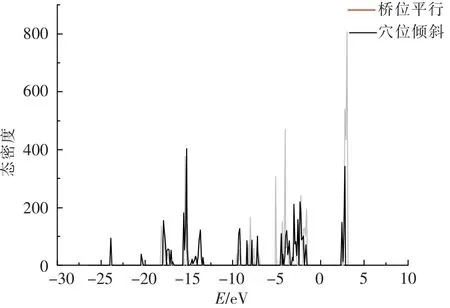
图3 桥位平行与穴位倾斜吸附态密度图Fig.3 Density of states for bridge and hole adsorption
2.2 掺杂Ca载体对Ir的吸附本文采用DFT方法研究了La2O2CO3(001)表面掺杂后Ir的吸附性能,掺杂物为Ca.碱土金属氧化物是常用的碱性催化剂助剂,选择Ca的原因是Ca共价半径(174 pm)与La(169 pm)大致相当,且有文献报道氧化镧系催化剂掺杂碱土金属后催化性能有所改善[16].通过计算掺杂前后吸附能的变化,分析Ca掺杂对Ir在碳酸氧镧001面上的吸附有无相关影响.
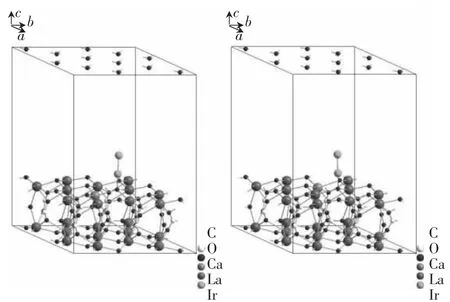
图4 Ca掺杂La2O2CO3(001)表面吸附Ir示意图Fig.4 Diagram for adsorption of Ir on Ca-doped La2O2CO3(001)surface
在所计算的体系中,Ca的掺杂率为0.8%.一个典型的掺杂示例如图4所示,即Ir在Ca掺杂的La2O2CO3(001)面上顶位垂直吸附结构图.可见吸附位点上,Ca有两种掺杂方式,分别为近端吸附(左)和远端吸附(右).与未掺杂体系相类似,将分别讨论如图5所示的顶位垂直、桥位垂直、穴位倾斜、桥位平行4种吸附位点的近端、远端掺杂情况.
Ca掺杂后Ir在La2O2CO3(001)上桥位垂直、桥位平行、顶位垂直、穴位倾斜等各位点吸附能近端掺 杂 时 分 别 为 -500.507、-676.971、-464.914、-424.969 kJ/mol,远端掺杂时分别为-428.396、-626.378、-415.944、N/A kJ/mol,可见近端掺杂时吸附能较远端掺杂更高.除穴位倾斜外,其它吸附位点在掺杂后吸附能都有所提高.其中桥位平行吸附位点尤为突出,掺杂后吸附能(-676.971 kJ/mol近端,-626.378 kJ/mol远端)远高于其他3种吸附位点;纵向对比,掺杂后吸附能提高亦最为明显(ΔE=-184.878 kJ/mol近端,ΔE=-112.763 kJ/mol远端).H.Jeong 等[23]研究CO2转化合成气的实验中发现,碱土金属助剂减少Ni/Al2O3催化剂中Ni粒度,抑制Ni纳米颗粒的烧结,从而提高催化效率.而在Ir/La2O2CO3体系中Ca的掺杂应起到相同作用.体系中引入Ca原子后,Ir吸附能显著提高,Ir与La2O2CO3表面的强相互作用较未掺杂体系大大提高,因而能明显地提高催化剂的活性与稳定性.而吸附能的提高有利于烧结时维持Ir颗粒在La2O2CO3表面的吸附,减少Ir脱离并团聚烧结,从而提高了催化剂成品的活性.
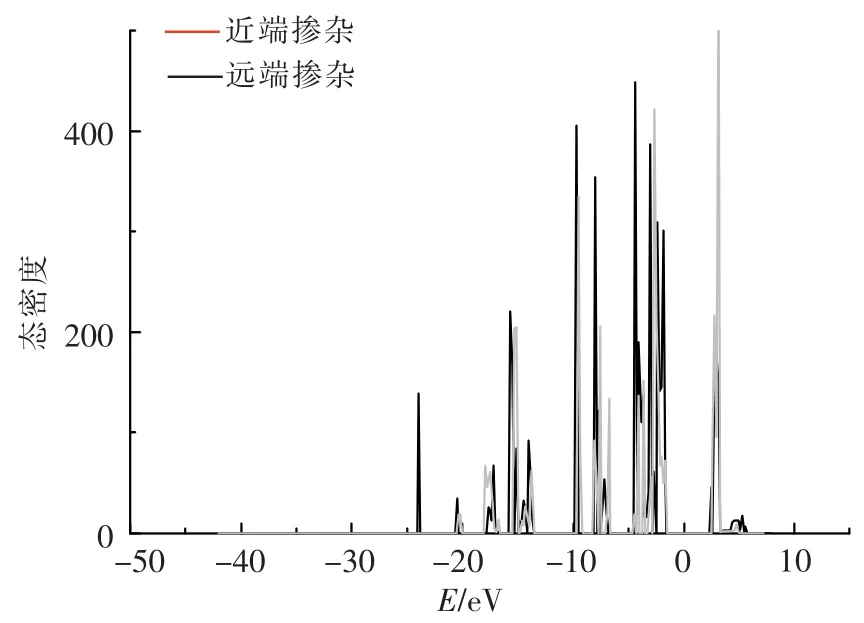
图6 Ca掺杂La2O2CO3(001)表面Ir桥位平行吸附态密度Fig.6 Density of states for bridge adsorption of Ir on Ca-doped La2O2CO3(001)surface
从结构示意图可以看出,Ca的掺杂并未对碳酸氧镧001表面结构造成破坏,依旧维持原有的M—O六元环结构.Ca在表面上稍有向内层凹陷的趋势,可能是由于Ca更趋向于形成Ca2+离子,与内层形成碳酸钙嵌于La2O2CO3晶体中.故推测提高Ca掺杂率后,体系X射线衍射会出现碳酸钙盐物相峰.实验证明当Ca掺杂量达到9%时,XRD结果出现CaCO3的衍射峰,与计算结果相吻合[16].
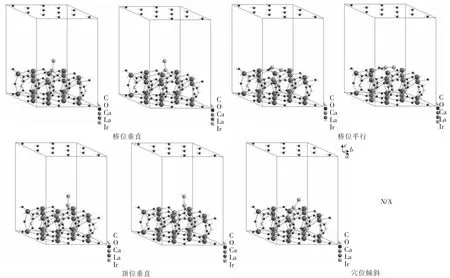
图5 Ir在Ca掺杂的La2O2CO3(001)上各位点吸附的优化结构Fig.5 Optimized structures for adsorption of Ir on Ca-doped La2O2CO3(001)surface
掺杂后桥位平行吸附位点的DOS如图6所示.由图6可见,2种掺杂体系DOS整区间均为尖峰,说明d电子相对局域,对应能带相对较窄.费米能级处态密度为0,无能带穿过,故掺杂后体系仍为绝缘体.近端掺杂体系中,可见5 eV能级附近有一较扁平峰,该处应为Ca在近端掺杂后与氧原子外层电子所成的非局域sp带.同时,近端掺杂体系中-24 eV能级附近可见一较窄d电子能带,该能带填充23电子,而并未在远端掺杂体系中出现.
3 结语
本文讨论了载体La2O2CO3(001)Ca掺杂前后对Ir的吸附情况.结果表明,掺杂前Ir在该载体上各个吸附位点都与表面原子发生了较强的化学吸附,其中以平行顶位的吸附位点吸附能达到最高-479.863 kJ/mol,可以认为桥位平行即为 Ir在La2O2CO3表面吸附中最佳的吸附位点.掺杂后,桥位平行仍为最佳吸附位点,且吸附能增加了-184.878 kJ/mol(近端),-112.763 kJ/mol(远端).吸附能的提高能有效降低Ir在La2O2CO3中的粒度,该结果从理论上分析了Ca原子的掺杂能有效提高Ir/La2O2CO3催化剂的催化性能.
[1]Di Lorenzo M,Thomson A R,Schneider K,et al.A small-scale air-cathode microbial fuel cell for on-line monitoring of water quality[J].Biosens Bioelectron,2014,62:182-188.
[2]Ratnasamy C,Wagner J P,Spivey S,et al.Removal of sulfur compounds from natural gas for fuel cell applications using a sequential bed system[J].Catal Today,2012,198(1):233-238.
[3]Zhu Z W,Qian J,Wang Z T,et al.High-performance anode-supported solid oxide fuel cells based on nickel-based cathode and Ba(Zr0.1Ce0.7Y0.2)O3-delta electrolyte[J].J Alloys Compd,2013,581:832-835.
[4]小泽昭弥.现代电化学[M].北京:化学工业出版社,1995.
[5]Zhang H,Michael K H L,Xuan J,et al.Energy and exergy analysis of microfluidic fuel cell[J].Int J Hydrogen Energy,2013,38(15):6526-6536.
[6]Pak C,Kang S,Choi Y S,et al.Nanomaterials and structures for the fourth innovation of polymer electrolyte fuel cell[J].J Mater Res,2010,25(11):2063-2071.
[7]Gianotti E,Reyes-Carmona A,Taillades-Jacquin M,et al.Study of the effect of addition of In to Pt-Sn/-Al2O3catalysts for high purity hydrogen production via partial dehydrogenation of kerosene jet A-1[J].Appl Catal:Environ,2014,B160/161:574-581.
[8]Queiroz A C,Silva W O,Rodrigues I A,et al.Identification of bimetallic electrocatalysts for ethanol and acetaldehyde oxidation:Probing C-2-pathway and activity for hydrogen oxidation for indirect hydrogen fuel cells[J].Appl Catal:Environ,2014,B160:423-435.
[9]Maggio G,Freni S,Cavallaro S.Light alcohols/methane fuelled molten carbonate fuel cells:a comparative study[J].J Power Sources,1998,74(1):17-23.
[10]Frusteri F,Freni S,Spadaro L.H2production for MC fuel cell by steam reforming of ethanol over MgO supported Pd,Rh,Ni and Co catalysts[J].Catal Commun,2004,5(10):611-615.
[11]Cavallaro S,Chiodo V,Freni S,et al.Performance of Rh/Al2O3catalyst in the steam reforming reforming of ethanol:H2production for MCFC[J].Appl Catal:Gen,2003,A249(1):119-128.
[12]Llorca J,Homs N,Sales J,et al.Efficient production of hydrogen over supported cobalt catalysts from ethanol steam reforming[J].J Catal,2002,209(2):306-317.
[13]Roy B,Artyushkova K,Pham H N,et al.Effect of preparation method on the performance of the Ni/Al2O3catalysts for aqueous-phase reforming of ethanol:Part II-characterization[J].Int J Hydrogen Energy,2012,37(24):18815-18826.
[14]de Lima S M,da Silva A M,da Costa L O O,et al.Study of catalyst deactivation and reaction mechanism of steam reforming,partial oxidation,and oxidative steam reforming of ethanol over Co/CeO2catalyst[J].J Catal,2009,268(2):268-281.
[15]Li S,Lu Y J,Guo L J,et al.Hydrogen production by biomass gasification in supercritical water with bimetallic Ni-M/gamma Al2O3catalysts(M=Cu,Co and Sn)[J].Int J Hydrogen Energy,2011,36(22):14391-14400.
[16]Yang G X,Yu H,Huang X Y,et al.Effect of calcium dopant on catalysis of Ir/La2O3for hydrogen production by oxidative steam reforming of glycerol[J].Appl Catal:Environ,2012,B127:89-98.
[17]Kresse G,Hafner J.Norm-conserving and ultrasoft pseudopotentials for first-row and transition-elements[J].J Phys:Condens Matter,1994,6:8245-8257.
[18]Kresse G,Joubert D.From ultrasoft pseudopotentials to the projector augmented-wave method[J].Phys Rev,1999,B59:1758-1775.
[19]Vanderbilt D.Soft self-consistent pseudopotentials in a generalized eigenvalue formalism[J].Phys Rev,1990,B41:7892-7895.
[20]Perdew J P,Burke K,Ernzerhof M.Erratum:generalized gradient approximation made simple[J].Phys Rev Lett,1997,78:1396-1396.
[21]Li B,Metiu H.Does Halogen adsorption activate the oxygen atom on an oxide surface?I.A study of Br2and HBr adsorption on La2O3and La2O3doped with Mg or Zr[J].J Phys Chem,2012,C116:4137-4148.
[22]陈鸿庆.乙醇重整制氢Ir-La催化剂设计及微反性能优化[D].广州:华南理工大学,2010.
[23]Jeong H,Kim K I,Kim D,et al.Effect of promoters in the methane reforming with carbon dioxide to synthesis gas over Ni/HY catalysts[J].J Mol Catal:Chem,2006,A246(1/2):43-48.
