普通鹿蹄草品质与根际和非根际土壤的关系
2014-08-08耿增超孟令军刘建军
耿增超,孟令军,刘建军
(1. 西北农林科技大学资源环境学院, 杨凌 712100;2. 西北农林科技大学林学院, 杨凌 712100;3. 宁夏贺兰山森林生态系统定位研究站,银川 750000)
普通鹿蹄草品质与根际和非根际土壤的关系
耿增超1,3,孟令军1,*,刘建军2,3
(1. 西北农林科技大学资源环境学院, 杨凌 712100;2. 西北农林科技大学林学院, 杨凌 712100;3. 宁夏贺兰山森林生态系统定位研究站,银川 750000)
以野外调查和室内分析相结合,采用相关分析、主成分分析、回归分析、通径分析等多种分析方法,对秦岭太白山区不同生境下野生普通鹿蹄草有效成分(总黄酮、单宁、金丝桃苷、槲皮素和抗氧化活性(DPPHIC50)与其根际和非根际土壤性质的关系做了研究。结论如下:(1)根际土壤速效钾、pH和脲酶与单个有效成分含量之间呈现出显著或极显著作用,而非根际土壤速效钾与5种有效成分均达到显著或极显著正相关。(2)根际土壤速效钾、pH、转化酶和脲酶是影响普通鹿蹄草有效成分含量的主导因子,而非根际土壤有效氮、速效钾、pH和转化酶是综合影响其含量的主导因子。(3)根际土壤速效钾是影响普通鹿蹄草有效成分含量的主要决策因素,而pH、转化酶和脲酶是其主要限制因素;非根际土壤有效氮和速效钾是影响普通鹿蹄草有效成分含量的主要决策因素,而pH和转化酶是其主要限制因素。由此得出,普通鹿蹄草有效成分含量受根际和非根际多种土壤因子的综合影响,且土壤速效钾含量、pH、转化酶是影响其含量的共同因子。
普通鹿蹄草;品质;根际;有效成分;土壤因子
普通鹿蹄草(Pyroladecorata)是多年生常绿草本植物,为鹿蹄草科鹿蹄草属,在我国分布广泛,在秦岭山区主要有鹿蹄草、普通鹿蹄草、皱叶鹿蹄草和紫背鹿蹄草共4种鹿蹄草植物,它们主要生长在海拔 1300—2800 m范围内阔叶林和针阔混交林下[1- 2]。由于鹿蹄草具有广谱抗菌、抗炎、抗肿瘤以及止咳平喘等作用,已经成为一种重要的药用资源[3- 4]。近年来,由于野生鹿蹄草具有重要的药用价值而被大量采挖,其数量正逐渐减少,因此,开展其野生资源的研究对于合理保护野生鹿蹄草具有重要意义。目前,国内外有关鹿蹄草属植物的研究越来越受重视,主要集中在对其分布状况[5- 6]、化学成分[7- 8]及医学功能[9- 10]等方面,但对其化学成分与根际环境之间关系的研究鲜有报道。土壤因子对中草药的品质有重要影响,近年来国内许多学者对怀菊[11]、泽泻[12]、枸杞[13]、华细辛[14]等中草药的有效成分与土壤因子的关系进行了大量研究,而有关中草药有效成分与根际土壤因子的关系研究尚未见报道。根际作为植物与土壤环境最紧密的接触面,是植物、土壤、微生物共同影响的特殊生态领域,对外界环境极为敏感[15]。有研究指出,植物通过光合作用合成的含碳化合物大约有30%—60%直接分配到根系,而其中40%—70%又被释放到根际中[16],因此,植物根际的研究,可以更深入反映植物生境的变化规律,因而越来越受到学者的重视[17- 19]。鉴于此,本研究分析了不同样地普通鹿蹄草有效成分间的差异,通过研究其品质与根际和非根际土壤养分和酶活性之间的关系,明确影响普通鹿蹄草品质的主要土壤因子及其作用特征和规律,以期为野生鹿蹄草资源的保护和利用以及人工引种和规范标准化栽培管理提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于陕西省眉县太白山国家级自然保护区蒿坪管理站境内(34°01′—34°05′ N,107°41′—107°43′ E),海拔 1 300—2 800 m,位于秦岭山脉中段。该区域年平均气温 12.9 ℃,7月份均温27.1 ℃,年积温≥10℃为3803.8℃,年平均降雨量 609.5 mm,年平均日照时间2 015 h,无霜期 160 d,相对湿度69.4%。该区域属于典型的暖温带半湿润气候,并且有明显的气候垂直带,年平均气温在海拔 1000—2000 m为 11.4 ℃[20]。
1.2 研究方法
根据实地调查中普通鹿蹄草的分布规律,选择6块林地下普通鹿蹄草植物和根际土壤作为研究对象(表1)。实验样品均采集于2010年8月。林地大小设为30 m×30 m,并在每块林地内设置3个10 m×10 m的样方作为重复,每个采样点随机取样,重复3次,然后将土壤和植物分别混匀,用四分法取一小部分作为一个样品。根际和非根际土壤用抖落法[21]采集,具体方法是先挖取具有完整根系的土体,将鹿蹄草根系剪断,轻轻抖落不含根系的土壤,视为非根际土壤,然后将根表面附着的土壤全部抖落下来,仍然粘在根上的,用软毛刷将土壤轻刷收集至土壤样品袋中,混匀后获得根际土壤。采集后的土壤和植物样品用无菌袋承装,密封、低温条件(4℃)保存。植物样品在45℃下烘干磨细后,过0.60 mm筛后备用。对根际土壤,处于半干状态时,将土壤轻轻压碎,用尼龙筛挑出其中的细根等杂物。土壤样品经室内风干后研磨过筛,其中 1 mm 筛孔土样用于测定土壤速效养分和酶活性,0.25 mm 筛孔土样用于测定土壤全量养分。
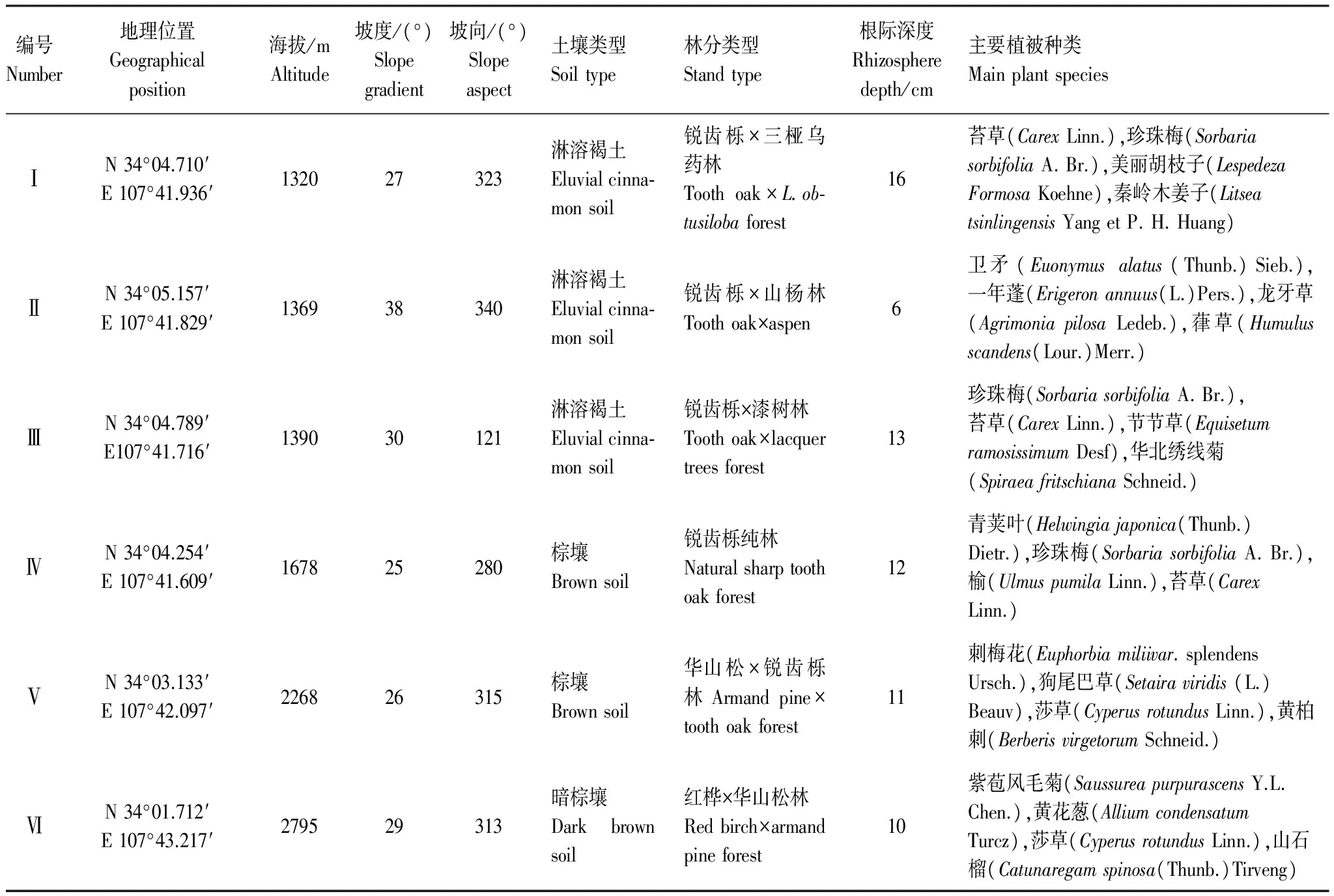
表1 样地基本概况
1.2.1 土壤测定方法
土壤化学分析采用常规方法进行。其中,pH采用电位法(水 ∶土=2.5 ∶1),有机质采用K2Cr2O7氧化-外加热法,全氮含量采用半微量凯氏法,全磷含量采用HClO4-H2SO4消煮-钼锑抗比色法,全钾含量采用NaOH熔融-火焰光度法,有效氮含量采用1 mol/L KCl浸提-连续流动分析仪法,有效磷含量采用0.5 mol/L NaHCO3浸提-钼锑抗比色法,速效钾含量采用1 mol/L NH4OAc浸提-火焰光度法。土壤转化酶活性用 3,5-二硝基水杨酸比色法,以 24 h 后每g土壤中的葡萄糖(mg)表示;土壤脲酶活性用苯酚钠比色法测定,以 24 h 后每g土生成的氨(mg)来表示;土壤过氧化氢酶活性用高锰酸钾滴定法测定,以单位质量土消耗的高锰酸钾(mL)表示;土壤酸性磷酸酶活性用磷酸苯二钠法测定,以 12 h 每g土产生的酚(mg)表示[22]。
1.2.2 植物测定方法
(1) 提取液的制备
称取普通鹿蹄草干粉20.00 g置于烧瓶中,加200 mL乙醚脱脂提取2 h,过滤,弃去滤液。按料液比为1∶20加入体积分数为70%乙醇400 mL,在80℃热水浴中回流提取3 h,过滤,重复操作2次,合并2次提取液,减压浓缩,用70% 乙醇定容至50 mL。用于总黄酮含量的测定,剩余提取液浓缩、烘干至恒重。
(2)总黄酮含量测定
采用NaNO3-Al(NO3)3显色法,在510 nm波长下测定其吸光度。线性回归方程为:
y=13.067x+0.0367,r=0.9998
(3) 单宁含量、金丝桃苷含量、槲皮素含量的测定
采用HPLC测定3种成分,仪器为美国安捷伦公司生产的 1200 高效液相色谱仪,色谱条件为:ZORBAXSB-C18色谱柱;流动相为甲醇- 0.5%磷酸溶液(50∶50);流速1mL/min;进样量为20μL;检测波长为370nm;柱温25℃。样品液的制备:准确称取鹿蹄草提取物100.00mg,甲醇溶解定容至10mL容量瓶中,即得单宁、金丝桃苷、槲皮素待测液。配成不同系列浓度后,按上述色谱条件测定,以峰面积(Y)为纵坐标,质量浓度(X, mg/mL)为横坐标,进行线性回归,得3种成分的回归方程:
单宁Y=1834.64X+0.87,r=0.9999,
线性范围为10—200μg/mL;
金丝桃苷Y=20748.37X-7.83,r=0.9997,
线性范围为25—500μg/mL;
槲皮素Y=57170.12X-119.26,r=0.9998,
线性范围为5—100μg/mL。
(4) 抗氧化活性能力(DPPHIC50)的测定
抗氧化活性能力(DPPHIC50)采用体外DPPH·自由基清除法测定。称取普通鹿蹄草提取物0.10g,再用50%乙醇溶解定容至50mL,稀释成不同浓度的的待测液,取上述待测液2mL,加2mL0.1mmol/mLDPPH溶液,混匀,避光反应30min,测定在517nm下的吸光度。
清除率(SA)的公式为:
SA(%)=[1-(Ai-Aj)/Ao]×100
式中,Ai为样品溶液的吸光值;Aj为空白样吸光值;Ao为对照组吸光值。
1.3 数据处理
数据分析和处理使用软件SPSS 18.0。用单因素方差分析法(One-way ANOVA)分析数据的差异显著性,显著性设为α= 0.01。用相关分析(Correlation Analysis)、主成分分析(Principal Components Analysis)、逐步回归分析(Stepwise Regression Analysis)和通径分析(Path Analysis)多种分析方法比较普通鹿蹄草根际土壤因子对有效成分含量的影响。
2 结果与分析
2.1 普通鹿蹄草有效成分含量分析
由表2可以看出,不同样地间普通鹿蹄草有效成分含量及抗氧化活性值均存在差异。其中,在不同样地间,总黄酮含量(介于1.67—2.28 mg/g之间)表现为差异较小,而其他有效成分含量则均存在较大差异。Ⅲ号样地的单宁、金丝桃苷和槲皮素含量(分别为31.84 mg/g、1.79 mg/g、130.77 μg/g) 明显高于其它样地,而总黄酮含量和DPPHIC50值(分别为1.67 mg/g、9.02 μg/mL)都低于其他样地,这可能是由于前3种与后两种成分之间有拮抗作用,从而引起不同的变化趋势。普通鹿蹄草根际与非根际土壤因子的实测值分别见表3和表4。
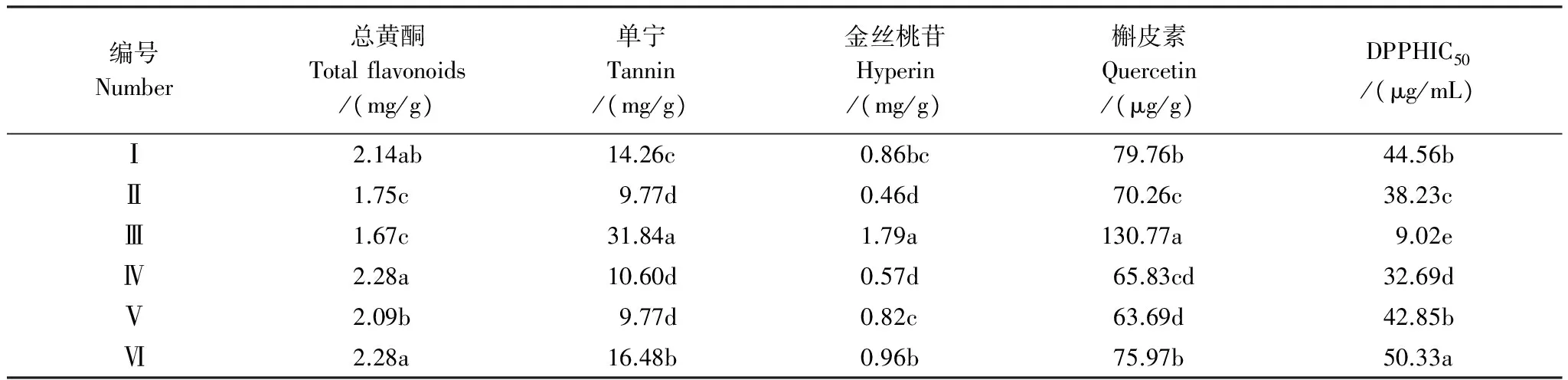
表2 普通鹿蹄草有效成分含量及抗氧化活性值(n=3)
同列不同小写字母表示差异显著(α=0.01)
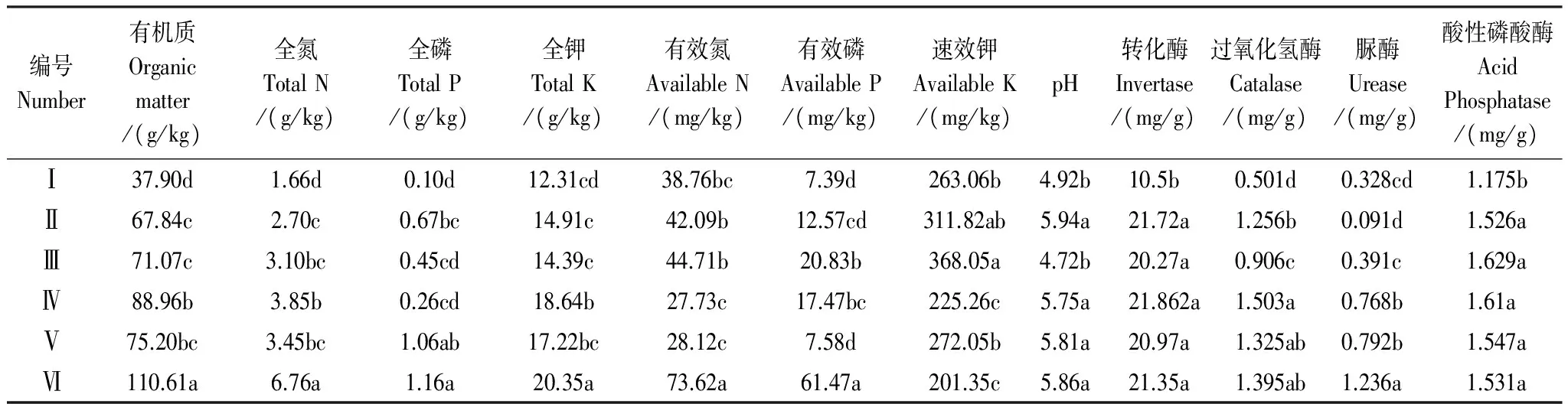
表3 普通鹿蹄草根际土壤养分与酶活性(n=3)

表4 普通鹿蹄草非根际土壤养分与酶活性(n=3)
2.2 普通鹿蹄草有效成分含量与根际和非根际土壤因子的分析
2.2.1 普通鹿蹄草有效成分含量与土壤因子的相关性分析
从表5可以看出,相关性分析表现为总黄酮含量与根际土壤速效钾含量呈极显著负相关,而与根际土壤脲酶含量呈极显著正相关。单宁、金丝桃、槲皮素含量与根际土壤pH均呈极显著负相关,而DPPHIC50与之呈显著正相关,此外,槲皮素含量与根际土壤速效钾呈极显著正相关,而DPPHIC50与之呈极显著负相关。从表6可以看出,相关性分析表现为总黄酮含量与非根际土壤速效钾含量呈极显著负相关,与非根际土壤有效氮和过氧化氢酶呈显著负相关,而与非根际土壤脲酶活性呈显著正相关。单宁和金丝桃苷含量与非根际土壤速效钾均呈显著正相关,槲皮素含量和DPPHIC50与非根际土壤速效钾均呈极显著正相关。由上述分析可见,单一的对应关系只能表现出普通鹿蹄草中一种成分和根际土壤因子的相关性,而无法反映出影响普通鹿蹄草品质的共同因子,因此,须进一步对其内在关系进行深入分析。

表5 普通鹿蹄草有效成分含量与根际土壤因子的相关系数
*表示P< 0.05;**表示P< 0.01
2.2.2 普通鹿蹄草有效成分含量的主成分分析
主成分分析可以在不损失或很少损失原有信息的前提下,将原来个数较多且彼此相关的多个变量转换为个数较少而彼此独立的变量,从而可以简化多指标分析。对普通鹿蹄草有效成分含量的5个指标进行主成分分析可知,前2个公因子的累计方差贡献率,已涵盖了全部信息的94.49 %,因此提取这2个公因子,因子分析表达式为:
F1= -0.354Z1+0.478Z2+0.458Z3+0.492Z4-0.441Z5
F2= 0.799Z1+0.312Z2+0.419Z3+0.124Z4+0.269Z5
式中,F1中单宁、金丝桃、槲皮素和DPPHIC50占的比重分别为0.478、0.458、0.492、-0.441,占影响因素的80.58 %;F2中总黄酮占0.799,但仅占影响因素的13.91 %。第一公因子占全部提取信息的比重较大,为主要影响因子,所以选取F1作主成分,更能代表有效成分含量的共同因子。

表6 普通鹿蹄草有效成分含量与非根际土壤因子的相关系数
2.2.3 土壤因子对F1的逐步回归分析
进一步就根际和非根际土壤因子对普通鹿蹄草有效成分F1的影响进行逐步回归分析,以主成分F1为因变量Y,以12个土壤因子有机质(X1)、全氮(X2)、全磷(X3)、全钾(X4)、有效氮(X5)、有效磷(X6)、速效钾(X7)、pH(X8)、转化酶(X9)、过氧化氢酶(X10)、脲酶(X11)、酸性磷酸酶(X12)为自变量,建立回归方程初始参数的选择标准是自变量对因变量作用的显著程度,从大到小逐个引入,直到既无不显著的变量总回归方程中剔除(F>0.01),又无显著变量可引入(F<0.05)回归方程为止。由此分别得到以下方程:
YR=1.2527+0.1501X7+0.0493X8-0.0449X9+0.3959X11(R2=0.9994,P=0.0001)
YN=-17.7249+4.2880X5+0.1403X7+0.3244X8-34.4890X9(R2=0.9993,P=0.0001)
上述方程式中,R2反映了普通鹿蹄草有效成分含量中被土壤因子解释的比例。式中,YR代表根际土壤因子对F1回归方程,YN代表非根际土壤因子对F1回归方程。由上述方程可看出,由于各逐步回归分析中R2均较大,表明所提取的普通鹿蹄草根际和非根际土壤因子能较好地解释普通鹿蹄草有效成分F1的指标。此外,根际土壤速效钾(X7)、pH(X8)、转化酶(X9)和脲酶(X11)是综合影响普通鹿蹄草的有效成分含量的主导因子,而非根际土壤有效氮(X5)、速效钾(X7)、pH(X8)和转化酶(X9)是综合影响普通鹿蹄草的有效成分含量的主导因子。
2.2.4 土壤因子对F1的通径分析
通径分析是研究变量间相互关系、自变量对因变量作用方式、程度的多元统计分析方法。通过它能够找出自变量对因变量影响的直接效应和间接效应,比简单相关分析更深入、全面地分析指标间相互影响程度[23]。
对上述4种根际土壤因子与F1进行通径分析(表7)。由相关系数可以看出,脲酶(X11)>速效钾(X7)>pH(X8)>转化酶(X9),其中速效钾和脲酶对F1表现为正效应,而pH和转化酶表现为负效应。直接作用系数表现为脲酶(X11)>pH(X8)>速效钾(X7)>转化酶(X9),其中pH对F1表现为负效应,而其他3种土壤因子均表现为正效应。间接作用系数表现为pH(X8)>转化酶(X9) >速效钾(X7)>脲酶(X11),其中速效钾和pH对F1表现为正效应,而转化酶和脲酶对F1表现为负效应。
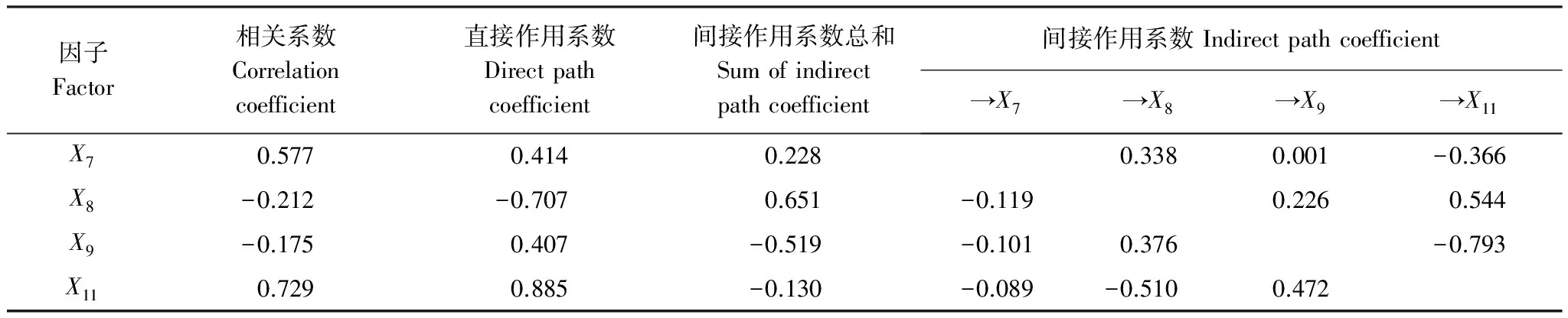
表7 普通鹿蹄草有效成分含量与根际土壤因子的相关和通径分析
对上述4种非根际土壤因子与F1进行通径分析(表8)。由相关系数可以看出,速效钾(X7)>有效氮(X5)>转化酶(X9)> pH(X8),其中有效氮和速效钾对F1表现为正效应,而pH和转化酶表现为负效应。直接作用系数表现为pH(X8) >转化酶(X9) >速效钾(X7)>有效氮(X5),其中转化酶对F1表现为负效应,而其他3种土壤因子均表现为正效应。间接作用系数表现为转化酶(X9)>pH(X8)>有效氮(X5)>速效钾(X7),其中有效氮、速效钾和转化酶对F1表现为正效应,而pH对F1表现为负效应。
2.2.5 土壤因子对F1的决定程度分析
每个土壤因子的决定系数大小反映了影响程度的强弱,因此就各个土壤因子对F1的绝对影响程度作进一步分析。决策系数可以反映自变量对因变量综合作用的大小,它可对通径分析结果进行更准确的分析和判断。决策系数的计算公式为:
式中,bi为直接作用系数,riy为间接作用系数总和。
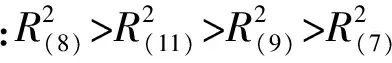

3 讨论与结论
普通鹿蹄草作为一种重要的中草药,其品质与根际土壤环境之间联系紧密,相互影响。因此,根际和非根际土壤因子是影响普通鹿蹄草有效成分含量的重要因素。对普通鹿蹄草有效成分含量与根际土壤因子相关性研究发现,普通鹿蹄草根际土壤 pH与五种有效成分含量相关系数均较高,且根际和非根际土壤 pH 都是普通鹿蹄草有效成分含量最主要的限制因素,这与孔璐[24]等的研究结果相似,表明土壤酸碱度与普通鹿蹄草有效成分含量之间有着紧密的关系,而且在其他土壤因子保持一定水平时,弱酸环境下,除总黄酮和DPPHIC50外,更有利于普通鹿蹄草其它有效成分的累积,对于其影响机理尚需进一步研究。回归分析表明,根际土壤速效钾、pH、转化酶和脲酶综合影响普通鹿蹄草的有效成分含量,是主导因子,它们之间存在着显著或极显著的线性关系。卜静等[25]研究也表明,土壤 pH 和钾素含量对玉竹有效成分的积累也有重要作用。通径分析表明,根际土壤脲酶活性是综合影响普通鹿蹄草有效成分含量的最重要因子,土壤速效钾含量在根际和非根际对普通鹿蹄草有效成分含量影响均较大,这主要是由于在根际土壤脲酶活性的增强与黄酮和DPPHIC50的积累密切相关,而根际和非根际土壤速效钾含量的增加有利于单宁、金丝桃苷、槲皮素的积累,而抑制黄酮和DPPHIC50的积累。根际土壤有效氮和非根际土壤有效氮、速效钾分别是影响普通鹿蹄草有效成分含量的主要决策因素,这可能是由于鹿蹄草体内一些化学物质的合成和积累与氮素和磷素的活化有着密切的关系,而且在实践中施用氮肥和磷肥可提高土壤酸碱度,有利于黄酮类等化合物的积累[24],刘鹏等[26]的研究结果也证明了这一点。因此,在人工种植时,适当增施氮肥和钾肥可以促进鹿蹄草体内有效成分的积累。从上述研究可以看出,普通鹿蹄草有效成分受根际和非根际土壤环境中多种因素的影响,且土壤速效钾含量、pH、转化酶活性是影响其含量的共同因子。因此,合理调节根系周围土壤酸碱度、钾素形态及转化酶活性,对普通鹿蹄草有效成分的积累意义重大。值得注意的是,本研究中各有效成分含量大小分别受根际土壤因子的共同影响。
植物在生长过程中,通过根部与土壤之间进行着各种物质和能量的交换,而根系分泌物和根残体是影响植物生长过程中养分循环的重要因素[27]。焦晓林等[28]研究表明西洋参根残体除促进植株生长外, 还影响根际生态环境中酚酸类化感物质含量的变化。植物在生长过程中,通过各种途径(如根系分泌、残体分解、地上部分淋溶等)不断与根系周围土壤之间进行着物质与能量的交换,植物残体中富含多种营养元素,腐解后能补充土壤养分,死亡的根系和大量的根际微生物等有机物质在根际聚集,对根际区域土壤酶的种类和数量以及养分的活化起着重要的作用[16,29],土壤又通过反馈调节进而改善植物条件,从而影响植物品质[30- 31]。本研究也证明了这一点,鹿蹄草几种有效成分均与根际和非根际土壤酶和养分之间存在一定的相关性,且单个土壤因子也是通过其他因子的间接影响,从而对植物有效成分进行反馈调节,而鹿蹄草根际土壤的物质交换是通过它与植物之间相互作用来影响土壤肥力和植物生产力。因此,对鹿蹄草人工引种和栽培时,应综合考虑各种肥力因子对其有效成分的综合作用,不能只片面考虑其单一的相关性。
本研究分析的普通鹿蹄草根际和非根际土壤因子和有效成分,均为多个变量,其规律性变化也呈现出不一致的现象,故通过相关分析、主成分分析、回归分析、通径分析等多途径来综合反映普通鹿蹄草根际土壤因子对品质的影响。此外,本研究只选择与普通鹿蹄草联系紧密的根际土壤因子来研究,而普通鹿蹄草广泛分布于秦岭太白山区,也有不同的亚种,其生长除了要求适宜的土壤环境以外,光照,湿度和温度等生态因子以及生物共栖生态型同样影响着药用植物的发育、产量和品质[32- 33],所以从海拔、光照、温度、植物生态型等多方面因素来研究与普通鹿蹄草品质之间的关系,有待更深入的探讨。
致谢:本研究在土壤样品分析测定过程中得到了黄土高原农业资源与环境修复重点开放实验室、农业部西北植物营养与农业环境重点实验室的支持与协助,特此致谢。
[1] Hu W G, Hu L Z. Flora of China. Beijing: Science Press, 1990,56: 158- 193.
[2] Meng L J, Geng Z C, Wang H T, Yin J Y, Jiang L, Lin W D. Soil nutrients and enzyme activities ofPyrolain rhizosphere and non-rhizosphere on Mt.Taibai, Qinling Mountains. Journal of Northwest A&F University: Natural Science Edition, 2012, 40(5): 157- 165.
[3] Hynson N A, Jolles D, Madsen P. A case of Pyrola plantlets with picky palates leads to new insights on mycoheterotrophic seedlings and the fungi that feed them. New Phytologist, 2012, 195(3): 503- 506.
[4] Ptitsyn L R, Nomura K, Sklyar I V, Ravcheeva A B.The 1,4-naphthoquinone derivative fromPyrolarotundifoliaactivates AMPK phosphorylation in C2C12 myotubes. Fitoterapia, 2011, 82(8):1285- 1289.
[5] Toftegaard T, Iason G R, Alexander I J, Rosendahl S, Taylor A F. The threatened plant intermediate wintergreen (Pyrola media) associates with a wide range of biotrophic fungi in native Scottish pine woods. Biodiversity and Conservation, 2010, 19(14): 3963- 3971.
[6] Liu Z W, Wang Z H, Zhou J, Peng H. Phylogeny ofPyroleae(Ericaceae): implications for character evolution. Journal of Plant Research, 2011, 124(3):325- 337.
[7] Chang J, Inui T. Novel phenolic glycoside dimer and trimer from the whole herb ofPyrolarotundifolia. Chemical and Pharmaceutical Bulletin, 2005, 53(8): 1051- 1053.
[8] Kim J S, Shim S H, Xu Y N, Kang S S, Son KH, Chang H W. Phenolic glycosides fromPyrolajaponica. Chemical and Pharmaceutical Bulletin, 2004, 52 (6):714- 717.
[9] Lee S M, An R B, Min B S, Na M K, Lee C H, Kang S J, Maeng H J, Bae K. A new naphthoquinone fromPyrolajaponica. Archives of Pharmacal Research, 2001, 24(6):522- 523.
[10] Liu L, Li A L, Zhao M B, Tu P F. Tetralones and Flavonoids fromPyrolacalliantha. Chemistry and Biodiversity. 2007, 4(12):2932- 2937.
[11] Guo Q S, Liang Y N, Zhang Z Y, Wang T Y, Wang T.Effects of soil factor on quality of Chrysanthemum morifolium originated from Wenxian County. China Journal of Chinese Materia Medica, 2008, 33(2): 123- 128.
[12] Yang J D, Chen F X, Yang W Y, Liu Y Q, Zhang B L. Correlation between quality of alisma orientale in Sichuan Province and rhizosphere soil physicochemical property. Chinese Traditional and Herbal Drugs, 2012, 43(3): 581- 587.
[13] Xie C X, Suo F M, Jia G L, Song J Y, Huang L F, Chen S L. Correlation between ecological factors and ginsenosides.Acta Ecologica Sinica, 2011, 31(24): 7551- 7563.
[14] Gu Y F, Liu Z, He M, Wang Y H. Correlation of the active ingredients in asarum sieboldii with physico-Chemical properties of soils. Journal of Shanghai Jiaotong University (Agricultural Science), 2010, 28(4): 361- 372.
[15] Lynch J P. Root architecture and plant productivity. Plant Physio, 1995, 109: 7- 13
[16] Lynch J M, Whipps J M. Substrate flow in the rhizosphere. Plant Soil, 1990, 129: 1- 101
[17] Xue Z Y, Zhou Z Y, Zhan Y Y, Ren W. Changing characteristics of phosphorus in the rhizosphere soil of the xeromorphic shrubs in arid deserts. Acta Ecologica Sinica, 2010, 30(2): 341- 349.
[18] Veresoglou S D, Shaw L J, Hooker J E, Sen R. Arbuscular mycorrhizal modulation of diazotrophic and denitrifying microbial communities in the (mycor) rhizosphere of Plantago lanceolata. Soil Biology and Biochemistry, 2012, 53: 78- 81.
[19] Yin H J, Xu Z F, Chen Z, Wei Y Y, Liu Q. Nitrogen transformation in the rhizospheres of two subalpine coniferous species under experimental warming.Applied Soil Ecology, 2012, 59:60- 67.
[20] Guo Z Y. Shaanxi soil. Beijing: Science Press, 1992: 15- 22.
[21] Riley D,Barber S A. Salt accumulation at the soybean root soil interface. Soil Sci Soc Am Proc, 1970,34: 154- 155.
[22] Guan S Y. Soil enzyme and its method. Beijing: Agriculture Publishing Press, 1986.
[23] Cai J B, Xu D, Liu Y,Zhang B Z. Path analysis on spatio-temporal scaling effect of crop evapotranspiration in growing seasons for winter wheat after reviving. Transactions of the Chinese Society of Agricultural Engineering, 2011, 27(8): 69- 76.
[24] Kong L, Li Y X, Quan Q M, Zhang L. Total flavonoids and icariin contents of Epimedium pubescens in different types of communities and their relationships with soil factors. Chinese Journal of Applied Ecology, 2010, 21(10): 2517- 2522.
[25] Bu J, Li D W, Wang D M. Correlations between wild Polygonatum odoratum quality and main ecological factors.Chinese Journal of Applied Ecology, 2012,23(6): 1447- 1454.
[26] Liu P, Hao C Y, Chen Z L, Zhang Z X, Wei F M, Xu S Z.Nutrient element distribution in organs of heptacodium miconioides in different communities and its relationship with soil nutrients. Acta Pedologica Sinica, 2008, 45(2): 304- 312.
[27] Meier C L, Keyserling K, Bowman W D. Fine root inputs to soil reduce growth of a neighbouring plant via distinct mechanisms dependent on root carbon chemistry. Journal of Ecology, 2009, 97(5): 941- 949.
[28] Jiao X L, Du J, Gao W W. Autotoxicity and promoting: dual effects of root litter on American ginseng growth. Acta Ecologica Sinica, 2012, 32(10): 3128- 3135.
[29] Guo L P, Huang L Q, Jiang Y X, Chen B D, Zhu Y G, Zeng Y, Fu G F, Fu M H. Bioactivity of extracts from rhizoma and rhizosphere soil of cultivated Atractylodes Lancea DC. and identification of their allelopathic compounds. Acta Ecologica Sinica, 2006, 26(2):528- 535.
[30] Manning P, Morrison SA, Bonkowski M, Bardgett R D. Nitrogen enrichment modifies plant community structure via changes to plant-soil feedback. Oecologia, 2008, 157(4): 661- 673.
[31] Wookey P A, Aerts R, Bardgett R D, Baptist F, Brathen K A, Cornelissen J H, Gough L, Hartley I P, Hopkins D W, Lavorel S, Shaver G R. Ecosystem feedbacks and cascade processes: understanding their role in the responses of Arctic and alpine ecosystems to environmental change. Global Change Biology, 2009, 15(5): 1153- 1172.
[32] Cao Y, Zhang M, Yu H Z, Li G Z, Du Y T, Xiao LT. Effects of meteorological factors and mineral elements on the content of resveratrol in Polygonum cuspidatum rootstalk. Chinese Journal of Applied Ecology, 2004, 15(7): 1143- 1147.
[33] Hou Y H, Dong S T, Hou G F, Chen C Y, Dong Z Q, Zhao M. The effect of ecological factors on the indexes of yield property equation and quantitative analysis. Agricultural Sciences in China, 2010, 9(4): 536- 548.
参考文献:
[1] 胡文光, 胡琳贞. 中国植物志. 北京: 科学出版社, 1990, 56:158- 193.
[2] 孟令军, 耿增超, 王海涛, 殷金岩, 林伟达. 秦岭太白山区鹿蹄草根际与非根际土壤养分及酶活性研究. 西北农林科技大学学报(自然科学版), 2012, 40(5): 157- 165.
[11] 郭巧生, 梁迎暖, 张重义, 王桃银, 汪 涛. 土壤因子对怀菊质量影响研究.中国中药杂志, 2008, 33(2): 123- 128.
[12] 杨俊东, 陈兴福, 杨文钰, 刘月秋, 张宝林. 川泽泻质量与其根际土壤理化性质的相关性分析. 中草药, 2012, 43(3): 581- 587.
[13] 谢彩香, 索风梅, 贾光林, 宋经元, 黄林芳, 陈士林. 人参皂苷与生态因子的相关性. 生态学报, 2011, 31(24):7551- 7563.
[14] 古一帆, 刘忠, 何明, 王永红. 华细辛中药有效成分与土壤理化性质的相关性研究. 上海交通大学学报(农业科学版), 2010, 28(4): 361- 372.
[17] 薛梓瑜, 周志宇, 詹媛媛, 任伟. 干旱荒漠区旱生灌木根际土壤磷变化特征. 生态学报, 2010, 30(2): 341- 349.
[20] 郭兆元. 陕西土壤. 北京: 科学出版社, 1992: 15- 22.
[22] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986.
[23] 蔡甲冰, 许迪, 刘钰, 张宝忠. 冬小麦返青后腾发量时空尺度效应的通径分析. 农业工程学报, 2011, 27(8): 69- 76.
[24] 孔璐, 黎云祥, 权秋梅, 张林. 不同群落类型柔毛淫羊藿总黄酮和淫羊藿苷含量及其与土壤因子的关系.应用生态学报, 2010, 21(10): 2517- 2522.
[25] 卜静, 李登武, 王冬梅. 玉竹品质与主要生态因子的相关性. 应用生态学报, 2012, 23(6): 1447- 1454.
[26] 刘鹏, 郝朝运, 陈子林, 张志祥, 韦福民, 许士珍. 不同群落类型中七子花器官营养元素分布及其与土壤养分的关系,土壤学报, 2008, 45(2): 304- 312.
[28] 焦晓林, 杜静, 高微微. 西洋参根残体对自身生长的双重作用. 生态学报, 2012, 32(10): 3128- 3135.
[29] 郭兰萍, 黄璐琦, 蒋有绪, 陈保冬, 朱永官, 曾燕, 付桂芳, 付梅红. 苍术根茎及根际土水提物生物活性研究及化感物质的鉴定. 生态学报, 2006, 26(2): 528- 535.
[32] 曹庸, 张敏, 于华忠, 李国章, 杜亚填, 萧浪涛. 气象因子和矿质元素对虎杖根茎白藜芦醇含量的影响. 应用生态学报, 2004, 15(7): 1143- 1147.
The relationship between selected rhizosphere and non-rhizosphere soil properties and the quality ofPyroladecorata
GENG Zengchao1,3,MENG Lingjun1,*,LIU Jianjun2,3
1CollegeofResourcesandEnvironment,NorthwestAgricultureandForestryUniversity,Yangling,Shaanxi712100,China2CollegeofForestry,NorthwestAgricultureandForestryUniversity,Yangling,Shaanxi712100,China3NingxiaHelanMountainForestEcosystemOrientationalResearchStation,Yinchuan,Ningxia750000,China
Pyroladecoratais a native plant species on Mt. Taibai in the Qinling Mountains. Because of its medicinal value, a large amount of wildP.decoratahas been excavated in recent years. As a result, theP.decoratapopulation on Mt. Taibai has gradually decreased. In order to protectP.decorata, it is important to study the relationship betweenP.decorataquality and selected chemical properties of rhizosphere and non-rhizosphere soil. Plant and soil samples were collected from different habitats on Mt. Taibai and taken to a laboratory for analysis. The plant samples were analyzed to determine the total flavonoid, tannin, hyperin, and quercetin content ofP.decorata. The antioxidant activity (DPPHIC50) of the samples was also determined. Correlation analysis, principal component analysis, regression analysis, and path analysis were conducted to determine the relationship between medicinally active compounds in wildP.decorataand selected properties of rhizosphere and non-rhizosphere soil. The results indicated that in rhizosphere soil, available potassium concentration, pH, and urease were positively correlated with individual compounds inP.decorata. In contrast, for non-rhizosphere soil, available potassium was significantly correlated with five active compounds. In rhizosphere soil, available potassium, pH, invertase, and urease were the main factors influencing the active compound content ofP.decorata, whereas in non-rhizosphere soil available nitrogen, available potassium, pH, and invertase were the main factors. In rhizosphere soil, available potassium was the most important factor influencing the active compound content, whereas soil pH, catalase, and acid phosphatase were the main limiting factors. In non-rhizosphere soil, available nitrogen and available potassium were the most important factors influencing the active compound content, whereas soil pH and invertase were the main limiting factors. In conclusion, the content of active compounds in ofP.decoratais affected by multiple soil factors, especially soil available potassium, soil pH, and invertase.
Pyroladecorata; quality; rhizosphere; effective component; soil factor
国家林业公益性行业科研专项资助项目(200904004)
2012- 10- 08;
2013- 03- 04
10.5846/stxb201210081387
*通讯作者Corresponding author.E-mail: mlg486@126.com
耿增超,孟令军,刘建军.普通鹿蹄草品质与根际和非根际土壤的关系.生态学报,2014,34(4):973- 982.
Geng Z CMeng L J,Liu J J.The relationship between selected rhizosphere and non-rhizosphere soil properties and the quality ofPyroladecorata.Acta Ecologica Sinica,2014,34(4):973- 982.
