三峡库区岸坡消落带草地、弃耕地和耕地土壤微生物及酶活性特征
2014-08-08李昌晓杨予静
马 朋, 李昌晓, 雷 明, 杨予静, 马 骏
(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆 400715)
三峡库区岸坡消落带草地、弃耕地和耕地土壤微生物及酶活性特征
马 朋, 李昌晓*, 雷 明, 杨予静, 马 骏
(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆 400715)
为研究不同用地方式对三峡库区消落带土壤性质的影响,选取三峡库区重庆忠县汝溪河流域典型消落带为研究区域,研究不同用地类型(草地、弃耕地、耕地)、不同土层间(0—10 cm、10—20 cm)土壤微生物、土壤酶活性和土壤化学性质的各自特征及其相互关系,旨在为该地区消落带生态恢复实践提供理论依据。研究发现:除蛋白酶活性、全磷含量、碱解氮含量外,不同用地类型对土壤各生化特性均产生了显著影响;与之不同,土层仅对细菌数量、放线菌数量、真菌数量、蔗糖酶活性、脲酶活性以及土壤有机质含量产生显著影响,但对其他生化性质影响不显著;用地类型与土层两者的交互作用仅对蔗糖酶活性影响显著。同时,弃耕地土壤的细菌数量在3种用地类型中最高;真菌、放线菌数量在草地中最高,耕地次之,弃耕地最低。弃耕地中的过氧化氢酶、蔗糖酶、蛋白酶和脲酶活性与其他两种用地类型相比较高,而耕地中磷酸酶活性则显著高于弃耕地和草地土壤。草地土壤全氮、有效磷以及速效钾含量均显著低于耕地,而草地0—20 cm土层的有机质含量却显著高于弃耕地和耕地;3种用地类型的全磷、全钾、碱解氮含量差异均不显著,弃耕地的pH值显著高于另外两种用地类型。另一方面,三峡库区消落带土壤的各生化指标间存在一定的相关性。pH值和微生物数量及酶活性间的关系最为密切,土壤真菌和放线菌数量与土壤有机质含量呈极显著正相关。研究结果表明,与弃耕地和耕地相比,草地在稳定消落带土壤环境、固持土壤营养元素、提高土壤肥力方面作用更为显著;相对而言,耕地的土壤微生态环境较差,故在消落带实施退耕还草、恢复草本植被等具有重要意义。
三峡库区;土壤微生物;土壤酶;消落带;农事活动
三峡水库完成蓄水后,形成了总面积约440 km2的水陆交错地带,库区水位每年在145 m与175 m之间变化[1- 2],该消落带土壤在库区水土流失防治、养分循环和对非点源污染的缓冲与过滤等方面具有重要意义[3]。然而,伴随着当地突出的人地矛盾[4],居住于消落带上部的村民仍采用传统的农耕方式进行耕作活动,而农耕活动却将频繁而强烈影响消落带的土壤环境[5- 7]。
土壤酶是土壤环境的重要组成部分,主要来源于植物根系分泌物和土壤微生物的增殖及其死亡残体的胞溶[8],其活性变化规律研究引起众多学者的重视[9- 13]。土壤微生物是土壤中最活跃的组分之一,通过参与土壤形成[14]、有机质分解、腐殖质形成、土壤养分转化和循环等影响调节土壤环境与质量[15- 18]。通过对不同土壤微生物种群和群落进行调查,可为评估土壤的退化程度以及生态重建提供量化指标[19]。作为土壤中分布广泛的三大菌群,细菌、放线菌、真菌在土壤有机物和无机物转化、分解动植物组分从而形成土壤腐殖质、分解转化氮素等无机营养等方面发挥重要作用[20],因而其数量分布特征通常可作为表征土壤生物活性高低的重要标志之一。
由于不同土地利用方式和土壤水分含量影响土壤的土壤质量和理化性质[21- 24],因此,在三峡库区消落带特殊的水文条件、人地矛盾突出、用地方式多样的背景下,对土壤性质的研究将有助于了解当地消落带的土壤环境,指导消落带的生态恢复实践活动。尽管对于消落带土壤性质的研究不断深入,但是目前有关三峡库区消落带土壤微生物与土壤酶活性受不同土地利用方式影响的研究还少见报道。为进一步阐明农事活动对消落带土壤环境的影响,对土壤微生物、酶活性和化学性质的系统综合研究显得至关重要。因此,本研究以三峡库区典型消落带(重庆忠县汝溪河流域)为研究区域,选取3种不同用地类型,通过分析土壤微生物数量、土壤酶活性、以及土壤元素含量对三峡库区消落带不同用地类型环境的反馈机制,了解弃耕时间长短及农事活动对土壤性质的影响,以期为三峡库区消落带土地的合理利用提供科学理论依据。
1 材料与方法
1.1 研究区域概况
本研究区域位于三峡库区重庆忠县境内的汝溪河流域消落带(108°0′803″—108°08′21″E, 30°24′16″—30°24′56″N),平均坡度为35°;年积温5891.4 ℃,年均温18.2 ℃,无霜期341 d,日照时数1327.5 h,日照率29%,年降雨量1172.1 mm,相对湿度80%,降雨多集中在6—8月,降雨量占全年的40%。地带性森林植被为亚热带常绿阔叶林,原生植被破坏殆尽,消落带现有植被以少量灌丛和草被为主;土壤主要为中性紫色土,质地为中壤或轻壤,土层厚度变异很大[16],水土流失、崩塌现象较严重[17]。
1.2 样地设置
在具有相同坡度的消落带区域内,选定具有典型代表性的样地开展试验研究。2011年8月,通过实地踏查,发现该区域内主要用地类型包括草地、弃耕地与耕地。其中,草地、弃耕地由三峡工程动工前的一部分耕地停耕后转变而来,而其余耕地则一直保留至今。
本研究中,所选样地所受光照辐射强度大致相同,土壤预热条件基本一致。根据试验地实际情况、植被类型和受干扰情况,设置3种用地类型共30个样地,包括11个草地、16个弃耕地以及3个耕地。草地优势种为狗牙根(Cynodondactylon),夹杂少量香附子(Cyperusrotundus),总盖度约为90%,三峡水库消落带形成前,主要为水土流失严重的耕地,弃耕时间约为5—6 a;弃耕地的弃耕时间约为2—3 a,主要植被为香附子,间杂少量苍耳(Xanthiumsibiricum)、狗尾草(Setariafaberii),总盖度约为55%;采样时,耕地样地内所种玉米(ZeamaysL.)已收获,只留下玉米秸秆,受人为松土、施肥、收获等管理活动影响严重。
1.3 样品采集
在采样区域内,每个样地随机设3条S型样带,每条样带设5个取样点。每个采样点分0—10 cm及10—20 cm土层采样,并将每条样带的相同土层样品按四分法混合后,用聚乙烯自封袋带回实验室,风干后以供土壤养分及酶活性分析。同时,取0.5 kg新鲜土样于已消毒的聚乙烯自封袋中,冷藏运输,用于土壤微生物的测定,各微生物指标在样品取回14 d内完成测定。
1.4 土壤指标测定方法

1.5 数据处理
根据测定土壤指标,采用双因素方差分析(Two-way ANOVA)分析不同用地类型、不同土层以及两者的交互作用对土壤微生物数量、酶活性和化学性质的影响。采用单因素方差分析(One-way ANOVA)分析不同用地类型对同一土层土壤性质的影响,并用Duncan检验法检验每个指标在不同用地类型间的差异性(α=0.05)。采用独立样本T检验分析同一用地类型下,不同土层各生化指标的差异显著性。并采用Pearson相关系数评价土壤各生化特性之间的相关关系。本研究采用SPSS 20.0软件进行数据分析,用Origin 8.6 软件制图。
2 结果与分析
2.1 不同用地类型、不同土层对土壤生化性质的影响
除蛋白酶活性、土壤全磷含量、碱解氮含量外,不同用地类型对土壤生化特性均产生显著影响;与之不同,土层仅对细菌、放线菌、真菌数量、蔗糖酶活性、脲酶活性及有机质含量产生显著影响,然而对其它土壤生化特性影响不显著;而用地类型和土层深度的交互作用仅对土壤蔗糖酶活性产生显著的影响(表1)。

表1 用地类型及土层对土壤生化特性影响的双因素方差分析
***P< 0.001;**P< 0.01;*P< 0.05;nsP> 0.05
2.2 不同用地类型对土壤微生物数量的影响
在细菌、放线菌、真菌三大土壤菌群中,数量最多的细菌在弃耕地中显著高于相同土层的草地和耕地土壤细菌数量,而在草地和耕地中却无显著差异(图1)。除表层土(0—10 cm)的草地与耕地间的真菌数量无显著差异外,草地中真菌和放线菌数量均分别显著高于弃耕地和耕地(图1)。不同土层之间,与耕地的3种土壤微生物数量、草地的细菌数量均无显著差异,草地0—10 cm土层的放线菌数量、弃耕地中细菌、放线菌数量均较10—20 cm土层有显著差异(P<0.05),草地和弃耕地表层土的真菌数量均极显著高于次表层土壤(P<0.01)(图1)。
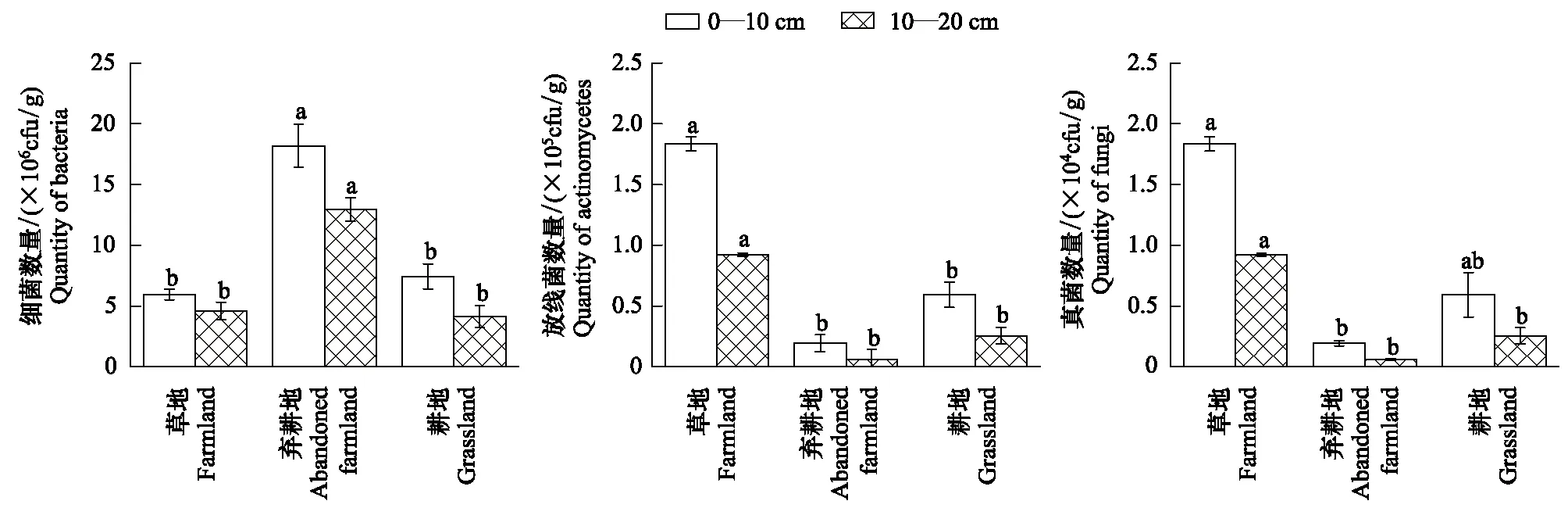
图1 不同用地类型对土壤细菌、放线菌、真菌数量的影响(平均值±标准差)*Fig.1 Effects of different land use patterns on the quantity of soil bacteria, actinomycetes, and fungi (Mean±SD)不同字母表示不同用地类型、相同土层的土壤性质间差异显著(P < 0.05)
2.3 不同用地类型对土壤酶活性的影响
3种用地类型中,弃耕地表层土壤的过氧化氢酶、蔗糖酶、脲酶活性、蛋白酶活性均分别显著高于草地和弃耕地,而草地与弃耕地间并无显著差异;与之不同,耕地中的磷酸酶活性却显著高于其他两种用地类型的磷酸酶活性(表2);在次表层土壤,3种用地类型蔗糖酶、蛋白酶活性无显著差异,弃耕地中过氧化氢酶、脲酶活性显著高于草地,而耕地与草地却无显著性差异。在不同土层间,除了表层草地中过氧化氢酶活性以及弃耕地过氧化氢酶、蔗糖酶活性显著高于次表层 (P<0.05)外,其余酶活性在上下两层土中差异并未达到显著水平(P>0.05)。
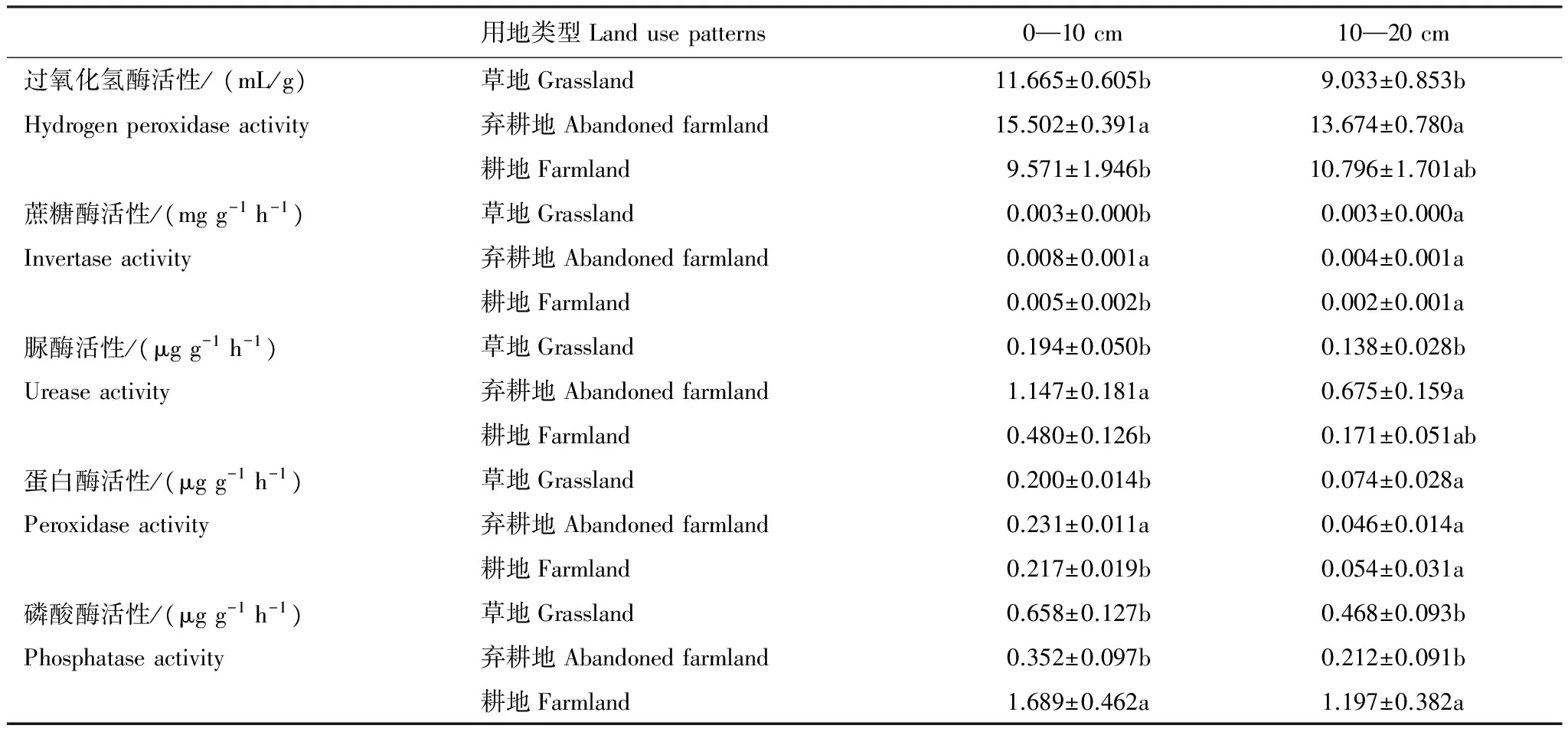
表2 不同用地类型中的土壤酶活性(平均值±标准差)*
不同字母表示不同用地类型、相同土层的土壤酶活性差异显著(P< 0.05)
2.4 不同用地类型对土壤化学性质的影响
在不同用地类型和不同土层中,土壤氮、磷、钾、有机质含量和pH值均呈现规律性分布(图2)。在相同土层,草地的土壤全氮(TN)、有效磷(AP)及速效钾(AK)含量均显著低于耕地,而其10—20 cm土层有机质(OM)含量却显著高于弃耕地和耕地;3种用地类型对土壤全磷(TP)、全钾(TK)、碱解氮(AN)含量均不产生显著影响,弃耕地的pH值显著高于另外两种用地类型。在不同土层间,除耕地的次表层土壤有效磷含量显著低于表层土壤外(P< 0.05),其它土壤营养元素含量间差异不显著(图2)。
2.5 土壤生化特性间的相关性分析
三峡库区汝溪河流域消落带不同用地类型的土壤生化特性相关性分析(表3)表明土壤细菌数量与过氧化氢酶、蔗糖酶、脲酶活性、pH值、AK、TN含量呈极显著正相关,而与真菌、放线菌数量以及磷酸酶活性呈显著或极显著负相关;放线菌数量与pH值、AK、TN含量极显著负相关,而与OM含量、真菌数量呈极显著正相关;真菌数量与OM含量之间呈现极显著的正相关关系,而与过氧化氢酶、脲酶活性、TN、AK含量、pH值却呈现极显著负相关。同时,过氧化氢酶活性与蔗糖酶、脲酶、蛋白酶、磷酸酶活性、TN、AK含量、pH值呈显著或极显著相关;蔗糖酶活性与脲酶活性、TN、AK含量、pH值呈极显著正相关;脲酶活性与TN、AK含量、pH值呈极显著相关。另一方面,三峡库区汝溪河流域消落带土壤化学性质间,TN含量极显著正相关于AK含量、pH值之间具有;AN、AP、OM含量显著或极显著负相关于土壤pH值;而AN与OM含量、AK含量与pH值间分别呈现显著、极显著的正相关关系。
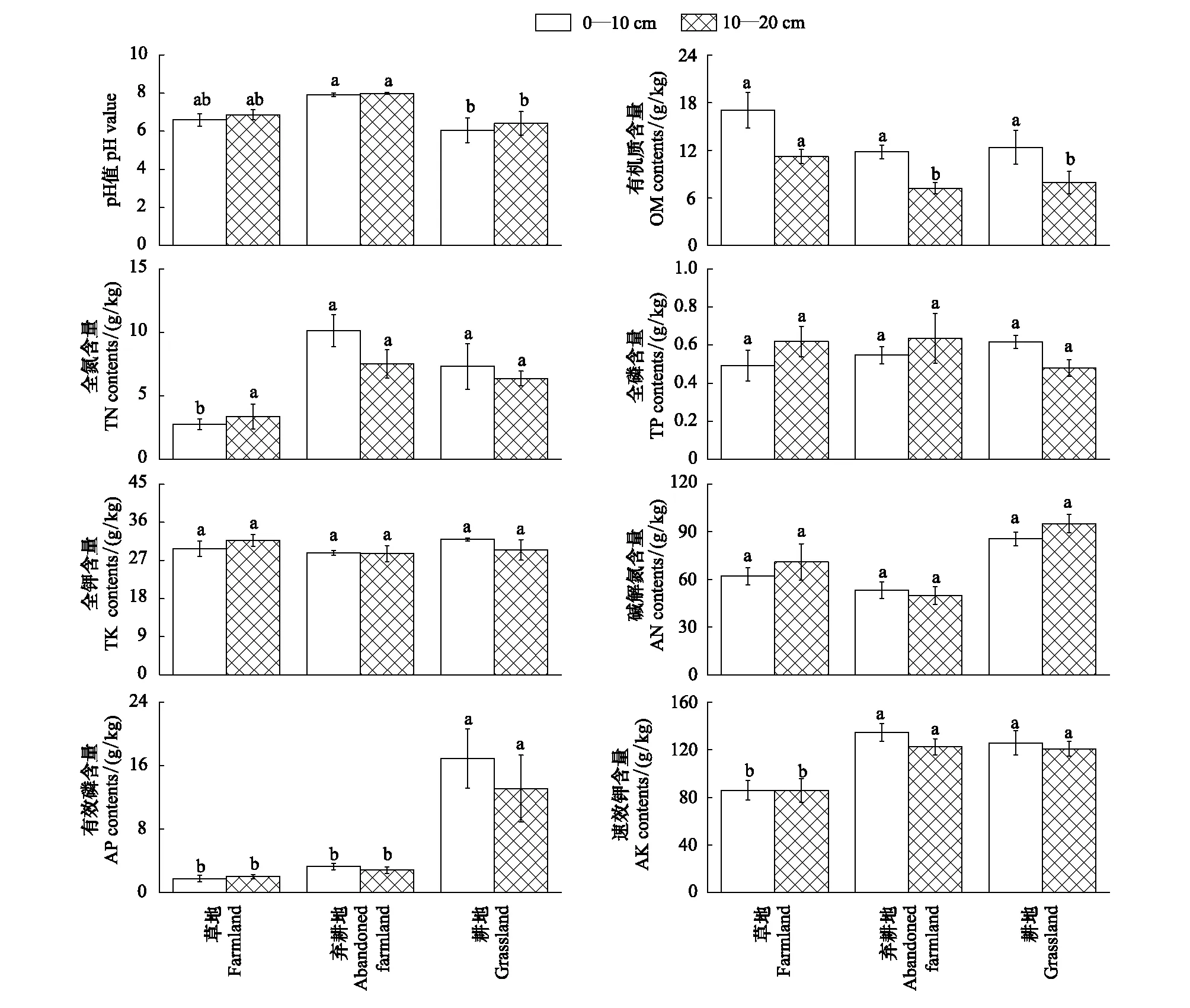
图2 不同用地类型对土壤pH值、有机质、全氮、全磷、全钾、碱解氮、有效磷、速效钾含量的影响(平均值±标准差)Fig.2 Effects of different land use patterns on pH value, OM, TN, TP, TK, AN, AP, AK contents (Mean±SD)
3 讨论
3.1 不同用地类型对土壤生化特性的影响
土壤微生物参与完成土壤中的各种复杂生化反应过程[29- 30],其微生物群落受土壤质地、酸碱度、有机质含量、植物根系分泌物、根系脱落物等多种因素的影响[31- 32]。研究发现,三大土壤微生物(细菌、真菌、放线菌)数量在不同用地类型和不同土层之间呈现出数量差异。可能由于表层土壤有机质的含量高于次表层(图2),易于微生物生存,其三大微生物均呈现表层多于下层的规律。细菌在三大菌群中数量最多,这主要是由不同种类微生物的生物学特性决定的,细菌不仅呼吸机制复杂,营养类型多,而且适应能力强,代谢旺盛,繁殖快速,往往成为土壤中的优势群[33]。较草地和耕地而言,弃耕地细菌数量最高(图1),这极有可能与土壤pH值有关。弃耕地中pH值处于中性,更适于细菌生长[34]。经过淹水,土壤将趋近于中性[6- 7];本研究中,弃耕地由于缺乏植被覆盖,其pH值更易与江水同步;草地由于大量植被覆盖,具有一定的自我调节能力;而耕地受施肥、翻耕等人为因素影响,pH值趋于酸性。同时,草地在3种用地类型中的真菌和放线菌数量最高,耕地次之,弃耕地最低(图1),可能是由于弃耕地土壤中动植物残体和植物枯落物较少,从而导致依赖于分解土壤中动植物残体和植物枯落物中某些难分解的组分的真菌和放线菌[35- 38]数量较低。
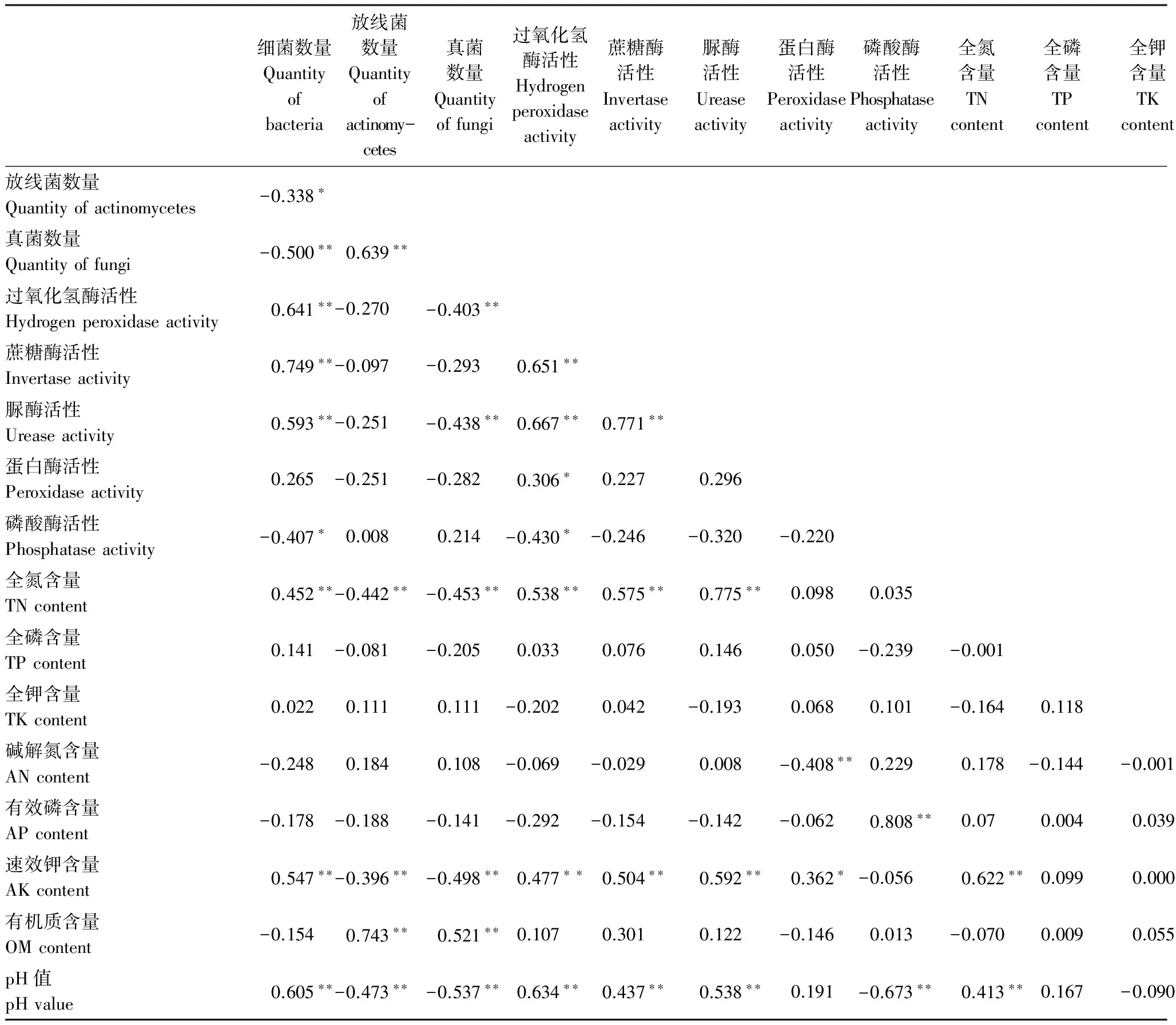
表3 土壤生化特性间的相关性分析
*, ** 分别表示在0.05与0.01水平上差异显著
除土壤微生物直接参与土壤中各种生化反应外,土壤酶还参与土壤中各种代谢过程和能量转化,这些来源于植物根系及其残体、土壤动物及其残骸以及土壤微生物分泌的土壤酶系,可以表征土壤生物活性的高低,对土壤质量有重要影响[39- 41]。过氧化氢酶是合成土壤腐殖质和防止过氧化氢对生物毒害的重要氧化还原酶系[42];土壤蔗糖酶是土壤中广泛存在的酶,能促进蔗糖分解,是土壤中碳循环的关键酶[43];前人发现,脲酶活性与全氮质量分数具有明显的正相关关系[44- 45]。研究发现,弃耕地中过氧化氢酶、蔗糖酶、脲酶活性均较高(表2)。弃耕地土壤全氮等营养元素含量丰富,在弃耕以后,形成了比较稳定的土壤结构,通气状况良好,能够维持较高的土壤酶活性。土壤磷酸酶是一类催化土壤有机磷化合物矿化的酶,其活性高低直接影响着土壤中有机磷的分解转化及其生物有效性[43]。耕地中磷酸酶活性最高,在磷酸酶作用下,转化生成的有效磷含量也最高(表2),但是由于耕地中人为翻耕、施肥,产生大量的速效营养物质。对于磷酸酶活性较高的草地土壤,有效磷含量却相对较低,可能是由于草地中大量的植被可将有效磷固定、转移至植物体而造成的。
3种不同用地类型对土壤的化学性质也产生较大影响。其中,可能受于人为干扰(如施肥等)的影响,耕地和弃耕地中TN含量显著高于草地;而由于地表植被的大量吸收,草地中土壤有效养分含量与耕地差异不显著,这对减少进入水体的营养物质的量、降低水体富营养化等起到关键作用。另外,弃耕地和耕地中OM含量也较低,可能是由于在人工翻耕后,土壤有机质更易于分解,促进了土壤的有机碳循环;与之不同,草地土壤有机质较稳定,土壤有机碳循环过程受到抑制,使其有机质含量较高。
3.2 土壤生化特性的相关性
作为土壤环境的重要组分,土壤微生物与土壤酶之间存在着不可分割的关系[46]。细菌在土壤微生物中数量最多,繁殖最快,在新陈代谢中产生大量过氧化氢酶、蔗糖酶、脲酶、蛋白酶等;这些酶强烈作用于底物,而这些底物正是真菌和放线菌所需的物质来源[47],导致真菌和放线菌数量与过氧化氢酶、蔗糖酶、脲酶和蛋白酶的活性呈负相关,这种负相关关系在真菌数量与过氧化氢酶、脲酶活性之间以及放线菌数量和过氧化氢酶活性之间表现尤为突出(表3)。蔗糖酶、蛋白酶、磷酸酶的活性与真菌、放线菌数量相关性不显著,可能是由于蔗糖酶主要来源于植物根系、土壤动物和数量更多的细菌,而真菌和放线菌分泌的酶量未达到显著水平的原因;氮素土壤微生物中与磷酸酶最为相关的是磷细菌,有研究发现土壤中解磷细菌的数量受土壤物理组成、腐殖酸质量分数、氮磷质量分数等因素的影响,尤其是土壤类型和耕作方式对其数量的影响最大[48- 49],而在本研究区域,可能由于在消落带特殊的土壤环境中,土壤受水淹和人为影响较大,磷细菌通过磷酸酶的解磷作用越强,土壤流失掉的磷素就会越多,刺激其产生强烈的反馈机制,抵消了这种作用,从而导致细菌与磷酸酶呈显著负相关。
土壤酶活性和微生物数量与土壤化学性质间也存在一定的相关性,其中,pH值和各生物指标间的关系最为密切(表3)。除磷酸酶外,其余四种土壤酶均与土壤pH值呈显著或极显著正相关。通过改变土壤酶中用于结合和催化的氨基酸功能基团的空间结构,土壤pH值干扰了土壤酶对土壤酸碱环境的敏感性,从而影响酶活性;另外,土壤pH值还可通过改变土壤溶液中的抑制剂或催化剂的浓度、底物的有效浓度影响土壤酶的活性[50]。同时,磷酸酶与速效磷含量呈极显著正相关,这是因为土壤有机磷化合物在酶促水解的作用下,磷酸根解脱转化为植物可以利用的形态,导致磷酸酶活性越高,土壤速效磷含量越低。在三大微生物中,只有细菌数量与pH值呈极显著正相关,而真菌与放线菌数量均与pH值呈极显著负相关关系,这是因为pH值影响土壤氧化还原电位,从而影响土壤微生物的活动。另外,真菌数量和放线菌数量与有机质含量呈极显著正相关,而细菌数量与有机质含量之间并未有相关性关系存在,说明该地区决定土壤有机质含量的主要菌群是真菌和放线菌。
4 结论
消落带内强烈的水文效应和人为活动影响着土壤微生物和土壤酶活性的状况。弃耕地中细菌数量在3种用地类型中最高;草地中的真菌、放线菌数量最高,耕地次之,弃耕地最低。弃耕地中的过氧化氢酶、蔗糖酶、蛋白酶和脲酶活性较其它两种用地类型高,而耕地中磷酸酶活性则显著高于弃耕地和草地。在土壤营养元素含量方面,草地中TN、AP以及AK含量显著低于耕地,而草地中OM含量却显著高于弃耕地和耕地。同时,三峡库区消落带土壤的各生化指标间存在一定的相关性。其中,pH值和微生物数量及酶活性间的关系最为密切,土壤真菌和细菌数量与有机质含量呈极显著正相关。因此,与弃耕地和耕地相比,草地在稳定消落带土壤环境、固持土壤营养元素、提高土壤肥力等方面具有重要作用;相对而言,耕地的土壤微生态环境较差,故在消落带实施退耕还草、恢复草本植被等具有重要意义。
[1] Niu Z M, Xie M S. Thoughts on development and utilization of water and soil resources in the reservoir changing region in the Three Gorges Reservoir Area. Science and Technology Review, 1998, (4): 61- 62.
[2] Xiao W F, Li J W, Yu C Q, Ma J, Cheng R M, Liu S Y, Wang J X, Ge J W. Terrestrial Animal and plant Ecology of the Three Gorges of Yangtze River. Chongqing: Southwest China Normal University Press, 2000: 3- 26.
[3] Feng X J, Wei C F, Xie D T, Yu W M, Fan X H. Environmental effects of interaction of water and soil of the Water-Level-Fluctuating Zone in the Three Gorges Reservoir. Chinese Agricultural Science Bulletin, 2005, 21(10): 356- 377.
[4] Wei J, He X B. Review of soil conservation practices on sloping farmlands in Three-Gorge Reservoir Area. World Science and Technology Research and Development, 2011, 33(1): 41- 45.
[5] Cheng R M, Wang X R, Xiao W F, Guo Q S. Advances in studies on Water-Level-Fluctuation Zone. Scientia Silvae Sinicae, 2010, 46(4): 111- 119.
[6] Kang Y, Guo Q S, Cheng R M, Hong M, Jin J Q, Wang X F. Changes of the soil physical properties in Hydro-Fluctuation Belt of the Three Gorges Reservoir. Scientia Silvae Sinicae, 2010, 46(6): 1- 5.
[7] Liu L Q, Wei S Q, Jiang T. Distribution of soil heavy metals from water-level-fluctuating zone in Three-Gorge Reservoir Area and their evaluation of potential ecological risk. China Environmental Science, 2011, 31(7): 1204- 1211.
[8] Zhang L L, Zhang Y L, Chen L J, Wu Z J. Response of soil saccharidase activities to free-air carbon dioxide enrichment (FACE) under rice-wheat rotation. Chinese Journal of Applied Ecology, 2004, 15(6): 1019- 1024.
[9] Zhou L K, Zheng Z M, Chen E F. Enzymatic activities in black soils. Acta Pedologica Sinica, 1981, 18(2): 158- 165.
[10] Tan S D, Zhu M Y, Zhang K R, Zhang Q F, Jiang L H. Effect of submergence on rhizospheric soil enzyme activity and fertility of bermudagrass (Cynodondactylon). Chinese Journal of Eco-Agriculture, 2011, 19(1): 8- 12.
[11] Max M C, Wood M, Jarvis S C. A microplate fluorimetric assay for the study of enzyme diversity in soils. Soil Biology and Biochemistry, 2001, 33(12/13): 1633- 1640.
[12] Sinsabaugh E L, Carreiro M M, Repert D A. Allocation of extracellular enzymatic activity in relation to litter composition, N deposition, and mass loss. Biogeochemistry, 2002, 60(1): 1- 24.
[13] Yao X H, Min H, Lü Z H, Yuan H P. Influence of acetamiprid on soil enzymatic activities and respiration. European Journal of Soil Biology, 2006, 42(2): 120- 126.
[14] Xiao G S, Hu Y Z, Tang H L, Yang J N, Li Y J, Zheng K J, Wang Q L. Ecological Distribution of Soil Microorganism and the Identification of the Dominant Microbes Before and After the Impoundment of the Three Gorges Reservoir. Jiangsu Agricultural Sciences, 2011, 39(4): 493- 496.
[15] Zhou L X, Ding M M. Soil microbial characteristics as bioindicators of soil health. Biodiversity Science, 2007, 15(2): 162- 171.
[16] Nichols T D, Wolf D C, Rogers H B, Beyrouty C A, Reynolds C M. Rhizosphere microbial populations in contaminated soils. Water, Air and Soil Pollution, 1997, 95(1/4): 165- 178.
[17] Miya R K, Firestone M K. Phenanthrene-degrader community dynamics in rhizosphere soil from a common annual grass. Journal of Environmental Quality, 2000, 29(2): 584- 592.
[18] Reilley K A, Banks M K, Schwab A P. Dissipation of polycyclic aromatic hydrocarbons in the rhizosphere. Journal of Environmental Quality, 1996, 25(2): 212- 219.
[19] Rillig M C, Mummey D L. Mycorrhizas and soil structure. New Phytologist, 2006, 171(1): 41- 53.
[20] Jiao R Z, Yang C D. The changes of the soil microorganism in rhizosphere and outside in different developing stages of the Chinese fir plantation. Scientia Silvae Sinicae, 1999, 35(1): 53- 59.
[21] Chen F, Pu L J, Peng B Z, Bao H S. The effect of land use changes on soil conditions in Korla City, Xinjiang. Acta Ecologica Sinica, 2001, 21(8): 1290- 1295.
[22] Guo X D, Fu B J, Chen L D, Ma K M, Li J R. Effects of land use on soil quality in a hilly area---a case study in Zunhua County of Hebei Province. Acta Geographica Sinica, 2001, 56(4): 447- 455.
[23] Adejuwon J O, Ekanade O. A comparison of soil properties under different landuse types in a part of the Nigerian cocoa belt. Catena, 1988, 15(3/4): 319- 331.
[24] Hajabbasi M A, Jalalian A, Karimzadeh H R. Deforestation effects on soil physical and chemical properties, Lordegan, Iran. Plant and Soil, 1997, 190(2): 301- 308.
[25] Institute of Soil Science, Chinese Academy of Sciences. Research Method of Soil Microbe. Beijing: Science Press, 1985: 40- 67, 153- 167.
[26] Zhao B, He S J. Microbiology Experiments. Beijing: Science Press, 2002: 230- 255.
[27] Lin X G. Principles and Methods of Soil Microbiology Research. Beijing: Higher Education Press, 2010: 243- 265.
[28] Bao S D. Soil Agricultural Chemistry Analysis. Beijing: China Agriculture Press, 2000: 44- 196.
[29] Li Y M, Hu J C, Wang S L, Wang S J. Function and application of soil microorganisms in forest ecosystem. Chinese Journal of Applied Ecology, 2004, 15(10): 1943- 1946.
[30] Zhang P. Ecological distribution and biochemical properties of soil microorganisms in secondary forestsin Xishuangbanna. Chinese Journal of Ecology, 1995, 14(1): 21- 26.
[31] Humphries J A, Ashe A M H, Smiley J A, Johnston C G. Microbial community structure and trichloroethylene degradation in ground water. Canadian Journal of Microbiology, 2005, 51(6): 433- 440.
[32] Sall S N, Masse D, Ndour N Y B, Chotte J L. Does cropping modify the decomposition function and the diversity of the soil microbial community of tropical fallow soil? Applied Soil Ecology, 2006, 31(3): 211- 219.
[33] Yao H Y, Huang C Y. Soil Microbial Ecology and Its Experimental Technology. Beijing: Science Press, 2006.
[34] Xue L, Kuang L G, Chen H Y, Tan S M. Soil nutrients microorganisms and enzyme activities of different stands. Acta Pedologica Sinica, 2003, 40(2): 280- 285.
[35] Li C H, Wang X X, Wang Q, Hao S P. Effect of different textural soils on rhizosphere microorganisms and enzyme activities in maize. Scientia Agricultura Sinica, 2007, 40(2): 412- 418.
[36] Wang M S, Jiang C Y, Pan W J, Xue X P, Chen Y, Liang Y J. Studying on physical chemical properties and microbiological community in tobacco-growing soils under different continuous cropping years. Journal of Anhui Agricultural Sciences, 2008, 36(12): 5033- 5034, 5052- 5052.
[37] Bai Q Y. Methods of the chemical evaluation of soil microbial community structure. Agro-Environmental Protection, 1997, 16(6): 252- 256.
[38] Shiomi Y, Nishiyama M, Onizuka T, Marumoto T. Comparison of bacterial community structures in the rhizoplane of tomato plants grown in soils suppressive and conducive towards bacterial wilt. Applied and Environmental Microbiology, 1999, 65(9): 3996- 4001.
[39] Hu Y L, Wang S L, Huang Y, Yu X J. Effects of litter chemistry on soil biological property and enzymatic activity. Acta Ecologica Sinica, 2005, 25(10): 2662- 2668.
[40] Zheng W J, Wang L M, Lin P. Soil enzymatic activity in the subtropical rain forest in Hexi, Fujian. Chinese Journal of Ecology, 1995, 14(6): l6- 20.
[41] Aon M A, Colaneri A C. Temporal and spatial evolution of enzymatic activities and physico-chemical properties in an agricultural soil. Applied Soil Ecology, 2001, 18(3): 255- 270.
[42] Yang T, Xu H, Fang D H, Zhu J J. Soil nutrient, microorganism and enzyme activity inPinussylvestrisvar. mongolica forests. Chinese Journal of Soil Science, 2006, 37(2): 253- 257.
[43] He W X, Zhu M E. Relationship between urease activity and fertility of soils in Shanxi Province. Acta Pedologica Sinica, 1997, 34(4): 392- 398.
[44] Liu G S, Xu D M, Xu Z J, Wang H Y, Liu W P. Relationship between hydrolase activity in soils and soil properties in Zhejiang Province. Acta Pedologica Sinica, 2003, 40(5): 756- 762.
[45] Qin S P, Hu C S, He X H, Dong W X, Cui J F, Wang Y. Soil organic carbon, nutrients and relevant enzyme activities in particle-size fractions under conservational versus traditional agricultural management. Applied Soil Ecology, 2010, 45(3): 152- 159.
[46] Wang Q L, Cao G M, Wang C T. Quantitative characters of soil microbes and microbial biomass under different vegetations in alpine meadow. Chinese Journal of Ecology, 2007, 26(7): 1002- 1008.
[47] Trasar-Cepeda C, Leirós M C, Seoane S, Gil-Sotres F. Limitations of soil enzymes as indicators of soil pollution. Soil Biology and Biochemistry, 2000, 32(13): 1867- l875.
[48] Lin Q M, Zhao X R, Sun Y X, Yao J. Community characters of soil phosphobacteria in four ecosystems. Soil and Environmental Sciences, 2000, 9(1): 34- 37.
[49] Kobus J. The role of microorganisms in the transformation of phosphoric compounds in the soil. Acta Microbiology of Polish, 1962, 11: 255- 262.
[50] Dick W A, Cheng L, Wang P. Soil acid and alkaline phosphatase activity as pH adjustment indicators. Soil Biology and Biochemistry, 2000, 32(13): 1915- 1919.
参考文献:
[1] 牛志明, 解明曙. 三峡库区水库消落区水土资源开发利用的前期思考. 科技导报, 1998, (4): 61- 62.
[2] 肖文发, 李建文, 于长青, 马娟, 程瑞梅, 刘少英, 王金锡, 葛继稳. 长江三峡库区陆生动植物生态. 重庆: 西南师范大学出版社, 2000: 3- 26.
[3] 冯孝杰, 魏朝富, 谢德体, 余炜敏, 范小华. 周期性淹水对消落区水土环境的影响及控制对策. 农业资源与环境科学, 2005, 21(10): 356- 377.
[4] 韦杰, 贺秀斌. 三峡库区坡耕地水土保持措施研究进展. 世界科技研究与发展, 2011, 33(1): 41- 45.
[5] 程瑞梅, 王晓荣, 肖文发, 郭泉水. 消落带研究进展. 林业科学, 2010, 46(4): 111- 119.
[6] 康义, 郭泉水, 程瑞梅, 洪明, 金江群, 王祥福. 三峡库区消落带土壤物理性质变化. 林业科学, 2010, 46(6): 1- 5.
[7] 刘丽琼, 魏世强, 江韬. 三峡库区消落带土壤重金属分布特征及潜在风险评价. 中国环境科学, 2011, 31(7): 1204- 1211.
[8] 张丽莉, 张玉兰, 陈利军, 武志杰. 稻—麦轮作系统土壤糖酶活性对开放式CO2的浓度增高的响应. 应用生态学报, 2004, 15(6): 1019- 1024.
[9] 周礼恺, 郑志明, 陈恩凤. 黑土的酶活性. 土壤学报, 1981, 18(2): 158- 165.
[10] 谭淑端, 朱明勇, 张克荣, 张全发, 姜利红. 深淹对狗牙根根际土壤酶活性及肥力的影响. 中国生态农业学报, 2011, 19(1): 8- 12.
[14] 肖国生, 胡廷章, 唐华丽, 杨俊年, 李彦杰, 郑克均, 王启龙. 三峡水库消落带淹没前后土壤微生物生态分布及优势菌群的鉴定. 江苏农业科学, 2011, 39(4): 493- 496.
[15] 周丽霞, 丁明懋. 土壤微生物学特性对土壤健康的指示作用. 生物多样性, 2007, 15(2): 162- 171.
[20] 焦如珍, 杨承栋. 杉木人工林不同发育阶段根际与非根际土壤微生物变化趋势. 林业科学, 1999, 35(1): 53- 59.
[21] 陈浮, 濮励杰, 彭补拙, 包浩生. 新疆库尔勒市土地利用变化对土壤性状的影响研究. 生态学报, 2001, 21(8): 1290- 1295.
[22] 郭旭东, 傅伯杰, 陈利顶, 马克明, 李俊然. 低山丘陵区土地利用方式对土壤质量的影响. 地理学报, 2001, 56(4): 447- 455.
[25] 中国科学院南京土壤研究所微生物室. 土壤微生物研究法. 北京: 科学出版社, 1985: 40- 67, 153- 167.
[26] 赵斌, 何绍江. 微生物学实验. 北京: 科学出版社, 2002: 230- 255.
[27] 林先贵. 土壤微生物研究原理与方法. 北京: 高等教育出版社, 2010: 243- 265.
[28] 鲍士旦. 土壤农化分析 (第三版). 北京: 中国农业出版社, 2000: 44- 196.
[29] 李延茂, 胡江春, 汪思龙, 王书锦. 森林生态系统中土壤微生物的作用与应用. 应用生态学报, 2004, 15(10): 1943- 1946.
[30] 张萍. 西双版纳次生林土壤微生物生态分布及其生化特性的研究. 生态学杂志, 1995, 14(1): 21- 26.
[33] 姚槐应, 黄昌勇. 土壤微生物生态学及其实验技术. 北京: 科学出版社, 2006.
[34] 薛立, 邝立刚, 陈红跃, 谭绍满. 不同林分土壤养分、微生物与酶活性的研究. 土壤学报, 2003, 40(2): 280- 285.
[35] 李潮海, 王小星, 王群, 郝四平. 不同质地土壤玉米根际生物活性研究. 中国农业科学, 2007, 40(2): 412- 418.
[36] 王茂胜, 姜超英, 潘文杰, 薛小平, 陈懿, 梁永江. 不同连作年限的植烟土壤理化性质与微生物群落动态研究. 安徽农业科学, 2008, 36(12): 5033- 5034, 5052- 5052.
[37] 白清云. 土壤微生物群落结构的化学评价方法. 农业环境保护, 1997, 16(6): 252- 256.
[39] 胡亚林, 汪思龙, 黄宇, 于小军. 凋落物化学组成对土壤微生物学性状及土壤酶活性的影响. 生态学报, 2005, 25(10): 2662- 2668.
[40] 郑文教, 王良睦, 林鹏. 福建和溪亚热带雨林土壤酶活性的研究. 生态学杂志, 1995, 14(6): 16- 20.
[42] 杨涛, 徐慧, 方德华, 朱教君. 樟子松林下土壤养分、微生物及酶活性的研究. 土壤通报, 2006, 37(2): 253- 257.
[43] 和文祥, 朱铭莪. 陕西土壤脲酶活性与土壤肥力关系分析. 土壤学报, 1997, 34(4): 392- 398.
[44] 刘广深, 徐冬梅, 许中坚, 王红宇, 刘维屏. 用通径分析法研究土壤水解酶活性与土壤性质的关系. 土壤学报, 2003, 40(5): 756- 762.
[46] 王启兰, 曹广民, 王长庭. 高寒草甸不同植被土壤微生物数量及微生物生物量的特征. 生态学杂志, 2007, 26(7): 1002- 1008.
[48] 林启美, 赵小蓉, 孙焱鑫, 姚军. 四种不同生态系统的土壤解磷细菌数量及种群分布. 土壤与环境, 2000, 9(1): 34- 37.
Responses of soil microorganisms and soil enzyme activities to different land use patterns in the water-level-fluctuating zone of the Three Gorges Reservoir region
MA Peng, LI Changxiao*, LEI Ming, YANG Yujing, MA Jun
KeyLaboratoryfortheEco-EnvironmentoftheThreeGorgesReservoirRegionoftheMinistryofEducation,CollegeofLifeSciences,SouthwestUniversity,Chongqing400715,China
The water-level fluctuating zone of the Three Gorges Reservoir (TGR) region contains several different land use types which have been altered or newly established since the commencement of the dam′s operations. This study sought to examine the variation of soil microorganisms (the quantity of bacteria, actinomycetes and fungi), soil enzyme activity, soil nutrient content and the relationship among these factors under three land-use regimes in the Ruxi river basin area: grassland, abandoned farmland and farmland. 30 sampling plots from 11 grassland, 16 abandoned farmland and 3 farmland in Ruxi river basin (a typical region in the TGR area) were set up. All samples were collected in the same month and from the same elevation to control for seasonal and flooding influences on soil microbiology. Soil samples were collected from the 0—20 cm and 20—40 cm soil layers for each sampling plots. Results showed that there were significant differences among land uses in certain soil biochemical properties. Of the three types of land use patterns, abandoned farmland displayed the highest quantity of bacteria, while the amounts of fungi and actinomycetes were the greatest in grassland. The activity of hydrogen peroxidase, invertase, protease and urease were also higher in abandoned farmland than in the other two land patterns. However, phosphatase activity was significantly higher in farmland than in abandoned farmland and grassland. Total nitrogen (TN), available phosphorus (AP) and available potassium (AK) concentrations were significantly lower in grasslands compared to farmland, while the organic matter (OM) content was significantly higher there than in abandoned farmland and farmland. There were no significant differences among total potassium (TK), total phosphorus (TP) or available nitrogen (AN) content or protease activity under the three kinds of land use patterns. Soil depth only had a significant impact on the quantity of soil microbes, invertase activity, urease activity and OM content. Furthermore, the effect exerted by land use type in combination with soil depth was only significant in invertase activity. The pH value of the abandoned farmland was significantly higher than the other two patterns of land use. An analysis of correlation of the relationships among the soil biochemical characteristics indicated that the most significant association existed between the pH value and the soil biological characteristics, suggesting that pH is a decisive influence on the other biochemical parameters in this region. In addition, the quantity of fungi and actinomycetes in soil were significantly positively correlated with OM content underling the important role these species play in improving soil fertility in this area. Compared to abandoned farmland and farmland, grassland plays an important role in stabilizing the soil environment by retaining soil nutrients and improving soil fertility in the fluctuating zone of the TGR region. Therefore, it is suggested that more land should be converted from farmland to grassland.
Three Gorges Reservoir region; soil microorganism; soil enzyme; water-level-fluctuating zone; agricultural activity
国家林业公益性行业科研专项资助项目(201004039);重庆市自然科学基金重点资助项目(CSTC2013JJB00004);留学回国人员科研启动基金资助项目(教外司留[2010- 1561]);中央高校基本科研业务费专项资金资助项目(XDJK2013A011)
2013- 06- 08;
2013- 10- 16
10.5846/stxb201306081443
*通讯作者Corresponding author.E-mail: lichangx@swu.edu.cn
马朋,李昌晓, 雷明, 杨予静,马骏.三峡库区岸坡消落带草地、弃耕地和耕地土壤微生物及酶活性特征.生态学报,2014,34(4):1010- 1020.
Ma P, Li C X, Lei M, Yang Y J, Ma J.Responses of soil microorganisms and soil enzyme activities to different land use patterns in the water-level-fluctuating zone of the Three Gorges Reservoir region .Acta Ecologica Sinica,2014,34(4):1010- 1020.
