三工河流域琵琶柴群落特征与土壤因子的相关分析
2014-08-08赵学春来利明朱林海王健健王永吉周继华姜联合鲁洪斌赵春强郑元润
赵学春,来利明, 朱林海,王健健, 王永吉,周继华,姜联合,鲁洪斌,赵春强,郑元润,*
(1. 中国科学院植物研究所,北京 100093; 2. 中国科学院大学,北京 100049;3. 青城山-都江堰旅游景区管理局, 都江堰 611843)
三工河流域琵琶柴群落特征与土壤因子的相关分析
赵学春1,2,来利明1, 朱林海1,王健健1,2, 王永吉1,2,周继华1,2,姜联合1,鲁洪斌3,赵春强3,郑元润1,*
(1. 中国科学院植物研究所,北京 100093; 2. 中国科学院大学,北京 100049;3. 青城山-都江堰旅游景区管理局, 都江堰 611843)
琵琶柴(Reaumuriasoongorica)是我国荒漠地区分布最广的地带性植被类型之一,对维系荒漠地区生态系统的稳定性具有重要作用。以三工河流域两个琵琶柴群落为对象,在2010年主要生长季节(6—10月),通过群落和土壤调查,采用土钻法、土柱法、地上收割法对两个琵琶柴群落的土壤性质、生物多样性、细根生物量、地上生物量、生物多样性与土壤性质的关系进行研究,结果表明:两个琵琶柴群落在冠幅、盖度、多度和物种多样性等方面均存在显著差异。在0—100 cm土壤层内,两个群落土壤电导率、pH值、容重、含水量存在显著差异。除土壤容重外,群落2各个土壤因子的值均大于群落1,并随土壤深度的增加表现出类似的趋势。两个群落物种多样性指数、地上生物量、细根生物量存在显著差异,从6月到10月呈现先下降再上升的趋势。由于7、8月群落1有大量夏雨型短命植物和类短命草本植物的出现,Shannon-Wiener多样性指数、Pielou均匀度指数急剧降低,Simpson指数表现出相反的变化趋势。群落2土壤电导率和pH值较高,草本植物鲜有出现,多样性指数和均匀度指数变化均较为平缓。两个群落的Sorenson相似性系数较低,群落差异明显。相关和回归分析表明土壤环境因子是导致两个琵琶柴群落特征、生物多样性和生物量不同的主要因素。较高的土壤含水量可以增加琵琶群落的生物多样性,较高的土壤容重抑制琵琶柴群落细根的生长,轻度的干旱胁迫促进地上生物量的积累,一定浓度的土壤pH值和土壤盐分可以促进琵琶柴群落细根的生长。
干旱区; 琵琶柴群落; 生物多样性; 生物量; 土壤因子
植物群落与环境因子的关系是生态学研究的热点问题[1- 2],气候、土壤及微环境条件的变化可在不同尺度上显著影响植物群落的结构和功能。即使在同一植被带内,由于环境因子的变化,也可造成类似的植物群落在结构和功能上的显著变化。关于植被大尺度格局与气候及土壤关系的研究很多, Woodward和Williams研究了全球和区域水平气候和植物分布的关系[3]。Ariza和Tielbörger分析了植物-环境关系及其随环境尺度的变化[4]。Kramer等探讨了空间尺度对1年生植物分布的作用和决定机制[5]。就荒漠地区而言,Schlesinger等分析了荒漠地区土壤环境对植物结构和功能的影响,认为土壤条件决定植物的生长发育与分布[6]。Ma等认为土壤盐分和水分制约植物群落的形成和演替[7],Sperry和Hacke[8]及Li等[9]研究了植物在干旱生境下生理和形态上产生的适应性反应。但在气候相同、土壤条件类似的区域内,微环境条件变化对自然生态系统结构和功能影响的研究较少。
琵琶柴(Reaumuriasoongorica)为柽柳科(Tamaricaceae)红砂属(Reaumuria)小灌木,广泛分布于我国西北荒漠地区,为我国荒漠地区分布最广的地带性植被类型之一,从鄂尔多斯西部、阿拉善、河西走廊、柴达木盆地、北山、噶顺戈壁到塔里木盆地和准噶尔盆地,形成面积巨大的盐柴类荒漠。琵琶柴亦是新疆阜康三工河流域的典型建群种和优势种,具有极强的抗干旱、耐盐碱特性[10],对土壤盐碱化改良、植被恢复以及维持荒漠生态系统的稳定性具有重要意义。
琵琶柴为泌盐植物,植物群落的建成除受到植物本身各种生物学特性影响外, 同时深受环境因子的影响。水分是影响荒漠地区植物生长发育的关键因子[7],是琵琶柴群落发生、发展和演化的决定因素[9]。土壤含盐量亦是影响琵琶柴群落组成的重要因素[11],影响着盐生植物群落的丰富度和多样性。
野外调查中发现,在三工河流域琵琶柴群落典型分布区内,两个相距较近,地形、地貌类似的琵琶柴群落在冠幅、盖度、密度、多度、生物量及物种多样性之间存在着很大变化,引起这种变化的原因是什么?本文旨在通过野外调查,比较分析两个琵琶柴群落的结构和功能及其相应的环境因子,探讨其结构和功能变化的机理,对深入理解琵琶柴群落与环境的关系,理解微环境变化对植物群落的影响机制具有重要意义,同时可为更加有效地管理天然琵琶柴群落,恢复退化琵琶柴群落提供科学基础。
1 材料与方法
1.1 研究区概况
研究地点位于新疆天山中段北坡准噶尔盆地南缘的三工河流域,地理坐标为87°43′—88°44′E, 43°45′—45°29′N,整个流域南高北低, 由东南向西北倾斜,流域面积1670 km2。研究区域为典型的温带荒漠气候,夏季炎热而冬季寒冷,降水少而蒸发量大。年平均气温6.6 ℃,最高气温42.6 ℃,最低气温-41.6 ℃,7月份平均气温25.6 ℃,1月份平均气温-17 ℃;年均降水量164 mm,年蒸发量1780—2453 mm,冬季平均积雪厚度29 cm,无霜期174 d。
研究区域土壤成土母质以冲积物为主,土壤类型为典型荒漠盐碱土,pH值均大于8.5,土壤生物过程较弱,有机碳含量较低 (<4.0 g/kg)。地带性植被为荒漠植被,其中以柽柳科(Tamaricaceae)琵琶柴属(Reaumuria)、柽柳属(Tamarix),藜科(Chenopodiaceae)梭梭属(Haloxylon)、猪毛菜属(Salsola)、碱蓬属(Suaeda),蒺藜科(Zygophyllaceae)白刺属(Nitraria)、霸王属(Sarcozygium)为重要建群种。其中,琵琶柴荒漠植被是北疆最典型的植被类型之一。
1.2 样地设置与野外观测
在研究区选取两个分布距离较近,但外貌结构具有显著差别的琵琶柴群落,基本情况见表1。

表1 两个琵琶柴群落的基本情况
于2010年主要生长季(6—10月)每月月初,在两个琵琶柴群落内分别设置3个25 m×25 m 的样方,记录样方内的物种数目及每个物种的个体数、冠幅、多度、高度、盖度等。在每个25 m×25 m的样方内设置3个5 m×5 m的样方,刈割植物地上部分,测定地上生物量。采用土柱法测定细根生物量,在每个5 m×5 m的样方内设置3个50 cm×50 cm的采样点,每隔10 cm挖取土样,直到鲜有根系为止。将土壤样品带回实验室,置于细筛之上用水冲洗,同时去除其它杂质,仅留直径小于2 mm的细根。在每个25 m×25 m 的样方内,随机选取3个样点进行土壤样品采集,采样时去掉地表凋落物,用土钻依次钻取0—5 cm、5—10 cm、10—20 cm、20—30 cm、30—40 cm、40—50 cm、50—100 cm处的土壤样品各约300 g,用于分析土壤pH值、电导率等指标;在每个样点内挖掘土壤剖面,用土壤环刀每隔10 cm分层采集用于测定土壤容重和含水量的样品,同时用Em50测定土壤温度。
1.3 室内分析
用于测定土壤容重的样品在105 ℃烘干至恒重,同时测定土壤含水量。用于测定其他指标的土壤样品,置于干燥阴凉处风干,挑去其中根系、未分解的有机质,过100目土壤筛。分别采用pH计和DDSJ- 308型电导仪测定土壤pH值和电导率。将琵琶柴地上生物量和细根生物量于65 ℃条件下烘干至恒重,测定干重。
1.4 数据分析
采用t检验法,比较两个琵琶柴群落特征及其土壤含水量、pH值、容重、电导率、土壤温度、地上生物量和细根生物量的差异。
采用以下公式计算琵琶柴群落的物种多样性:
(1)物种数目 s
(2) Shannon-Wiener多样性指数
H=-∑PilgPi
(3)Simpson指数
(i为1,2,3,…,s)
(4) Pielou均匀度指数
J=(-∑PivlnPiv)/lns
(5)Sorenson相似性系数
式中,s为物种总数,N为全部物种个体总数;H为香农-维纳多样性指数,Pi为抽样个体属于某一物种的概率;Sd为Simpson指数,ni为第i个物种的个体数,N为全部物种个体总数;J为Pielou均匀度指数,Piv为ni的相对重要值(相对高度+相对盖度);Cs为Sorenson相似性系数,j为两群落或样地共有的种数,a为群落1的物种数,b为群落2的物种数。
数据分析检验均在SPSS16.0中完成。
2 结果
2.1 琵琶柴群落特征
两个琵琶柴群落物种数均较少,群落1为8种,包括琵琶柴和梭梭2个基本种,全年均存在于群落之中;猪毛菜和大花骆蹄瓣(Zygophyllumpotaninii)2种夏雨型短命植物,出现在夏雨较为集中的6—8月;二色补血草(Limoniumbicolor)、兜藜(Panderiaturkestanica)、角果藜和盐地碱蓬(Suaedasalsa)4 种类短命草本植物,其中二色补血草、角果藜、兜藜出现在初春至9月,盐地碱蓬出现于6月中旬至生长季结束。群落2物种数为4种,包括琵琶柴、小果白刺、梭梭3种基本种,猪毛菜1种夏雨型短命植物,类短命植物未出现于群落之中。群落结构简单,仅有灌木层和草本层。盖度较小,群落1为25%,群落2为35%。
由图1可见,在主要生长季节两个琵琶柴群落的冠幅、盖度、高度随琵琶柴的生长大致呈递增趋势,10月份或有微量降低。两个琵琶柴群落除植株高度无明显差异外,密度、冠幅、盖度、多度均存在显著差异。
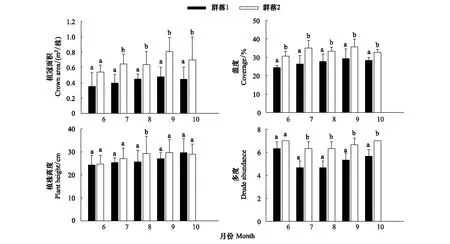
图1 两个琵琶柴群落的植冠面积、盖度、多度、高度(平均值±标准误差)Fig.1 Crown area, coverage, abundance and height of Reaumuria soongorica communities (mean ± SE)不同字母表示在相同时间下两个群落指标存在显著差异
群落1和2平均地上生物量分别为100.20、140.25 g/m2,平均细根生物量分别为35.92、105.13 g/m2(图2),差异显著,并表现出明显的季节变化。两个琵琶柴群落生物量变化规律相似,6月份最低,随后逐渐升高,在9月初达到峰值,随后急剧下降;群落1地上生物量与细根生物量变化均较群落2变化缓慢。
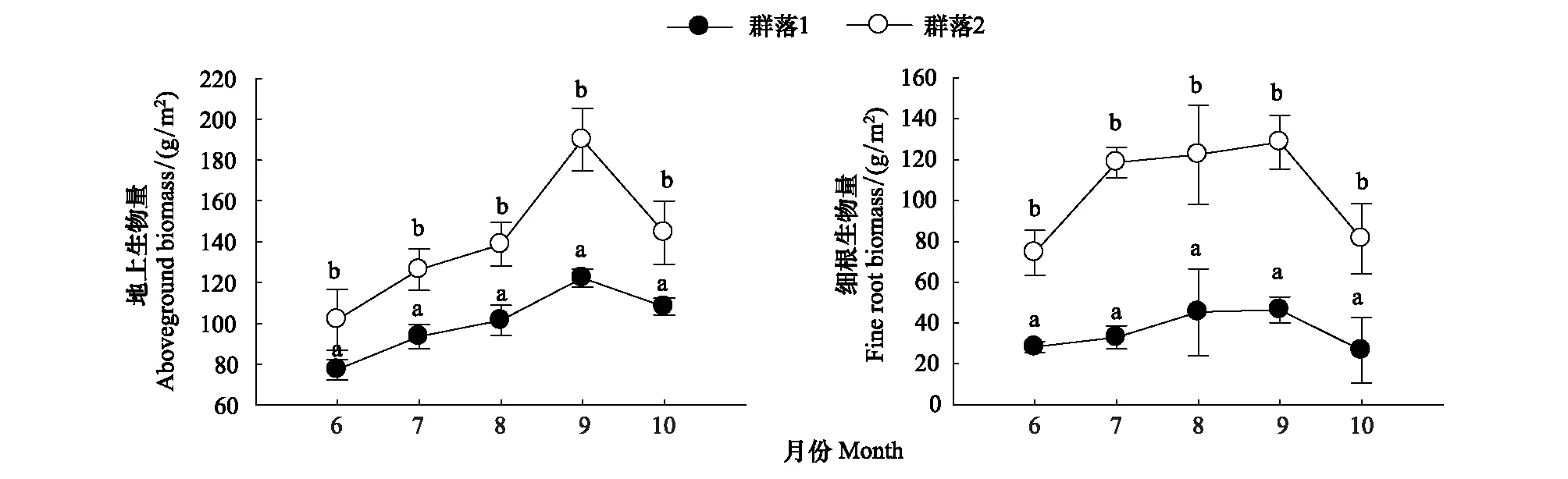
图2 两个琵琶柴群落地上生物量、细根生物量季节变化(平均值±标准误差)Fig.2 Seasonal variations of aboveground biomass and fine root biomass of Reaumuria soongorica communities (mean ± SE)不同字母表示在相同时间下两个群落指标存在显著差异
由图3可见,两个琵琶柴群落的物种数目相对较低,群落1的物种数目明显大于群落2。季节变化趋势一致,6月最低,随后逐渐升高,8月达到最大,之后逐渐下降。
就Shannon-Wiener指数而言,群落1明显高于群落2,群落1的指数值由6月的0.67下降到8月的0.43,9月后有所增加,10月再次下降。群落2指数值从6月份到10月份变化趋势平缓。
对于Simpson指数,除6月外,群落1指数值均大于群落2。季节变化与Shannon-Wiener多样性指数变化趋势相反。
两个群落Pielou均匀度指数季节变化趋势与Shannon-Wiener指数几乎一致,不同之处是除6月外,群落1指数值均比群落2低。
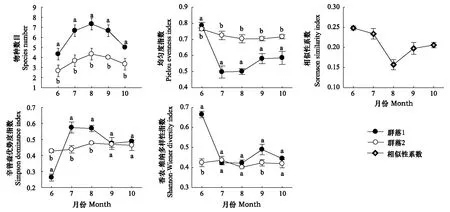
图3 两个琵琶柴群落物种多样性季节变化(平均值±标准误差)Fig.3 Seasonal variations of species diversity of Reaumuria soongorica communities (mean±SE)不同字母表示在相同时间下两个群落指标存在显著差异
两个琵琶柴群落的Sorenson相似性系数较低且季节波动大,平均值仅为0.21,从6月的0.25降低至8月的0.16,之后在10月增加到0.20。
2.2 土壤理化性质
两个群落1 m内的土壤pH值随深度的增加表现为先增大后减小的趋势。群落1的pH值变化范围为8.3—9.0,平均大小为8.73;群落2的pH值范围变化为9.1—9.7,平均大小为9.32。
群落2土壤发生高强度盐胀反应,表层(0—10 cm)疏松,土壤容重较小,仅为0.9 g/cm3, 随土壤深度增加,表现出逐渐增大的趋势。群落1土壤表现出一定的板结现象,表层土壤容重较大,随土壤深度的增加土壤容重先降低后逐渐增加,超过40 cm以后容重增加趋势变缓。
群落1的土壤含水量明显低于群落2,从表层的0.79%增加到1 m处的7.04%,表层土壤含水量较低,约为1%,超过20 cm后逐渐达到6%以上,30 cm以后增加不明显。群落2表层土壤含水量亦较低,但达到2%左右,深度超过10 cm后达到6%,40 cm深度时达到12%,其后增加不明显。
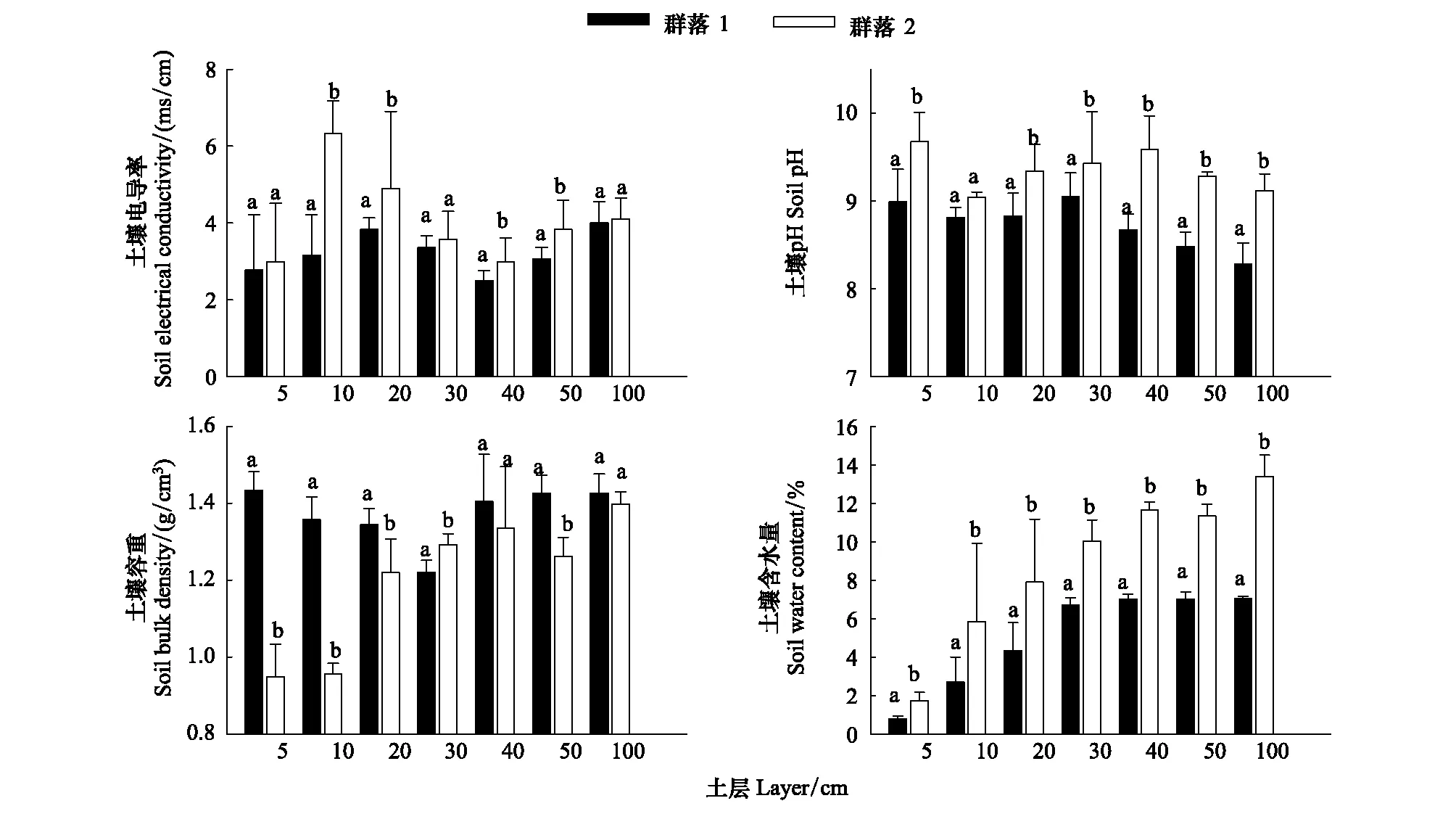
图4 琵琶柴群落不同层次土壤电导率、pH值、容重和含水量 (平均值±标准误差)Fig.4 Soil electrical conductivity, pH, bulk density, soil water content of two Reaumuria soongorica communities (mean±SE) in different soil layers不同字母表示在相同时间下两个群落指标存在显著差异
2.3 物种多样性与土壤因子的关系
表2显示了群落1各多样性指数与土壤因子的关系。Shannon指数、Pielou均匀度指数均随土壤含水量增加而增加,随土壤电导率和土壤pH值的增大而减小,Simpson指数表现出相反的变化趋势。此外,仅Shannon指数与土壤容重的拟合达到了显著水平,生物多样性指数与土壤温度的关系不显著。
表3显示了群落2各多样性指数与土壤因子的关系。其中仅Pielou均匀度指数随土壤容重、土壤电导率和土壤pH值的增加而减小,Simpson指数随土壤容重和土壤电导率的增加而增大,其它多样性指数与土壤因子之间不存在显著关系。

表2 群落1多样性指数与土壤含水量、容重、电导率、pH值、容重的回归方程
*P< 0.05; **P< 0.01
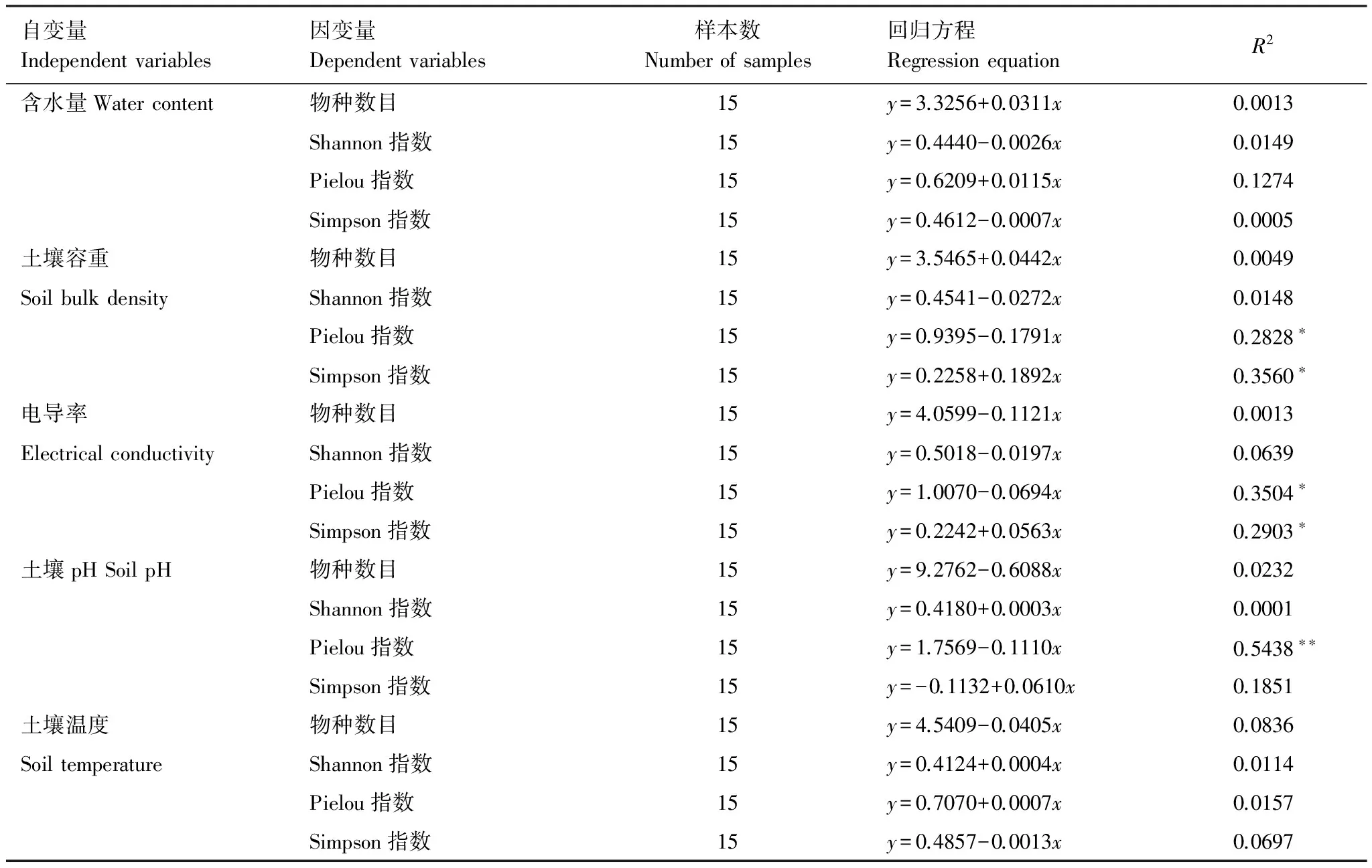
表3 群落2多样性指数与土壤含水量、容重、电导率、pH值、容重的回归方程
*P< 0.05; **P< 0.01
由表4可见,pH值、土壤含水量进入群落1 Shannon指数、Pielou指数、Simpson指数与土壤因子的逐步回归方程中。pH值进入群落2 Pielou指数与土壤因子的逐步回归方程;电导率、土壤含水量进入Simpson指数与土壤因子的逐步回归方程。
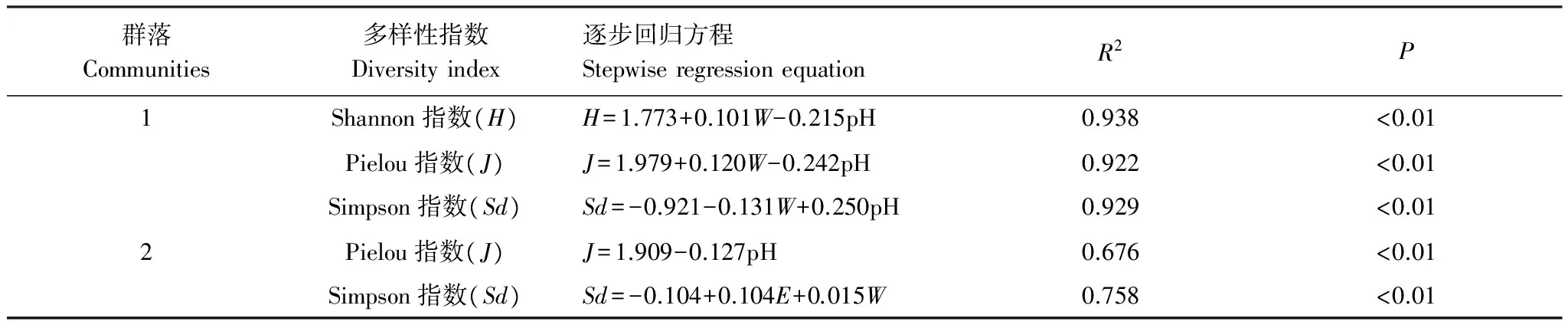
表4 多样性指数与影响因素的逐步回归分析
W:土壤含水量(%); pH: 土壤pH;E:土壤电导率(ms/cm)
2.4 细根生物量与土壤因子的关系
由图5可见,群落1细根生物量与土壤容重关系显著。群落2细根生物量与土壤容重关系不显著。
阵头规定,家乡宗教庙会时,青年必须赶回家乡参加子弟阵头的训练和表演。这一传统相当于“春节”,是人们繁忙之余顺应亲人或族群团聚的精神寄托,在于合家团聚、祭祀祈福;“九天”成立职业阵头团体一方面是满足社会需求,另一方面是求生存求发展。吴明认为传统体育从文化的功能上来说是一种“文化资源”,一种可支配的资源,是会给人们带来效益的[11]。如果一个传统在生活中不能发挥任何作用,人们也不会遵从,自然就会消亡。
群落1细根生物量随电导率的增加而逐渐增加,在电导率3.6 ms/cm处达到峰值后缓慢下降。群落2表现出完全不同的规律,细根生物量随电导率增加近直线增加。
群落1细根生物量随pH值增加先增加后下降,在pH值为9.10时达到最大。群落2细根生物量在可见pH值范围内,随pH值的增加而增加,但增加速率逐渐变慢。
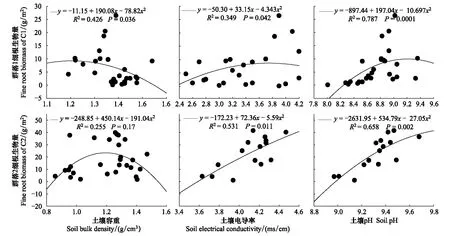
图5 两个琵琶柴群落细根生物量与土壤容重、电导率、pH的回归方程Fig.5 Regression equations of fine root biomass and soil bulk density, soil electrical conductivity, soil pH
由表5可见,pH、电导率进入群落1细根生物量逐步回归方程。土壤pH值、土壤电导率和土壤含水量进入了与群落2细根生物量逐步回归方程中。
2.5 地上生物量与土壤因子的关系
由图6可见,群落1地上生物量与土壤含水量关系显著,随土壤含水量的增加逐渐增加,在含水量为6.09%达到最大值后地上生物量开始下降。群落2地上生物量与土壤含水量关系不显著。群落1和群落2地上生物量与土壤容重关系均显著,随土壤容重的增加地上生物量不断增大。群落1和群落2地上生物量均随电导率的增加先增大后逐渐降低。
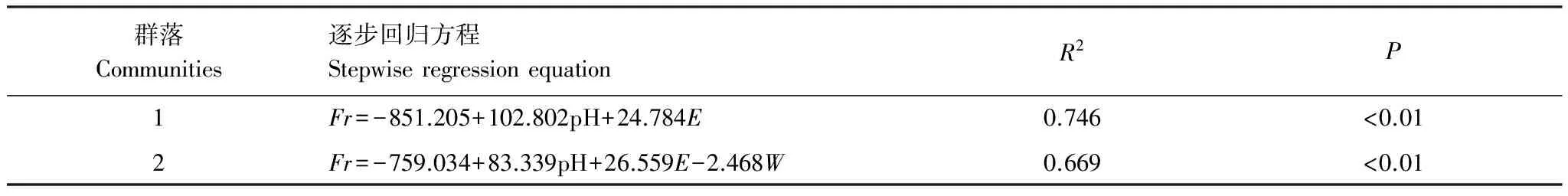
表5 细根生物量与影响因素的逐步回归分析
Fr: 细根生物量(g/m2);W: 土壤含水量(%); pH: 土壤pH;E: 土壤电导率(ms/cm)
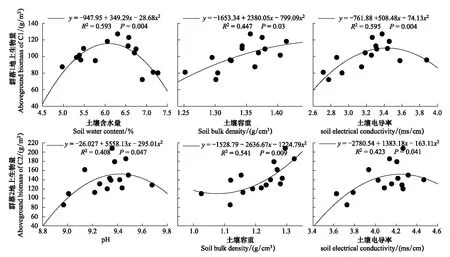
图6 两个琵琶柴群落细根生物量与土壤含水量、土壤容重、电导率、pH值的回归方程Fig.6 Regression equations of fine root biomass and soil water content, soil bulk density, soil electrical conductivity, soil pH
群落1地上生物量与土壤pH值关系不显著,群落2地上生物量随土壤pH值的增加逐渐增加,在pH值9.42时达到最大值后开始下降。
由表6可见,pH值、土壤温度和土壤含水量进入群落1地上生物量逐步回归方程。群落2仅有土壤容重进入地上生物量逐步回归方程中。
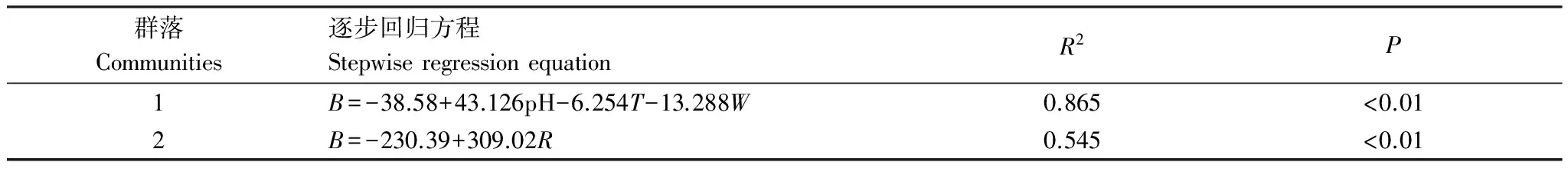
表6 地上生物量与影响因素的逐步回归分析
B: 地上生物量(g/m2);W: 土壤含水量(%); pH: 土壤pH;R: 土壤容重(g/cm3)
3 讨论
3.1 琵琶柴群落物种多样性
物种多样性是度量生态系统结构、功能的主要指标[12],其大小影响着群落的生产力和生态系统稳定性[13]。气候变化、人类干扰、极端环境、环境异质性和生物间的相互作用决定着植物群落组成和多样性变化[14]。
本研究中群落1与群落2的多样性指标在时间和空间尺度上均表现出较大的差异,主要与群落1 7、8月份有大量夏雨型短命草本植物出现,群落2此类植物鲜有出现相关。因此,猪毛菜、大花骆驼瓣、角果藜、二色补血草等夏雨型草本植物在7、8月的大量出现导致群落1的物种数目、Simpson指数显著增加,Shannon-Wiener指数、Pielou均匀度指数、Sorenson相似性系数显著降低。群落1中6月和9、10月草本植物的种类、个体总数虽不及7、8月多,但均匀度较大,Shannon-Wiener指数亦较大。Simpson指数表现出与Shannon-Wiener指数相反的趋势。
群落2因其土壤表面蓬松和高盐高碱的影响,限制了其它植物种子的萌发,夏雨型草本植物仅有极少量猪毛菜出现,对多样性指数的影响较小。群落2较群落1组成简单且植物个体总数少,受物种数目和个体总数的共同影响,Pielou均匀度指数在整个生长季节均较群落1大。受均匀度、物种数目和个体总数的共同影响,群落2 Shannon-Wiener指数在整个生长季呈平缓下降趋势,Simpson指数呈平缓上升趋势。
研究区域海拔变化较小,气候条件、人类活动干扰类似,表现为土壤环境条件对更多物种生存的限制,特别是土壤水盐的空间异质性是限制本地区植物群落分布的主要原因。琵琶柴群落物种Shannon-Wiener多样性和Pielou均匀度随土壤电导率和pH值的增大显著降低,这与顾雪峰关于土壤盐渍化是限制阜康绿洲植物群落分布和生物多样性主要原因的结论类似[15]。因此,可以认为由于土壤盐碱化程度较高,土壤盐分含量和土壤pH值限制了三工河流域琵琶柴群落生物多样性的发展,决定着种群繁衍和群落演替。
3.2 琵琶柴生物量
生物量是评价生态系统功能的重要参数之一,生物量对研究生态系统的碳循环和营养物质分配具有重要意义[16]。一般而言,荒漠生态系统由于受极端环境的影响,植物群落物种多样性小、植被分布稀疏、盖度小、生物量较低。本文中琵琶柴群落1和群落2地上生物量的平均值分别为100.20、140.25 g/m2,大于赵成义、刘速报道的55.55、63.63 g/株的结果[17- 18],但小于马茂华报道的295.6 g/m2[19]。琵琶柴群落1和群落2细根生物量平均为35.92、105.13 g/m2小于Jackson等报道的全球荒漠生态系统细根生物量(270 g/m2)[20],这可能与本文琵琶柴群落分布于极端干旱区有关,但本文结果与裴志琴等报道的琵琶柴群落细根生物量(54.51 g/m2)[21]接近。
造成植物生物量不同的直接原因是降水、温度、光照、海拔高度、土壤等因素,本实验中两个植物群落除了土壤性质差异之外,其它环境因子基本一致,因此土壤因子是造成琵琶柴细根生物量不同的主要原因。细根生物量是生物量的重要组成部分[22],对土壤因子的变化响应灵敏,其生长对整个群落生物量的影响十分明显[23]。本文结果表明细根生物量与土壤容重、pH值和电导率具有显著的相关性,与土壤含水量和土壤温度相关性不明显。琵琶柴群落1和群落2的平均土壤容重分别为1.36、1.21 g/cm3,由于群落1具有较大的土壤容重,降低了土壤孔隙度和氧气含量,导致土壤微生物、有机质等含量减少,限制了植物根系的伸展,降低了水分和养分的利用效率。因此,导致细根生物量降低。
琵琶柴为耐盐碱植物,通过Na+和K+含量的增加而调节渗透势以适应土壤盐度的增加[10]。何玉惠认为琵琶柴可以在高盐碱条件下生长良好[24],并具有极强的抗盐、抗干旱能力[19],耐盐能力越强的盐生植物,其根际的盐分富集程度也更大[25]。周航宇采用150mmol/L的盐溶液处理琵琶柴后,地上部分干重增加18%[10],表明适当的盐分处理可以促进琵琶柴植株地上部分的生长。谭会娟等发现100—150 mmol/L的NaCl可以显著促进琵琶柴愈伤组织的生长[26]。杨成龙等认为Na+和CI-具有促进盐生植物的生长和地上部分器官肉质化的作用[27]。一些学者在霸王(Zygophyllumxanthoxylum)、细叶滨藜(Atriplexgmelini)和盐地碱蓬(Suaedasalsa)等一些盐生植物中也发现了类似的现象[7,28]。因此适当浓度的土壤盐碱可以促进琵琶柴细根的生长和生物量的增加,群落2因其具有较高的盐分含量和pH值,促进作用较群落1更为明显,其机理仍需进一步研究。
综上所述,干旱区琵琶柴群落受土壤环境条件的影响,物种种类少、结构简单,生物多样性低,较高的土壤含水量可以增加琵琶柴群落生物多样性,土壤盐碱化是影响植物群落和生物多样性的主要因素;土壤容重、pH值和土壤盐分含量是造成两个琵琶柴群落生长和多样性差异的主要因素,较高的土壤容重抑制琵琶柴群落根系的生长,轻度的干旱胁迫促进地上生物量的积累,一定浓度的土壤pH值和土壤盐分可以促进琵琶柴根系的生长和生物量的增加。
[1] Grime J P, Brown V K, Thompson K, Masters G J, Hillier S H, Clarke I P, Askew A P, Corker D, Kielty J P. The response of two contrasting limestone grasslands to simulated climate change. Science, 2000, 289(5480): 762- 765.
[2] Brooker R W. Plant-plant interactions and environmental change. New Phytologist, 2006, 171(2): 271- 284.
[3] Woodward E I, Williams B G. Climate and plant distribution at global and local scales. Vegetatio, 1987, 69(1/3): 189- 197.
[4] Ariza C, Tielbörger K. An evolutionary approach to studying the relative importance of plant-plant interactions along environmental gradients. Functional Ecology, 2011, 25(4): 932- 942.
[5] Kramer H A C, Montgomery D M, Eckhart V M, Geber M A. Environmental and dispersal controls of an annual plant′s distribution: how similar are patterns and apparent processes at two spatial scales?. Plant Ecology, 2011, 212(11): 1887- 1899.
[6] Schlesinger W H, Pilmanis A M. Plant-soil interactions in deserts. Biogeochemistry, 1998, 42(1/2): 169- 187.
[7] Ma Q, Yue L J, Zhang J L, Wu G Q, Wang S M. Sodium chloride improves photosynthesis and water status in the succulent xerophyteZygophyllumxanthoxylum. Tree Physiology, 2011, 32(1): 4- 13.
[8] Sperry J S, Hacke U G. Desert shrub water relations with respect to soil characteristics and plant functional type. Functional Ecology, 2002, 16(3): 367- 378.
[9] Li Y, Cohen Y, Fuchs M, Wallach R, Cohen S, Fuchs M. On quantifying soil water deficit of a partially wetted root zone by the response of canopy or leaf conductance. Agricultural Water Management, 2004, 6(1): 21- 38.
[10] Zhou H Y, Bao A K, Du B Q, Wang S M. The physiological mechanisms underlying how eremophyteReaumuriasoongoricaresponses to severe NaCl stress. Pratacultural Science, 2012, 29(1): 71- 75.
[11] Zhang B, Meng B, Hao J X, Ding W H. Heterogeneity of soil moisture and salt Contents and its eco-environmental effects in oasis-desert belt in arid zone-Taking Zhangye oasis in the middle reaches of Heihe River as a case study. Journal of Desert Research, 2006, 26(1): 81- 84.
[12] Tylianakis J M, Tscharntke T, Klein A M. Diversity, ecosystem function, and stability of parasitoid-host interactions across a tropical habitat gradient. Ecology, 2006, 87(12): 3047- 3057.
[13] Tilman D. Causes, consequences and ethics of biodiversity. Nature, 2000, 405(6783): 208- 211.
[14] He J S, Chen W L. A review of gradient changes in species diversity of land plant communities. Acta Ecologica Sinica, 1997, 17(1): 91- 99.
[15] Song C Y, Guo K, Liu G H. Relationships between plant community`s species diversity and soil factors on Otingdag sandy land. Chinese Journal of Ecology, 2008, 27(1): 8- 13.
[16] Potter C S. Terrestrial biomass and the effects of deforestation on the global carbon cycle. BioScience, 1999, 49(10): 769- 778.
[17] Zhao C Y, Song Y D, Wang Y C, Jiang P A. Estimation of aboveground biomass of desert plants. Chinese Journal of Applied Ecology, 2004, 15(1): 49- 52.
[18] Liu S, Liu X Y. The estimating model of upper plant weight onReaumuriasoongoricasemishrub. Arid Zone Research, 1996, 13(1): 36- 41.
[19] Ma M H, Kong L S. The bio-ecological characteristics ofReaumuriasoongoricaon the border of oasis at Hutubi, Xinjiang. Acta Phytoecologica Sinica, 1998, 22(3): 237- 224.
[20] Jackson R B, Mooney H A, Schulze E D. A global budget for fine root biomass, surface area, and nutrient contents. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(4): 7362- 7366.
[21] Pei Z Q, Zhou Y, Zheng Y R, Xiao C W. Contribution of fine root turnover to the soil organic carbon cycling in aReaumuriasoongoricacommunity in an arid ecosystem of Xinjiang Uygur Autonomous Region, China. Chinese Journal of Plant Ecology, 2011, 35(11): 1182- 1191.
[22] Lukac M, Godbold D L. Fine root biomass and turnover in southern taiga estimated by root inclusion nets. Plant and Soil, 2010, 331(1/2): 505- 513.
[23] King J S, Albaugh T J, Allen H L, Buford M, Strain B R, Dougherty P. Below-ground carbon input to soil is controlled by nutrient availability and fine root dynamics in loblolly pine. New Phytologist, 2002, 154(2): 389- 398
[24] He Y H, Liu X P, Xie Z K. Effects ofReaumuriasoongoricaon its underlying soil properties and herb plant characteristics. Chinese Journal of Ecology, 2011, 30(11): 2432- 2436.
[25] Yi L P, Ma J, Li Y. Soil salt and nutrient concentration in the rhizosphere of desert halophytes. Acta Ecologica Sinica, 2007, 27(9): 3565- 3571.
[26] Tan H J, Jia R L, Liu Y B, Zhao X, Li X R. Characters of ions accumulation inReaumuriasoongoricacallus under salt stress. Journal of Desert Research, 2010, 30(6): 1305- 1310.
[27] Yang C L, Duan R J, Li R M, Hu X W, Fu S P, Guo J C. The physiological characteristics of salt-tolerance inSesuviumportulacastrumL.. Acta Ecologica Sinica, 2010, 30(17): 4617- 4627.
[28] Bajji M, Kinet J M, Lutts S. Salt stress effects on roots and leaves ofAtriplexhalimusL. and their corresponding callus cultures. Plant Science, 1998, 137(2): 137- 142.
参考文献:
[10] 周航宇, 包爱科, 杜宝强, 王锁民. 荒漠植物红砂响应高浓度NaCl的生理机制. 草业科学, 2012, 29(1): 71- 75.
[11] 张勃, 孟宝, 郝建秀, 丁文晖. 干旱区绿洲- 荒漠带土壤水盐异质性及生态环境效应研究——以黑河中游张掖绿洲为例. 中国沙漠, 2006, 26(1): 81- 84.
[14] 贺金生, 陈伟烈. 陆地植物群落物种多样性的梯度变化特征. 生态学报, 1997, 17(1): 91- 99.
[15] 宋创业, 郭柯, 刘高焕. 浑善达克沙地植物群落物种多样性与土壤因子的关系. 生态学杂志, 2008, 27(1): 8- 13.
[17] 赵成义, 宋郁东, 王玉潮, 蒋平安. 几种荒漠植物地上生物量估算的初步研究. 应用生态学报, 2004, 15(1): 49- 52.
[18] 刘速, 刘晓云. 琵琶柴 (Reaumuriasoongorica) 地上植物量的估测模型. 干旱区研究, 1996, 13(1): 36- 41.
[19] 马茂华, 孔令韶. 新疆呼图壁绿洲外缘的琵琶柴生物生态学特性研究. 植物生态学报, 1998, 22(3): 237- 244.
[21] 裴智琴, 周勇, 郑元润, 肖春旺. 干旱区琵琶柴群落细根周转对土壤有机碳循环的贡献. 植物生态学报, 2011, 35(11): 1182- 1191.
[24] 何玉惠, 刘新平, 谢忠奎. 红砂灌丛对土壤和草本植物特征的影响. 生态学杂志, 2011, 30(11): 2432- 2436.
[25] 弋良朋, 马健, 李彦. 荒漠盐生植物根际土壤盐分和养分特征. 生态学报, 2007, 27(9): 3565- 3571.
[26] 谭会娟, 贾荣亮, 刘玉冰, 赵昕, 李新荣. NaCl胁迫下红砂愈伤组织中主要离子累积特征的研究. 中国沙漠, 2010, 30(6): 1305- 1310.
[27] 杨成龙, 段瑞军, 李瑞梅, 胡新文, 符少萍, 郭建春. 盐生植物海马齿耐盐的生理特性. 生态学报, 2010, 30(17): 4617- 4627.
Correlation between characteristics ofReaumuriasoongaricacommunities and soil factors in the Sangong River basin
ZHAO Xuechun1,2, LAI Liming1, ZHU Linhai1, WANG Jianjian1,2,WANG Yongji1,2, ZHOU Jihua1, 2, JIANG Lianhe1, LU Hongbing4, ZHAO Chunqiang4, ZHENG Yuanrun1,*
1InstituteofBotany,ChineseAcademyofSciences,Beijing100093,China2UniversityofChineseAcademyofSciences,Beijing100049,China3QingchengMountain-DujiangyanScenicSpotsAuthority,Dujiangyan611843,China
Reaumuriasoongaricais one of the most widely distributed plant species in arid regions of China and has an important role in maintaining the stability of the desert ecosystem. On the basis of field data, including the species composition, number of species, plant height, coverage and abundance, and selected soil properties (electrical conductivity, pH, bulk density and moisture content), the fine root biomass and aboveground biomass of twoR.soongaricacommunities in the Sangong River basin were investigated over the course of the main growing season (from June to October) of 2010. In addition, by calculation of derivative biodiversity indices comprising Pielou′s evenness index, Simpson′s dominance index, the Shannon-Wiener diversity index, and Sorenson′s similarity index, the relationships between fine root biomass, biodiversity and soil properties of the two communities were analyzed. The results showed that the crown area, coverage, abundance, species number, Pielou′s evenness index, Simpson′s dominance index, Shannon-Wiener diversity index, aboveground biomass, fine root biomass, and the soil electrical conductivity, pH, bulk density and moisture content in the 0—100 cm soil layer of twoR.soongaricacommunities were significantly different. Except for soil bulk density, the values of all soil properties of Community 2 were higher than those of Community 1, and showed similar trends with increment in soil depth. Except for species number and Simpson′s dominance index, the other biodiversity indices decreased initially and thereafter increased from June to October, whereas the aboveground biomass and fine root biomass increased initially and thereafter decreased from June to October. Owing to the appearance of a large number of summer rain-dependent herbs in July and August in Community 1, the Shannon-Wiener diversity index and Pielou′s evenness index showed sharp reductions over the growing season, whereas Simpson′s dominance index showed the opposite trend. Compared with Community 1, Community 2 had higher soil electrical conductivity and soil pH, and few summer rain-dependent herbs, and therefore the Shannon-Wiener diversity index, Pielou′s evenness index and Simpson′s dominance index changed only moderately. In addition, Sorenson′s similarity coefficient was small and the difference between the two communities was significant. Regression analysis showed that soil properties were determinants of the differences in biodiversity and biomass of the two communities. High soil moisture content increased biodiversity, high soil bulk density inhibited fine root growth, and certain soil pH and soil salt contents promoted fine root growth inR.soongaricacommunities. We concluded that soil salt content and soil pH are the main factors that restrict biodiversity, community structure, and growth ofR.soongaricain the Sangong River basin. Differences in microenvironments, especially in soil characteristics, could induce strong differences in two communities with identical dominant species in the same climatic zone. These findings provide a scientific base for management of naturalR.soongaricacommunities and rehabilitation of degraded communities, as well as for improvement of soil salinization in arid regions of China.
arid region;Reaumuriasoongoricacommunity; biodiversity; biomass; soil factor
国家重点基础研究发展计划资助项目(2009CB825103)
2012- 10- 07;
2013- 03- 14
10.5846/stxb201210071379
*通讯作者Corresponding author.E-mail: zhengyr@ibcas.ac.cn
赵学春,来利明, 朱林海,王健健, 王永吉,周继华,姜联合,鲁洪斌,赵春强,郑元润.三工河流域琵琶柴群落特征与土壤因子的相关分析.生态学报,2014,34(4):878- 889.
Zhao X C, Lai L M, Zhu L H, Wang J J,Wang Y J, Zhou J H, Jiang L H, Lu H B, Zhao C Q, Zheng Y R.Correlation between characteristics ofReaumuriasoongaricacommunities and soil factors in the Sangong River basin.Acta Ecologica Sinica,2014,34(4):878- 889.
