基于静态箱式法和生物量评估海北金露梅灌丛草甸碳收支
2014-08-08李红琴李英年张法伟刘晓琴吴启华毛绍娟
李红琴,李英年,*,张法伟,刘晓琴,吴启华,毛绍娟
(1. 中国科学院西北高原生物研究所,西宁 810001;2. 中国科学院高原生物适应与进化重点实验室, 西宁 810001; 3.中国科学院大学,北京 100049)
基于静态箱式法和生物量评估海北金露梅灌丛草甸碳收支
李红琴1,2,李英年1,2,*,张法伟1,2,刘晓琴1,3,吴启华1,3,毛绍娟1,3
(1. 中国科学院西北高原生物研究所,西宁 810001;2. 中国科学院高原生物适应与进化重点实验室, 西宁 810001; 3.中国科学院大学,北京 100049)
高寒灌丛是青藏高原重要植被类型,因特殊生物学性质致使其系统碳功能较难评估。采用静态箱式法测定高寒金露梅(Potentillafruticosa)灌丛草甸的生态系统呼吸,结合生物量收获法估测生态系统净初级碳量。结果表明,高寒金露梅灌丛草甸生态系统呼吸、土壤呼吸和植物呼吸具有明显的季节动态变化,其年总量分别为886.28、444.93 gC/m2和441.36 gC/m2;灌丛区、草本区以及土壤区的呼吸均与5 cm地温具有极显著的指数关系(R2分别为0.95、0.94和0.83),各区温度敏感系数Q10分别为4.40、4.13和3.16;8a(2003—2010)植被净初级生产力平均为468.55 gC/m2。结合系统土壤呼吸,生态系统年均净固碳量为27.19 gC/m2,即高寒金露梅灌丛草甸生态系统为碳汇。对比涡度相关标准方法连续观测数据表明该方法评估生态系统碳功能具有较大可信度。
金露梅灌丛;生态系统呼吸;土壤呼吸;净初级生产力;碳汇能力
陆地生态系统中植被碳库和土壤碳库碳贮存约为大气碳库的3倍,是全球碳循环的重要组成部分[1]。陆地生态系统种类繁多,灌丛生态系统介于木本和草本之间,不仅占有较高的比重,而且具有特殊的生物学性质。伴随着气候暖干化,灌丛化尤其在高寒区域越来越普遍[2]。由于灌丛木质部分相对于草本具有较高的C/N,而且随温度升高而增大,但另一方面灌丛生态系统的土壤有机质和凋落物在暖化情境下分解变快[3],致使灌丛化所引起的系统碳收支变化复杂[4]。通过精确解析灌丛生态系统碳收支特征,可为评估灌丛化所引起的区域碳功能提供科学依据。
高寒灌丛草甸在青藏高原分布面积仅次于高寒草甸,约为0.106×106km2,占青藏高原总面积的4 %左右,多分布在东部海拔2700—4500 m的山地阴坡、土壤湿度较高的平缓滩地,以及地下水位较高的河谷阶地。金露梅(Potentillafruticosa)灌丛草甸生物量较高、土壤有机质含量丰富且因低温分解缓慢,系统碳储量巨大[5- 6],冬季往往易被积雪和结冰所覆盖,夏季多为当地牧民的放牧草场。但在气候变暖和人类活动加剧的双重压力下,生态系统的植被结构和分布现状业已发生改变,尤其是系统的碳源/汇功能变化显著[7]。为了认识和了解青藏高原金露梅灌丛草甸植被类型的碳收支特征,在海北高寒草地生态系统国家野外观测研究站(海北站)于2003年开始利用微气象-涡度相关法观测系统进行大气与植被界面碳通量的观测,取得一定的研究结果[8]。同时相应不定期的进行了生态系统呼吸、土壤呼吸、植被净初级生产碳量、土壤碳库储量等项目监测。本文以静态箱式法解析生态系统植被、土壤呼吸特征,结合植被净初级生产力数据,评估生态系统源/汇功能。并通过对比涡度相关连续数据,评估该方法的可信度,以期为高寒灌丛草甸生态系统碳汇能力的估算和碳循环的研究等提供科学依据。
1 材料与方法
1.1 自然概况
研究在青藏高原东北隅的海北高寒草地生态系统国家野外科学观测研究站(海北站)东北7 km处的金露梅灌丛草甸进行。实验区(3729—3745N,10112—10123E)海拔3358 m,具明显的高原大陆性气候。据海北站资料分析,实验区附近年平均气温约为-2 ℃;年降水量620 mm左右,降水主要集中于暖季的5—9月。区域气候表现出冷季寒冷、干燥、漫长,暖季凉爽、湿润、短暂[9]。土壤类型为暗沃寒冻雏形土(Mol-Cryic Cambisols),土壤发育年轻,土层浅薄,有机质含量丰富[10]。
金露梅灌丛草甸群落由2层组成,上层为金露梅灌丛群落,下层为禾本和莎草为主植物群落。金露梅灌丛株高在30—40 cm之间,最高可达60 cm,其盖度为50%左右。下部草本植物种类异质性较强。草本层中主要有47种植物组成,隶属15科37属,草本层优势种有藏异燕麦(Helictotrichontibeticum)、垂穗披碱草(Elymusnutans),次优势种有异针茅(Stipaaliena)、羊茅(FestucaovinaL.)、紫羊茅(Festucarubra)、线叶嵩草(Kobresiacapillifolia),伴生种有柔软紫菀(Asterflaccidus)、棘豆(Oxytropisochrocephala)、瑞苓草(Saussureanigrescens)、珠芽蓼(PolygonumviviparumL.)、矮火绒草(Leontopodiumnanum)、尖叶龙胆(Gentianaaristata)、糙毛野青茅(Deyeuxiaarundinacea)、花苜蓿(Trigonellaruthenica)、圆萼摩苓草(Morinachinensis)等。群落的总盖度约为90%,草本高度平均约为8—16 cm。
1.2 研究材料和方法
1.2.1 金露梅灌丛草甸生态系统及土壤CO2排放量测定
CO2通量气体测定采用静态密闭箱-气相色谱法进行。采集箱由304K薄不锈钢板制作,考虑到金露梅灌丛较高,箱体设计为顶箱、中段箱,体积均为50 cm×50 cm×50 cm。底座(50 cm×50 cm×10 cm),上端有密闭水槽。
因金露梅灌丛草甸系草本和木本嵌套分布,故观测按草本、灌丛木本和裸露地表(人为除去地表植物)3个处理区进行,分别代表系统的草本区、灌丛区和土壤呼吸(当然也包括了一定的植物根系呼吸),每个处理区3个重复。静态箱式法CO2通量观测于2009年5月到2010年6月期间进行。按有关研究者提出在9: 00—11: 00的采样可代表日平均值方案[11],观测频次视天气状况每月进行 4—6次,考虑到海北站区地方时与北京时相差1 h18 min,实验观测取在采样时间为10:00—11:00,气体样品采集频率1次/10min,共4次。此外,在寒冬季节(1月)、植物生长初期(5月)、中期(7月)和末期(9—10月),分别进行了每3 h的1次日变化观测。取样后及时带回实验室采用HP4890D气相色谱仪进行分析。通量计算则采用下式计算:
式中,F是被测气体排放通量;V是箱体体积;A是箱体底面积;Ct是时间t时刻箱内被测气体的体积混合比浓度;ρ是标准状态下的被测气体密度;T0和P0分别为标准状况下的空气绝对温度和气压;P为采样地点的气压;T为采样时的绝对温度。
1.2.2 金露梅灌丛草甸植被净初级生产碳量的测定与计算
高寒金露梅灌丛草甸为草本和灌丛景观嵌套分布。草本植被生物量采用收获法,即5月15日到枯黄初期的10月15日期间的每月15日前后调查草本地上、地下生物量。随机选择6个50 cm×50 cm的丛间草地样方,收集枯落物和植物绿色部分;地下生物量在上述样方内再随机选择25 cm×25 cm的二级样方3个,按0—10 cm、10—20 cm和20—40 cm 3个层次用铁铲和切刀分层取出,用100目的筛子将根系样品冲洗干净。然后置恒温65 ℃的烘箱,烘干至恒重后称重,并换算为碳含量(gC/m2)。
对金露梅灌木生物量采用收获法与样线法相结合进行估算。首先,于2002年5月在金露梅灌丛草甸中央部随机选择一点,分别依正北方向(0°)、120°方向、240°方向延伸80 m后,在左侧选择10 m×10 m的样方,共3个样方,并对3个样方内所有(包括刚生长的单株)金露梅灌木进行标记(共计1162丛)。再在植物生长期的6—9月每月15日前后的3 d内,测定样方内所有标记的金露梅灌木冠面自然状况下的最大长度、最小宽度和植株最大高度。每月得到1162组数据,作为调查金露梅灌丛生物量的基本参数。
每月15日上述参数测定的同时,在3个样方外围挖掘最小(单株)到最大的金露梅灌木丛18丛。挖掘前测定对应的金露梅冠面最大长度(A)、最小宽度(B)和植株最大高度(H)。挖掘后用剪刀分离出金露梅当年新生长的枝叶、地上部分和地下部分,分别装入纸袋,并将地下部分用水冲洗,最后所有样品置在恒温65 ℃的烘箱连续烘干至恒重后称重。
然后,以地上多年累积枝杆生物量、地下生物量、地上新生生物量为因变量,分别建立与冠面最大长度、最小宽度和植株最大高度的回归方程:
Wij=ealn(A·B·H)+b
式中,a、b为回归系数;Wij(i=1,2,3)分别为金露梅灌丛地上多年累积枝杆生物量、地下生物量、地上新生生物量,j为月份。再利用300 m2每月所调查的1162丛灌丛数的基本参数,计算单位面积平均灌木生物量(g/m2)。并根据灌木各部位碳含量转换成碳量(gC/m2)。
由于金露梅灌丛草甸生物量是由灌木和草本植物构成。在10 m×10 m的3个样方内,测量、计算灌丛和草本面积的比例,进而估测灌丛草甸的植被总生物碳量。其中灌木地上部和地下部平均碳含量分别为0.50和0.48(实测值),丛间草本植被含碳量地上和地下分别取0.45和0.40[12]。
1.2.3 金露梅灌丛草甸CO2净生态系统交换量(碳汇能力)计算
本研究假设未发生根系分泌补给土壤碳,另外根系呼吸监测难度大,文中将根系呼吸归入到土壤呼吸。因此采用植被净初级生产碳量与土壤呼吸的差值来估算净生态系统生产力(NEP)[13]。利用2009年5月到2010年12月期间监测的土壤呼吸、植被呼吸数据,建立与微气象连续观测资料的TEM指数相关模型[14]:
Reco=Reco,feln(Q10)(T-Tf)/10
式中,Reco是系统呼吸速率,Reco,f是系统在Tf参考温度下的呼吸速率(本研究取Tf为10 ℃),Q10是系统呼吸敏感度(温度每增加10 ℃,呼吸速率增加的倍数),T为土壤温度。并根据灌木和草本的比例,获取生态系统年际呼吸特征,计算金露梅灌丛年际NEP。同时,对比涡度相关系统观测的相应净生态系统CO2交换量(NEE),以评估本研究方法的可信度。
2 结果与分析
2.1 金露梅灌丛草甸生态系统呼吸、土壤呼吸和植被呼吸
本研究共取得了66次生态系统呼吸的有效数据。分析发现,生态系统CO2日排放量与5 cm地温(Td)具有极显著的指数关系(图1)。由模拟方程可知,Td能够解释丛间草地区和灌木区系统呼吸变异的94%和95%,而对裸露地表的土壤呼吸可解释83%。根据TEM模型[14],各区系统呼吸熵Q10分别为4.40、4.13和3.16,表明灌丛草本区和木本区系统呼吸强度的温度敏感性较高。其中灌木区系统呼吸强度最大,丛间草本区仅次之,裸露地表区最小。这主要由于:1)灌丛区郁闭度较高,能有效降低土壤蒸发,改善土壤湿度和结构,利于微生物的活动和CO2扩散[15]; 2)灌丛区、草本区和裸露区的地下生物量和系统光合通化速率依次降低,而根系活动强度和光合能力的高低影响了微生物活动的底物供应[16];3)灌丛植被具有较高的持雪能力(Snow-holding capacity),为微生物和根系活动提供了充足的水分和营养物质[3,17]。
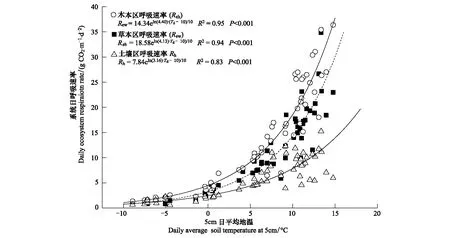
图1 高寒金露梅灌丛草甸草本区(Reh)、木本区(Rew)和裸露土壤(Rh)系统日呼吸速率与5cm平均地温关系Fig.1 The relationship between average soil temperature at 5cm and diurnal CO2 emissions in grass plots (Reh), shrub plots (Rew) and exposed soil plots (Rh)
依连续观测的地温资料及模拟方程,计算得到生态系统CO2呼吸日总量的年际变化(图2)。灌木区系统呼吸的变化范围在1.49—48.27 g CO2m-2d-1之间,草本区系统呼吸的变化范围在1.04—39.14 g CO2m-2d-1之间,土壤呼吸的变化范围在1.01—16.99 g CO2m-2d-1之间。3个处理区系统呼吸都表现出明显的季节变化规律。从5月中旬开始,随着土壤温度的升高,系统CO2日排放量也迅速增大,7到8月达最高;冷季一般低于5 g CO2m-2d-1且变化平缓,在11月下旬到次年3月上旬低于2 g CO2m-2d-1。
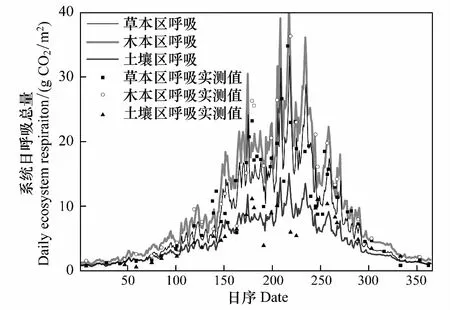
图2 高寒金露梅灌丛草甸草本区、木本区生态系统和裸露地表下总土壤CO2日排放量的年特征Fig.2 Annual variation of CO2 emissions every day in in grass plots, shrub plots and exposed soil plots
测量表明,10 m×10 m的3个样方内草本和灌丛分别占地表面积的78%和22%。因此高寒金露梅灌丛草甸生态系统植被总的净初级生产碳量和生态系统呼吸量按78%的草本和22%的灌丛之和来估算。表明2010年高寒金露梅灌丛草甸生态系统呼吸、土壤呼吸和植物呼吸年总量分别为886.28 、444.93 gC m-2a-1和441.36 gC m-2a-1(表1)。并根据2003—2010年5 cm日平均地温资料利用相关指数回归模型计算出8a生态系统呼吸、土壤呼吸、植物呼吸的年总量,8a平均分别为874.43 、441.36 gC m-2a-1和433.07 gC m-2a-1(表1)。虽然年景不同,生态系统、土壤呼吸、植物呼吸有所不同,但波动幅度较小(约为10%),生态系统、土壤呼吸、植物呼吸其年间波动幅度分别为76.89 、34.33 gC m-2a-1和47.73 gC m-2a-1。植被呼吸、土壤呼吸占生态系统呼吸比例表明,分别为49.5%和50.5%(表1)。
2.2 金露梅灌丛草甸植被地上、地下生物碳量及净初级生产碳量
同样,高寒金露梅灌丛草甸生态系统净初级生产碳量按照22%的灌木和78%的草本净初级生产碳量加权而得。其结果见表1。2003—2010年,海北金露梅灌丛草甸植被净初级生产碳量在345.02 gC m-2a-1(2005年)到633.96 gC m-2a-1(2009年)之间,平均为468.55gC m-2a-1。地上部分净初级生产碳量为117.10gC m-2a-1,地下部分净初级生产碳量为455.88 gC m-2a-1,地下部分是地上部分的3.89倍。而金露梅灌丛草甸其灌丛木本部分净初级生产碳量仅只是草本净初级生产碳量的13%,是总的净初级初级生产碳量的10%。表明高寒灌丛草甸生态系统,植被对大气CO2的吸收主要归功于草本植物的吸收,而灌木木本部分对碳吸收作用微弱。因此草本植物在灌丛生态系统碳吸收过程中起重要作用。
2.3 金露梅灌丛草甸生态系统碳汇能力
统计分析表明,2003—2010年年均净生态系统生产力(碳汇能力)为27.19 gC m-2a-1(表1),各年间差异稍大,在-108.72—175.06 gC m-2a-1之间波动,2009年碳汇能力最强,而2005表现为强的碳源。这个值比同试验地涡度相关法观测系统观测的8年平均值(58.57 gC m-2a-1)低31.38 gC m-2a-1。偏低的原因主要是裸露地表处理仅将植物地上部分去除,而将植物根系的呼吸也纳入到土壤呼吸之中,致使系统土壤呼吸偏大而低估了净生态系统生产碳量。因此高寒金露梅灌丛草甸生态系统为一弱碳汇功能区或源汇平衡区。

表1 海北金露梅灌丛草甸2003—2010年Re、Ra、Rh、NPP、NEP分布状况及Ra、Rh分配比例
Re 生态系统呼吸(gC m-2a-1);Ra 植被呼吸(gC m-2a-1);Rh土壤呼吸(gC m-2a-1);NPP 植被地上地下总的净初级生产碳量(gC m-2a-1);NEP 为忽略根分泌及根系呼吸后的碳汇能力(gC m-2a-1)
利用净初级生产量和土壤呼吸计算得到的碳汇值与涡度相关法观测的NEE是有差别的,这种差别包含了多种因素。如生物量测定误差,土壤呼吸仅是在10:00—11:00间测定而替代日平均,同时受条件限制没有进行动态的连续观测,仅只是选择了一年中66次得测定值,而且在土壤呼吸过程中有根系呼吸的作用,测定值又用地温来模拟其年变化乃至年的总呼吸量的计算。当然,涡度相关法观测的NEE也有其本身的缺陷。但从二者比较的最终结果来看,在年际变化的长时间尺度上仍能说明植被的碳汇源强度。表明利用该方法估算金露梅灌丛草甸生态系统碳汇能力是可行的。
3 讨论
草地灌丛化随气候变暖在高寒地区日益增加[18]。本研究发现高寒金露梅灌丛草甸生态系统的碳汇功能主要归功于草本植物(表1),这主要由于一方面虽然灌丛冠面面积较大(可达40%—50%),而基部占地表面积较低(约为草本的1/4),另一方面草本植物净初级生产力较高(约同面积灌木的3倍以上)。同时,灌木枝条丰富且高度较高,具有较大的生态系统呼吸存在较高的碳释放能力(图2),表明草地灌丛化可能会降低系统的碳汇能力;但由于草本植物的碳储时效性远低于木本[19],灌木能增加系统碳储的时效性,其对区域碳收支的作用仍还需进一步深入研究。另外,由于草本区呼吸熵Q10(4.13)仅比灌木区呼吸熵(4.40)低0.27,加之高寒金露梅灌丛草甸植被中草本群落在地表面占据较大的面积比例,表明气候暖化的背景下,生态系统的草本呼吸强度贡献明显增强,更为灌丛化引起的区域碳平衡增加了复杂度。
草地碳储巨大,但其碳汇能力时间和空间异质性较强[20- 22]。涡度相关法被认为是最直接、最有效的监测生态系统CO2交换的技术[23]。但由于涡度相关仪器昂贵,加之生态系统复杂的景观格局,亟需可替代的方法。本研究通过测定生态系统净初级生产力和土壤呼吸的方法,估测高寒金露梅灌丛草甸在2003和2004年表现为碳汇,分别吸收16.12gC m-2a-1和31.54gC m-2a-1(表1),略低于Zhao等[24]利用涡度相关法所得的58.5gC m-2a-1(2003年)和75.5gC m-2a-1(2004年)。这主要由于以下2方面的原因:1)生态系统的呼吸十分复杂[16],当温度到一定程度后,土壤湿度、C/N、生物因子将成为主控因素[11,23]。而本文仅仅采用温度来模拟生态系统呼吸,极有可能高估生态系统的呼吸速率,进而低估了系统的碳汇功能;2)涡度相关系统虽然是测定同质、均匀下界面CO2交换的精确方法,但当夜间大气层结稳定时易低估生态系统呼吸,尽管可通过摩擦速度这一方法降低误差但却无法消除[21- 22]。但两种方法的差值较为恒定(约43gC m-2a-1),说明本研究的方法具有一定的可信度。
同时,以8年高寒金露梅灌丛草甸生态系统碳汇能力为因变量,构建其与年均气温(Ta)和年降水量(R)的函数。一般线性模型统计表明,Ta(p= 0.36)、R(p= 0.79)和Ta×R(p= 0.26)与系统碳汇能力无显著关系。表明该系统碳汇能力年际波动受控因子较为复杂,有别于温度控制高寒金露梅灌丛草甸生态系统CO2通量季节波动的研究结果[8]。而高寒生态系统的碳汇能力受光合吸收的影响更强[25],也暗示高寒生态系统碳汇能力更多的受控于生物群落和生理特性。
不同生态系统的呼吸因受碳底物有效性、植被种类和土壤性质等众多因子的影响而表现出差异[14]。由于微生物和植被酶活性,生态系统呼吸与温度存在显著指数相关[26- 27]。对温度的敏感性Q10分析发现,灌丛生态系统呼吸,草本生态系统呼吸以及土壤呼吸的Q10分别为4.40、4.13和3.16,和中高纬度地区的研究结果相似[28],这是因为温度较低和海拔较高的缘故[16],同时也导致了土壤呼吸占生态系统呼吸的比例略低于内蒙古羊草草原的[29]。
4 结论
高寒金露梅灌丛草甸生态系统的灌木区、草本区和裸露土壤区呼吸强度与Td具有极显著的指数关系。其中,灌木区CO2日排放量最大,草本区次之,裸露地表区最小。结合地温连续观测资料,估算其年总量分别为886.28 、444.93 gC m-2a-1和441.36 gC m-2a-1。金露梅灌丛区和草本区的系统呼吸熵Q10分别为4.40、4.13,显著高于裸露地表区的3.16,表明前两者的系统呼吸的温度敏感性较强。2003—2010年8a高寒金露梅灌丛草甸的平均植被净初级生产力为468.55 gC m-2a-1,生态系统土壤呼吸量为441.36 gC m-2a-1,生态系统净生产力为27.19 gC m-2a-1,但年际变异较大。表明高寒金露梅灌丛草甸生态系统为弱碳汇区或者源汇平衡区,和国际广泛认可的涡度相关观测结果波动较为一致,表明利用该方法评估的系统净初级生产力具有一定的可信度。
[1] Tao B, Ge Q S, Li K R, Shao X M. Progress in the studies on carbon cycle in terrestrial ecosystem. Geographical Research, 2001, 20(5): 564- 575.
[2] Cannone N, Sgorbati S, Guglielmin M. Unexpected impacts of climate change on alpine vegetation. Frontiers in Ecology and the Environment, 2007, 5(7): 360- 364.
[3] Sturm M, Schimel J, Michaelson G, Welker J M, Oberbauer S F, Liston G E, Fahnestock J, Romanovsky V E. Winter biological processes could help convert Arctic tundra to shrubland. Bioscience, 2005, 55(1): 17- 26.
[4] Knapp A K, Briggs J M, Collins S L, Archer S R, Bret-Harte M S, Ewers B E, Peters D P, Young D R, Shaver G R, Pendall E, Cleary M B. Shrub encroachment in North American grasslands: shifts in growth form dominance rapidly alters control of ecosystem carbon inputs. Global Change Biology, 2007, 14(3): 615- 623.
[5] Zhou H K, Zhou L, Zhao X Q, Shen Z X, Li Y N, Zhou X M, Yan Z L, Wei L. Study of formation pattern of below-ground biomass inPotentillafruticosashrub. Acta Prataculturae Sinica, 2002, 11(2): 59- 65.
[6] Wang Q J, Zhou X M, Zhang Y Q, Zhao X Q. Structure characteristics and biomass ofPotentillaFruticosashrub in Qinghai-Xizang Plateau. Acta Botanica Boreali-Occidentalia Sinica, 1991, 11(4): 333- 340.
[7] Li Y Q, Zhao H, Zhao X, Zhang T, Chen Y. Soil respiration, carbon balance and carbon storage of sandy grassland under post-grazing natural restoration. Acta Prataculturae Sinica, 2006, 15(5): 25- 31.
[8] Li Y N, Sun X M, Zhao X Q, Zhao L, Xu S X, Gu S, Zhang F W, Yu G R. Seasonal variations and mechanism for environmental control of NEE of CO2concerning thePotentillafruticosain alpine shrub meadow of Qinghai-Tibet Plateau. Science in China (Series D: Earth Sciences), 2006, 36(SII): 163- 173.
[9] Li Y N, Zhao X Q, Cao G M, Zhao L, Wang Q X. Analyses on climates and vegetation productivity background at Haibei alpine meadow ecosystem research station. Plateau Meteorology, 2004, 23(4): 558- 567.
[10] Le Y Z, Zuo K C, Zhang J X, Zhao B L, Wang Z M, Guo J H. Soil type and basic characteristics at Haibei research station of Alpine Meadow Ecosystem // Xia W P, ed. Alpine Meadow Ecosystem. Lanzhou: Gansu People′s Press, 1982: 19- 32.
[11] Dugas W A, Heuer M L, Mayeux H S. Carbon dioxide fluxes over bermudagrass, native prairie, and sorghum. Agricultural and Forest Meteorology, 1999, 93(2): 121- 139.
[12] Zhang J X, Cao G M, Zhou D W, Hu Q W, Zhao X Q. The carbon storage and carbon cycle among the atmosphere, soil, vegetation and animal in theKobresiahumilisalpine meadow ecosystem. Acta Ecologica Sinica, 2003, 23(4): 627- 634.
[13] Fang J Y, Ke J H, Tang Z Y, Chen A P. Implications and estimation of four terrestrial productivity parameters. Acta Phytoecologica Sinica, 2001, 25(4): 414- 419.
[14] Raich J W, Tufekciogul A. Vegetation and soil respiration: correlations and controls. Biogeochemistry, 2000, 48(1): 71- 90.
[15] Li D, Cao G M, Hu Q W, Wu Q, Li Y M, Wang Y H. A primary study on CO2emission from alpinePotentillafruticosascrub meadow ecosystem. Acta Agrestia Sinica, 2005, 13(2): 144- 148.
[16] Lloyd J, Taylor J A. On the temperature dependence of soil respiration. Functional Ecology, 1994, 8(3): 315- 323.
[17] Strack J E, Pielke Sr R A, Liston G E. Arctic tundra shrub invasion and soot deposition: Consequences for spring snowmelt and near-surface air temperatures. Journal of Geophysical Research, 2007, 112: G04S44 doi:10.1029/2006JG000297.
[18] Chapin F S III, Shaver G R, Giblin A E, Nadelhoffer K J, Laundre J A. Responses of arctic tundra to experimental and observed changes in climate. Ecology, 1995, 76(3): 694- 711.
[19] Chen P Q, Wang X K, Wang L M. Carbon Budget and Its Sink Promotion of Terrestrial Ecosystem in China. Beijing: Science Press, 2008.
[20] Diemer M, Körner C. Transient enhancement of carbon uptake in an alpine grassland ecosystem under elevated CO2. Arctic and Alpine Research, 1998, 30(4): 381- 387.
[21] Oberbauer S F, Gillespie C T, Cheng W, Sala A, Gebauer R, Tenhunen J D. Diurnal and seasonal patterns of ecosystem CO2efflux from upland tundra in the foothills of the Brooks Range, Alaska, USA. Arctic and Alpine Research, 1996, 28(3): 328- 338.
[22] Ren J Z, Liang T G, Lin H L, Feng Q S, Huang X D, Hou F H, Zou D F, Wang C. Study on grassland′s responses to global climate change and its carbon sequestration potentials. Acta Prataculturae Sinica, 2011, 20(2): 1- 22.
[23] Baldocchi D D. Assessing the eddy covariance technique for evaluating carbon dioxide exchange rates of ecosystems: past, present and future. Global Change Biology, 2003, 9(4): 479- 492.
[24] Zhao L, Li Y N, Xu S X, Zhou H K, Gu S, Yu G, Zhao X Q. Diurnal, seasonal and annual variation in net ecosystem CO2exchange of an alpine shrubland on Qinghai-Tibetan plateau. Global Change Biology, 2006, 12(10): 1940- 1953.
[25] McFadden J P, Eugster W, Chapin F S. A regional study of the controls on water vapor and CO2exchange in arctic tundra. Ecology, 2003, 84(10): 2762- 2776.
[26] Davidson E A, Richardson A D, Savage K E, Hollinger D Y. A distinct seasonal pattern of the ratio of soil respiration to total ecosystem respiration in a spruce-dominated forest. Global Change Biology, 2006, 12(2): 230- 239.
[27] Zhang L H, Song C C, Wang D X, Wang Y Y. Relationship of ecosystem respiration with temperature, nitrogen and plant in freshwater marshes. Environmental Science, 2007, 28(1): 1- 8.
[28] Boone R D, Nadelhoffer K J, Canary J D, Kaye J P. Roots exert a strong influence on the temperature sensitivity of soil respiration. Nature, 1998, 396(6711): 570- 572.
[29] Geng Y B, Luo G Q. Analysis of affecting factors and partitioning of respiration in aLeymuschinensissteppe in Inner Mongolia. Acta Geographica Sinica, 2010, 65(9): 1058- 1068.
参考文献:
[1] 陶波, 葛全胜, 李克让, 邵雪梅. 陆地生态系统碳循环研究进展. 地理研究, 2001, 20(5): 567- 575.
[5] 周华坤, 周立, 赵新全, 沈振西, 李英年, 周兴民, 严作良, 刘伟. 金露梅灌丛地下生物量形成规律的研究. 草业学报, 2002, 11(2): 59- 65.
[6] 王启基, 周兴民, 张堰青, 赵新全. 青藏高原金露梅灌丛的结构特征及其生物量. 西北植物学报, 1991, 11(4): 333- 340.
[7] 李玉强, 赵哈林, 赵学勇, 张铜会, 陈银萍. 不同强度放牧后自然恢复的沙质草地土壤呼吸、碳平衡与碳储量. 草业学报, 2006, 15(5): 25- 31.
[8] 李英年, 孙晓敏, 赵新全, 赵亮, 徐世晓, 古松, 张法伟, 于贵瑞. 青藏高原金露梅灌丛草甸净生态系统CO2交换量的季节变异及其环境控制机制. 中国科学 D辑: 地球科学, 2006, 36(增刊): 163- 173.
[9] 李英年, 赵新全, 曹广民, 赵亮, 王勤学. 海北高寒草甸生态系统定位站气候、植被生产力背景的分析. 高原气象, 2004, 23(4): 558- 567.
[10] 乐炎舟, 左克成, 张金霞, 赵宝莲, 王在模, 郭建华. 海北高寒草甸生态系统定位站的土壤类型及其基本特点 // 夏武平. 高寒草甸生态系统. 兰州: 甘肃人民出版社, 1982: 19- 33.
[12] 张金霞, 曹广民, 周党卫, 胡启武, 赵新全. 高寒矮嵩草草甸大气-土壤-植被-动物系统碳素储量及碳素循环. 生态学报, 2003, 23(4): 627- 634.
[13] 方精云, 柯金虎, 唐志尧, 陈安平. 生物生产力的“4P”概念、估算及其相互关系. 植物生态学报, 2001, 25(4): 414- 419.
[15] 李东, 曹广民, 胡启武, 吴琴, 李月梅, 王迎红. 高寒灌丛草甸生态系统CO2释放的初步研究. 草地学报, 2005, 13(2): 144- 148.
[19] 陈泮勤, 王效科, 王礼茂. 中国陆地生态系统碳收支与增汇对策. 北京: 科学出版社, 2008.
[22] 任继周, 梁天刚, 林慧龙, 冯琦胜, 黄晓东, 侯扶江, 邹德富, 王翀. 草地对全球气候变化的响应及其碳汇潜势研究. 草业学报, 2011, 20(2): 1- 22.
[27] 张丽华, 宋长春, 王德宣, 王毅勇. 沼泽湿地生态系统呼吸与温度、氮素及植物生长的相互关系. 环境科学, 2007, 28(1): 1- 8.
[29] 耿元波, 罗光强. 内蒙古羊草草原呼吸的影响因素分析和区分. 地理学报, 2010, 65(9): 1058- 1068.
Carbon budget of alpinePotentillafruticosashrubland based on comprehensive techniques of static chamber and biomass harvesting
LI Hongqin1,2, LI Yingnian1,2,*, ZHANG Fawei1,2, LIU Xiaoqin1,3, WU Qihua1,3, MAO Shaojuan1,3
1NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences,Xining810001,China2KeyLaboratoryofAdaptationandEvolutionofPlateauBiota,ChineseAcademyofSciences,Xining810001,China3UniversityofChineseAcademyofSciences,Beijing100049,China
Alpine shrubland is one of the most important dominant vegetation types on the Qinghai-Tibetan Plateau, and because of its biological uniqueness, accurately estimating its ecosystem carbon function is very difficult. This is particularly true in the case of shrub encroachment induced by ongoing climate warming. Shrubs sequester much more carbon (C), and their woody branches have a higher carbon to nitrogen (C/N) ratio than do grasses. In addition, soil organic matter and litter are predicted to decompose more rapidly under future warmer scenarios. Consequently, predicting changes in the ecosystem carbon budget caused by more shrubland in the future is crucial but difficult.
In this study, the referee CO2fluxes were estimated by eddy covariance method from 2003—2010 in the alpinePotentillafruticosashrubland of Haibei Tibetan Autonomous Prefecture, China. The respiration rates of the soil and ecosystem were observed using a static chamber, and biomass was estimated by harvesting plants four to six times per month from May 2009 through June 2010. Finally, the net ecosystem primary production was evaluated to assess whether the ecosystem was a sink or a source of carbon.
Because shrubs were mixed with grasses in the study area, our experimental design included three treatments, each with three replicates, in the shrubland; the treatments were shrub plots, grass plots, and exposed field plots. In each plot, soil temperature was measured daily in each year of the study, while respiration rate was measured at intervals. The correlation between soil temperature and respiration rate on the days when both were measured was used to estimate the daily respiration rate. The results showed that daily respiration rate in the shrub, grass, and exposed field plots was 1.49—48.27, 1.04—39.14, and 1.01—16.99 g CO2m-2d-1, respectively. The soil, vegetation and ecosystem respiration rates fluctuated distinctly among seasons, and all three reached their maxima in August. The annual carbon accumulations were 444.93, 441.36, and 886.28 g C/m2, respectively. The respiration rates of the shrub, grass, and exposed field plots correlated exponentially and significantly with the soil temperature at a depth of 5 cm (R2=0.95, 0.94, and 0.83, respectively). Respiration entropy,Q10(the magnitude of the respiration rate change with a 10 °C change in temperature), of the treatments was 4.40, 4.13, and 3.16, respectively. The respiration rate in the shrub and grass plots was relatively sensitive to temperature, implying that plant respiration might contribute to ecosystem respiration much more in warming scenarios. The average 8-year net plant primary production was 468.55 g C/m2from 2003 to 2010, ranging from 345.02 g C/m2in 2005 to 633.96 g C/m2in 2009. The below-ground net plant primary production was 3.89 times that of the above-ground net plant primary production. Subtracting soil heterotrophic respiration, the alpine shrubland ecosystem acted as weak carbon sink and on average absorbed 27.19 g C/m2per year from the atmosphere. However, carbon function varied over time, from releasing -108.72 g C/m2in 2005 to assimilating 175.06 g C/m2in 2009. The magnitude and direction of carbon function was consistent with the results of an authentic eddy covariance technique in this alpine shrubland ecosystem, although our value of 27.19 g C/m2was slightly lower than in the previous study. Our results indicated that this comprehensive method integrating data from static chambers and plant harvests provided a credible estimate of the ecosystem carbon budget.
Potentillafruticosashrubland; ecosystem respiration; soil heterotrophic respiration; net primary production; carbon sequestration capacity
国家自然科学基金资助项目(31070437, 31270523);中国科学院战略性先导科技专项资助项目(XDA05050601, XDA05050404);国家重点基础研究发展计划(973)资助项目(2010CB833501- 01- 13)
2012- 10- 10;
2013- 03- 14
10.5846/stxb201210101401
*通讯作者Corresponding author.E-mail: ynli@nwipb.cas.cn
李红琴,李英年,张法伟,刘晓琴,吴启华,毛绍娟.基于静态箱式法和生物量评估海北金露梅灌丛草甸碳收支.生态学报,2014,34(4):925- 932.
Li H Q, Li Y N, Zhang F W, Liu X Q, Wu Q H, Mao S J.Carbon budget of alpinePotentillafruticosashrubland based on comprehensive techniques of static chamber and biomass harvesting .Acta Ecologica Sinica,2014,34(4):925- 932.
