不同分枝数对桑树幼苗生长发育的影响
2014-08-08郇慧慧贺俊东杨延霞黄科朝
郇慧慧,胥 晓,2,*,刘 刚,贺俊东,杨延霞,黄科朝
(1. 西华师范大学生命科学学院, 南充 637009;2. 西华师范大学西南野生动植物资源保护教育部重点实验室,南充 637009;3. 四川省农业科学院蚕业研究所, 南充 637000)
不同分枝数对桑树幼苗生长发育的影响
郇慧慧1,胥 晓1,2,*,刘 刚3,贺俊东1,杨延霞1,黄科朝1
(1. 西华师范大学生命科学学院, 南充 637009;2. 西华师范大学西南野生动植物资源保护教育部重点实验室,南充 637009;3. 四川省农业科学院蚕业研究所, 南充 637000)
以我国常见经济林木桑树(Morusalba)为试验材料,从气体交换、形态变化和地上生物量方面研究5种分枝模式(1、2、3、4和5枝)对幼苗生长发育的影响。结果显示:(1)分枝数为1的植株的净光合速率(Pn)最高,达到8.6 μmol·m-2·s-1。随着分枝数增加,Pn显著下降,直至分枝数达到3枝及其以上时,净光合速率保持相对稳定,为4.3 μmol·m-2·s-1。而气孔导度(gs)、胞间CO2浓度(Ci)和蒸腾速率(E)则不受分枝数的影响。(2)随着分枝数增加,总叶片数量、总叶面积和总枝长都显著增加,最终分别达到114.3,10481.1 cm2和457.1 cm,而平均单枝叶片数、平均单枝基径、平均单叶面积和比叶面积则显著减少。(3)随着分枝数的增加,植株的总叶生物量和总枝生物量无显著变化,但平均每枝叶干重、平均每枝枝干重和平均每枝总生物量随分枝数的增加而逐渐减少。研究结果表明了分枝数增加可能导致叶片间对光资源的竞争强度增大,引起净光合速率下降,叶片面积变小,单枝长度和生物量减小。另一方面,植株则通过生长出更多的叶片数量,以及更大的总叶片面积来尽可能地消除竞争带来的不利影响,提高对光环境资源的利用。
桑树;分枝数;净光合速率;形态生长;生物量积累
作为植株的重要构成部分,枝条的数量、大小和分布格局等特征对植株的形态构成具有非常重要的作用[1],它直接决定着植株的外部形态、空间结构、叶片数量和面积、以及地上生物量的积累等。然而,从国内外查阅的文献来看,相关的研究工作开展得并不多,仅少数文献报道了枝条特征与植株形态和生物量之间的相关关系。如,Ceulemans等人对杨树的研究表明,不同的枝条特征和枝条分布格局将直接导致植株在外冠的性状和空间结构方面出现明显的差异[2]。同时,Suzuki对常绿树木柃木(Euryajaponica)的研究也表明,枝条的上下排列次序的差异是引起植株呈现不同空间结构的主要因素[3]。该结论与King对澳大利亚东北部以及中美洲雨林中58个不同物种幼苗的观测结果一致[4],均反映出了枝条的特征将决定植株的形态这一现象。
另一方面,一些研究还表明,植株的分枝特征与植株的生物量分配也具有紧密的内在联系。如Porté等人[5]在对海岸松(Pinuspinaster)的研究中发现枝条性状和树木生长之间存在显著的异速生长关系。Kellomäki[6]对樟子松(Pinussylvestris)进行深入研究后指出,樟子松的分枝数和枝条总生物量呈明显负相关关系,同时外冠较小的植株比外冠较大的植株具有更大的分枝密度和更少的生物量。Kim等人[7]调查了菊花(Dendranthemagrandiflorum)扦插苗的分枝数对植株品质和产量的影响后发现,当分枝数达到4时,植株的株高生长速率将显著降低。然而,Nakamura等人对茶树幼苗的研究却表明,植物的生长随着分枝数目的增多而有所提高[8]。根据Isebrands和Nelson等人的研究,分枝数对植株生长的影响与不同的基因类型、物种类别、以及植株生长的资源条件(光照、水分和土壤质地)密切相关[9- 11]。据此,若资源条件和基因型相同,则植株在生长过程中的形态和生物量积累将主要受到分枝数量的影响。随着分枝数增多,叶片数量可能增加,对光环境的利用率将提高,但分枝数的进一步增多将造成植株叶片间对光环境的竞争加剧,最终限制植株的生长和发育。因此,进一步推测,不同分枝模式下植株在生理、形态和生物量的变化可能是利用与竞争环境资源的最终平衡结果。
桑树(MorusalbaL.)属桑科(Moraceae)桑属(Morus),广泛分布于我国中部、北部和西南地区。它不仅是我国最重要的一种经济栽培树种,而且也是我国蚕桑业和纺织业蓬勃发展的主要基础原料。从已有文献来看,对桑树的研究主要集中在栽培技术、病虫防治、品质改良和资源开发等方面,尤其对栽培技术方面的研究开展较多[12- 14]。这些栽培技术均集中在通过改良桑树品质或土壤水肥条件来获取更多的叶片和地上生物量的积累,从而满足养蚕过程中对桑叶的需要。然而,针对不同分枝模式下桑树植株的光合能力、叶片发育、生物量变化的研究尚未见报道。
基于上述原因,以桑树为试验材料,研究具不同分枝数的植株在气体交换、形态生长和地上生物量积累方面的差异,以验证其的推测,也为桑树的最适栽培提供理论参考。
1 材料和方法
1.1 材料和试验设计
供试桑树幼苗来源于四川省农业科学院蚕业研究所桑树科研试验基地(位于四川省南充市),该地区属亚热带季风气候,年降水量为1 065 mm,相对湿度为76%—86%,年日照时数为1 980 h,年均气温16.8 ℃[15]。2012年3月上旬选择30株基径相同、长势基本一致,苗龄为1 a的幼苗,并从距根部20 cm处截断茎干后移栽到盛有匀质土壤、体积为30 L的塑料盆内,每盆土壤25 kg。
缓苗结束后,于3月下旬对每株植株留存茎干上刚萌生的侧枝芽进行摘除处理,使茎干上的侧枝芽数分别保留为1、2、3、4、5个,共5种模式,每种模式的重复数量为6株。处理完毕后,将30盆植株移至南充市西华师范大学生命科学学院试验基地的生长室中培育,以防止病虫害。生长室接近圆柱形,容积大约24.5 m3,地面面积9.35 m2,由玻璃和PC(聚碳酸酯)材料构成,透光率达90%,室内有计算机控制的自动冷却和换气系统,可保持室内外温湿度基本一致。生长期间,每盆植株施缓效肥31 g(39% N, 29% P, 29% K, 3% Zn)。为避免土壤水分条件引起的误差,采用称重法确定浇水量,每隔2 d浇水1次,以保持30%的土壤含水量。
1.2 测定指标与方法
1.2.1 气体交换
2012年7月12日,选取具有不同侧枝数量的植株各6株,参考胥晓等[16]的方法选取茎干上第1侧枝上部的第5或6片完全展开的向阳叶片,用于测定植株的气体交换特征。采用Li- 6400便携式光合仪(LI-COR公司,美国)于9:00—11:00 h测定其净光合速率(Pn)、气孔导度(gs)、胞间CO2浓度(Ci)和蒸腾速率(E)。测定时设置叶室温度为(26±2) ℃;根据柯裕州等[ 17]的研究设定光照强度为(1000±100) μmol·m-2·s-1;相对湿度为(60±5)%;CO2浓度(370 ± 10) μmol/mol。
1.2.2 形态特征
在植株生长期间,待侧枝萌发成形后,从5月7日至8月7日对植株每一侧枝的叶片数、枝长和基径进行测量,间隔时间为10 d。试验结束后,将各植株地上部分分别按叶和枝分离,并测量每株植株的总叶片数(TNL)、总枝条长度(TSL)、平均每枝叶片数(LN/B)、平均每枝枝长(SL/B)、平均每枝基径(BD/B)。同时,用LI- 3000C便携式叶面积仪测定(LI-COR公司,美国)对植株的总叶面积(TLA)、每枝总叶面积(,LA/B)和平均单叶面积(LA/L)进行测量。
1.2.3 地上生物量
试验结束后,将植株分别按枝条和叶进行采收。生物量样品置于70 ℃烘箱内48 h烘干至恒重后,分别测定枝条和叶的生物量,并计算各植株的总叶干重(TLM),总茎干重(TSM),总地上部分干重(TAM),平均每枝叶干重(LM/B),平均每枝茎干重(SM/B),平均每枝总干重(DM/B),比叶面积(SLA)(叶面积与叶干重之比),比枝长(SSL),叶/枝生物量之比(LM/SM)。
1.3 数据分析
采用SPSS13.0统计软件进行平均值间的单因素方差分析(One Way ANOVA),组间平均值的比较采用Duncan多重比较检验(Duncan′s multiple range test),显著性水平设定为α=0.05。
2 结果与分析
2.1 不同分枝模式下桑树植株的气体交换特征
由图1知,5种分枝模式下植株的Pn间存在显著差异。随着分枝数增加,净光合速率显著下降。当分枝数达到3枝及以上时,净光合速率保持相对稳定,不再降低。 此外,5种分枝模式下的gs,E和Ci无显著差异。
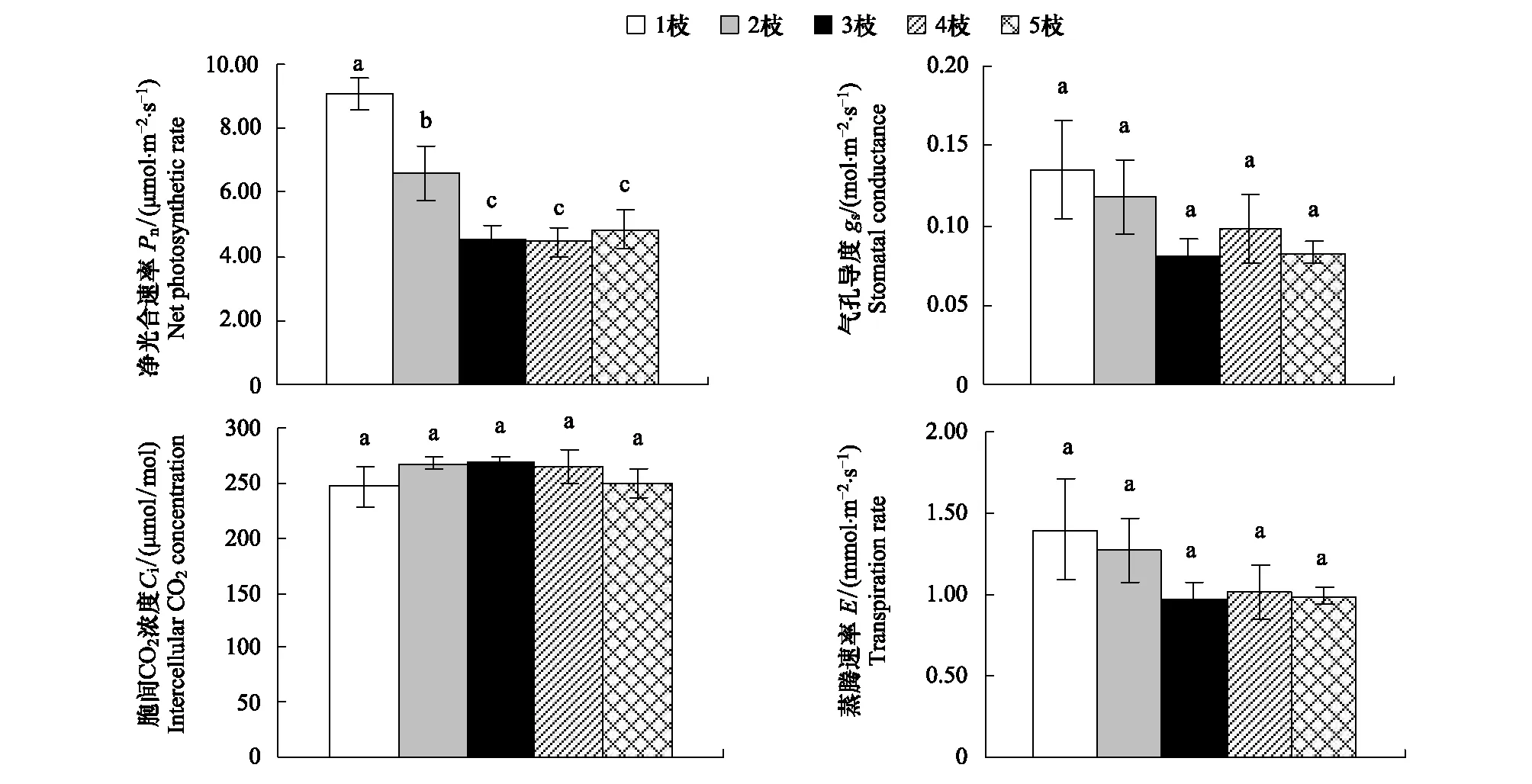
图1 分枝数对桑树净光合速率,胞间CO2浓度,蒸腾速率和气孔导度的影响Fig.1 Effect of branch number on the net photosynthesis rate (Pn), intercellular CO2 concentration (Ci), transpiration (E), and stomatal conductance (gs) in M. alba saplings
2.2 不同分枝模式下桑树植株的形态特征
由表1可知,随着分枝数增加,桑树的总叶片数量(TNL)、总叶面积(TLA)和总枝长度(TSL)都显著增加,而平均每枝叶片数(LN/B)、平均每枝叶面积(LA/B)、平均每枝枝长(SL/B)、平均每枝基径(BD/B)和每枝总叶面积(LA/B)均呈现随分枝数增加而降低的趋势。另外,植株比叶面积(SLA)随分枝数增加而显著减小,比枝长(SSL)随分枝数增加而显著增加,而叶/枝生物量之比(LM/SM)却没有显著变化(图2)。
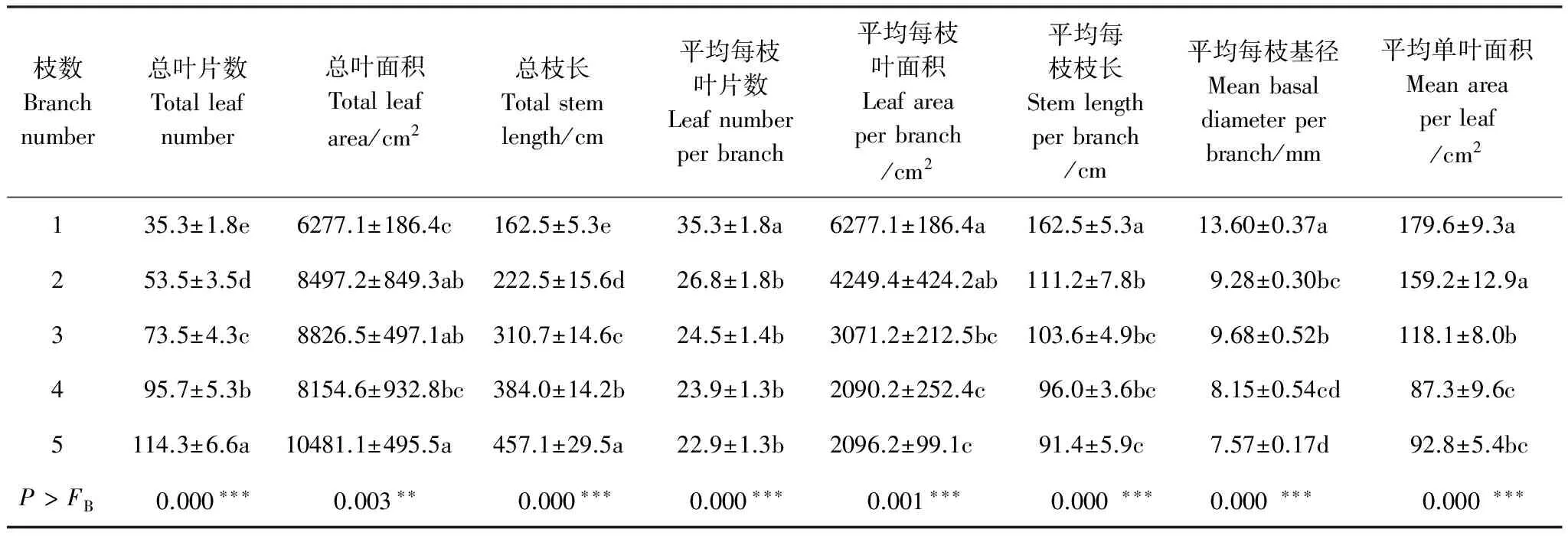
表1 不同分枝之间形态方面的差异
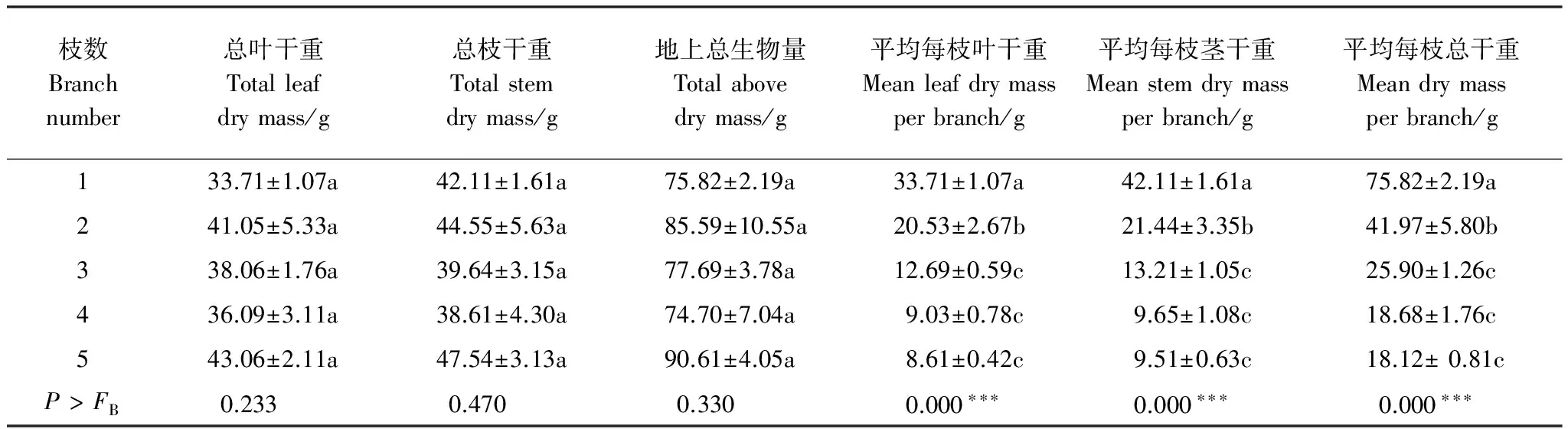
*: 0.01 定期对桑树平均每枝叶片数(LN/B)、平均每枝枝长(SL/B)以及平均每枝的基径(BD/B)的测量结果显示,在60 d的生长监测期内,5种分枝模式下,植株的上述3个指标均稳步增长,与时间呈线性相关。具单枝枝条植株的LN/B、SL/B和BD/B在各时间段均显著高于具多枝枝条的植株(图3)。 图2 分枝数对桑树比叶面积 (Specific leaf area, SLA)、叶/枝生物量比 (Leaf mass/stem mass, LM/SM)、比枝长 (Specific stem length, SSL)的影响Fig.2 The SLA、LM/SM and SSL in M. alba saplings with different branch numbers 图3 不同分枝模式下桑树的平均每枝叶片数、平均每枝枝长和平均每枝基径的生长趋势Fig.3 The tendency of growth in average leaf number per branch, average stem length of per branch and average basal diameter of per branch in M. alba saplings with different branch numbers 2.3 不同分枝模式下桑树植株的生物量 在5种分枝模式下,桑树幼苗在总叶干重(TLM)、总枝干重(TSM)和地上部分总干重(TAM)方面均无显著差异(表2)。然而,随枝条数增加,桑树幼苗的平均每枝叶干重(LM/B)、平均每枝枝干重(SM/B)和平均每枝总生物量(TM/B)都表现出明显降低的趋势。当分枝数达到3及以上时,上述指标保持相对稳定,不再降低(表2)。 表2 不同分枝之间生物量方面的差异 3.1 分枝数对净光合速率的影响 光合作用是植物生长过程中物质积累和能量代谢最基本的生理过程,光合能力的大小直接影响植物的生长和发育。分枝数对植株的净光合速率影响较大:随着分枝数增加,净光合速率显著下降。当分枝数进一步增多时,净光合速率保持相对稳定,不再降低(图1)。有研究表明,影响植物光合速率降低的因素主要分为两种:一是气孔关闭导致气孔受到限制;二是叶肉细胞活性降低导致非气孔限制。前者使胞间CO2浓度(Ci)值降低,而后者使Ci值升高。当两种因素同时存在时,Ci的变化取决于占优势的因素[18]。考虑到本研究中5种分枝模式下桑树幼苗的Ci值均无显著变化,因此,推测导致植株净光合作用下降的因素可能是气孔限制与非气孔限制共同作用的结果。 另一方面,光照环境也是影响植株光合作用的重要因素,长期处于荫蔽环境中的植物的光合能力往往低于生长于阳光充足环境中的植物。具有5枝枝条的植株叶片数量最多,植株总叶面积最大,但其净光合作用最低。与之相反,具1枝枝条的植株的叶片数量最少,总叶面积最小,但净光合速率最高。这与Scott和Aarssen[19]的研究结果“相对较低的叶片密度可以促进叶片更好地获取光能,合成更多的光合产物”基本一致。这一现象可能源于分枝数的不断增加导致了植株叶片对光环境空间竞争强度的不断增大,最终引起植株叶片对光能利用效率的降低。与此同时,分枝数增加所引起叶片数的增加,以及总叶面积的增大则有利于植株尽可能地补偿因光能竞争而带来的物质积累和能量代谢方面的损失,从而达到对环境资源最佳利用的平衡。所以,具有不同分枝数的桑树幼苗在生长过程中对有限光环境的利用可能具有不同的适应策略。 3.2 分枝数对植株形态的影响 根据Burk等[20]和Lebon 等[21]人的研究,枝条的发育也决定了枝条上所支持的叶片数量和面积,枝条数量增加可以为更多叶片的生长和发育提供支撑。Ward等[22]也指出分枝数与分芽数目和枝条长度之间存在某种特定关系。因此,分枝数决定着植株的外在形态特征。此外,左娟等人对领春木的研究发现植株在光限制的环境中,往往通过增加叶片数量来提高对光能的利用率[23]。结果表明,随分枝数增加,桑树总叶片数量、总叶面积和总枝长均显著增加,这与上述文献研究结果相一致。另一方面,本研究还发现随分枝数增加,平均每个分枝上的枝长、叶片数量、总叶片面积、基径和单叶面积等都呈现降低趋势。由于受试过程中植株所处的生长环境(光照环境和土壤环境)均通过控制措施保持了完全一致,而选取来源相同的实验材料也避免了植株大小引起的生长差异。故推测分枝数增加导致平均单枝在枝长、叶片以及基径等特征方面减小的原因可能归结为植株总叶片数量增加而导致枝条间对光环境的竞争强度加剧,致使叶片光合能力降低,最终导致物质积累受到限制。这一推论正好与“植株净光合速率随着分枝数增加而呈下降趋势”相吻合。 比叶面积和比枝长是另外两个衡量植物功能器官形态变化的常用指标,尤其是比叶面积能反映植物从外界环境中获取资源的能力,评价植物叶片功能。相关文献表明,资源受限的环境会导致植株比叶面积变小[24],但这种变化并不是孤立的, 而与其它叶片性状如叶片干物质量、叶片含氮量、净光合速率及叶片大小等共同体现植物的适应对策[25]。在本研究中,对桑树5种分枝模式的比较结果显示,随着枝数的增加,比叶面积值逐渐降低,而比枝长则呈现上升趋势。由此说明分枝数的增加将使桑树在形态方面朝着叶片变得更薄、枝条变得更细的方向发展。由于植株为了适应不同的环境条件,其在形态、生理和功能方面将作出相应的调整[26],从而最大可能地获得生长、发育和繁育所需的资源[27]。故认为“分枝数增加将使桑树叶片变得更薄,枝条变得更细”的现象是植株对较强光环境竞争长期形态适应的最终结果。 3.3 分枝数对植株生物量积累及其分配的影响 在植物生长的过程中,为了满足不同部位发育需要,同化物质的分配扮演了重要角色[28]。多数研究认为,胁迫环境下植株的生物量将向地下部分分配,而在适宜环境中植株的地上和地下生物量之比并不会发生显著变化[28]。本研究结果显示,各分枝模式下植株的总叶生物量、总枝生物量、地上生物量以及总叶干重与总茎干重之比并无显著差异。由此我们认为,植株对生物量的积累和分配并不受分枝数多少的影响,而主要取决于周围环境是否能提供充足的资源以保障生长发育的需要。在我们的实验中,由于尽可能地保证了各桑树幼苗所生长的土壤环境、水分条件、光照环境的一致性,故植株生物量分配并未受到影响,该推测与Bartelink对树木干物质分配模式的研究[28]结果相吻合。 此外,一些文献表明,植物在受到虫害、干旱、踩踏等自然或人为伤害时会产生一种适应性的生理现象,以此弥补伤害造成的损失,即植物在不利环境下存在着补偿机制[29- 31]。如被昆虫或者草食动物取食的植株可以通过对资源进行重新分配,以及对生长格局、光合能力、叶片形态以及植株空间结构等进行调整来促进补偿性生长,从而降低损失[32- 35]。Boege等对热带树木Casearianitida的研究表明,植株至少可以补偿25%的叶片损失[36]。王世绩等发现杨树在摘叶处理后可以促进光合作用速率、茎伸长速率和叶面积增长速率,从而对全年的苗高和地径生长量均有补偿作用[37]。本研究中,平均每枝叶生物量、平均每枝茎生物量和平均每枝总生物量随着分枝数减少而呈递增趋势,但其植株的总体生物量并未发生显著变化。鉴于分枝数的减少能直接导致叶片的损失,促进植株进行补偿性生长。因此,出现总体生物量不随分枝数发生变化的原因极可能还与植株固有的补偿性生长机制有关。 综上所述,分枝数对桑树植株光合、形态和单枝生物量的积累具有显著影响。分枝数增加所引起的植株总叶片数量的增多将导致植株内部叶片之间对光环境资源的竞争强度增大,叶片光合作用受到抑制,净光合速率下降,物质积累和能量代谢降低,叶片面积变小,单枝长度变短,单枝生物量减小。另一方面,为了最大可能地弥补因光能竞争而带来的物质积累和能量代谢方面的损失,植株又通过生长更多的叶片数量,以及更大的总叶片面积等补偿生长来达到对环境资源的最佳利用。因此,不同分枝模式下植株生理、形态和生物量的变化实际上是植株内部对环境资源的竞争与利用二者之间相互平衡的结果。 [1] Nelson N D, Burk T, Isebrands J G. Crown architecture of short-rotation, intensively culturedPopulus.: Ⅰ. Effects of clone and spacing on first-order branch characteristics. Canada Journal of Forest Research, 1981, 11(1): 73- 81. [2] Ceulemans B, Stettler R F, Hinckley T M, Isebrands J G, Heilman P E. Crown architecture ofPopulusclones as determined by branch orientation and branch characteristics. Tree Physiology, 1990, 7(1/4): 157- 167. [3] Suzuki A. Patterns of vegetative growth and reproduction in relation to branch orders: the plant as a spatially structured population. Trees, 2000, 14(6): 329- 333. [4] King D A. Relationship between crown architecture and branch orientation in rain forest trees. Annals of Botany, 1998, 82(1): 1- 7. [5] Porté A, Trichet P, Bert D, Loustau D. Allometric relationships for branch and tree woody biomass of Maritime pine (PinuspinasterAït.). Forest Ecology and Management, 2002, 158(1/3): 71- 83. [6] Kellomäki S. A model for the relationship between branch number and biomass inPinussylvestriscrowns and the effect of crown shape and stand density on branch and stem biomass. Scandinavian Journal of Forest Research, 1986, 1(1/4): 455- 472. [7] Kim J H, Kim T J, Lee C H, Paek K Y, Hahn E J, Kim H H. Effect of number of branches on quality and yield of secondary cut flower production ofDendranthemagrandiflorum‘Herman de Boon’. Korean Journal of Horticultural Science and Technology, 2003, 21(3): 212- 215. [8] Nakamura Y, Morita A. Effects of pruning of tea cuttings in paper pots on the number of branches and plant growth before and after transplanting. Japanese Journal of Crop Science, 2006, 75(3): 289- 295. [9] Isebrands J G, Nelson N D. Crown architecture of short-rotation, intensively culturedPopulusII. Branch morphology and distribution of leaves within the crown ofPopulus‘Tristis’ as related to biomass production. Canadian Journal of Forest Research, 1982, 12(4): 853- 864. [10] Kauppi A, Kiviniitty M, Ferm A. Growth habits and crown architecture ofBetulapubescensEhrh. of seed and sprout origin. Canadian Journal of Forest Research, 1988, 18(12): 1603- 1613. [11] Mizumachi E, Mori A, Osawa N, Akiyama R, Tokuchi N. Shoot development and extension ofQuercusserratasaplings in response to insect damage and nutrient conditions. Annals of Botany, 2006, 98(1): 219- 226. [12] Lin T B, Li Y G, Lü Z Q, Zhu Y. Advances in the research and development on the synthesize utilization of Mulberry resources. Bulletin of Sericulture, 2008, 39(3): 1- 4. [13] Ye W B. Status quo of Mulberry cultivation technique and its development strategy in China. Acta Sericologica Sinica, 1996, 22(4): 235- 240. [14] Tang C M, Luo G Q, Chen X T, Xiao G S, Wu F Q, Yang Q, Wu J A, Ren D Z. Breeding and cultivation technique of seedless Mulberry variety-Da10 with fruit-leaf dual purpose. Journal of Soochow University: Engineering Science Edition, 2005, 25(2): 35- 38. [15] Luo P, Zhou S L. Effect of land use on ecological benefit of farm belt in suburbs: A case study was conducted of Gaoping district, Nanchong City, Sichuan Province. Journal of Ecology and Rural Environment, 2007, 23(4): 6- 10. [16] Xu X, Yang F, Xiao X W, Zhang S, Korpelainen H, Li C Y. Sex-specific responses ofPopuluscathayanato drought and elevated temperatures. Plant, Cell & Environment, 2008, 31(6): 850- 860. [17] Ke Y Z, Zhou J X, Zhang X D, Sun Q X, Zuo L. Effects of salt stress on photosynthetic characteristics of mulberry seedlings. Scientia Silvae Sinicae, 2009, 45(8): 61- 66. [18] Xu D Q, Zhang Y Z, Zhang R X. Photoinhibition of photosynthesis in plants. Plant Physiology Communications, 1992, 28(4): 237- 243. [19] Scott S L, Aarssen L W. Leaf size versus leaf numbertrade-offs in dioecious angiosperms. Journal of Plant Ecology, 2013, 6(1): 29- 35. [20] Burk T E, Nelson N D, Isebrands J G. Crown architecture of short-rotation, intensively culturedPopulus. III. A model of first-order branch architecture. Canadian Journal of Forest Research, 1983, 13(6): 1107- 1116. [21] Lebon E, Pellegrino A, Louarn G, Lecoeur J. Branch development controls leaf area dynamics in grapevine (Vitisvinifera) growing in drying soil. Annals of Botany, 2006, 98(1): 175- 185. [22] Ward J K, Dawson T E, Ehleringer J R. Responses ofAcernegundogenders to interannual differences in water availability determined from carbon isotope ratios of tree ring cellulose. Tree Physiology, 2002, 22(5): 339- 346. [23] Zuo J, Wang G, Tang Y S, Qin Y L, Wang L, Zhang H T. The response of morphological plasticity and biomass allocation ofEupteleapleiospermumseedlings to different light regimes. Chinese Agricultural Science Bulletin, 2010, 26(21): 85- 89. [24] Zhang Y J, Feng Y L. The relationships between photosynthetic capacity and lamina mass per unit area, nitrogen content and partitioning in seedlings of twoFicusspecies grown under different irradiance. Journal of Plant Physiology and Molecular Biology, 2004, 30(3): 269- 276. [25] Li Y L, Cui J Y, Su Y Z. Specific leaf area and leaf dry matter content of some plants in different dune habitats. Acta Ecologica Sinica, 2005, 25(2): 304- 311. [26] Wang Y H, Wang K, Xing F. Advances of studies on the morphological plasticity, integration and foraging behavior of stoloniferous herbaceous plants. Chinese Journal of Ecology, 2005, 24(1): 70- 74. [27] de Kroons H, Hutchings M J. Morphological plasticity in clonal plants: the foraging concept reconsidered. Journal of Ecology, 1995, 83(1): 143- 152. [28] Bartelink H H. A model of dry matter partitioning in trees. Tree Physiology, 1998, 18(2): 91- 101. [29] Sheng C F. An napproach to the nature of compensation of crops for insect feedings. Acta Ecologica Sinica, 1989, 9(3): 207- 212. [30] Yuan B Z, Wang J, Zhao S L. An approach to the mechanism of plant compensation. Chinese Journal of Ecology, 1998, 17(5): 45- 49. [31] Belsky A J, Carson W P, Jensen C L, Fox G A. Overcompensation by plants: Herbivore optimization or red herring? Evolutionary Ecology, 1993, 7(1): 109- 121. [32] Quintero C, Bowers M D. Effects of insect herbivory on induced chemical defences and compensation during early plant development inPenstemonvirgatus. Annals of Botany, 2013, doi:10.1093/aob/mct011. [33] Focardia S, Tinellib A. Herbivory in a Mediterranean forest: browsing impact and plant compensation. Acta Oecologica, 2005, 28(3): 239- 247. [34] Trumble J T, Kolodny-Hirsch D M, Ting I P. Plant compensation for arthropod herbivory. Annual Review of Entomology, 1993, 38: 93- 119. [35] Lu H, Han J G, Zhang Z H. Impacts of damage caused byOedaleusasiaticuson the compensatory growth of plants in steppe. Pratacultural Science, 2008, 25(5): 112- 116. [36] Boege K. Influence of plant ontogeny on compensation to leaf damage. American Journal of Botany, 2005, 92(10): 1632- 1640. [37] Wang S J, Liu Y R, Zu C Q, Shen Y B. A study on the over-compensation effect of poplar from leaf loss. Forest Research, 1993, 6(3): 294- 298. 参考文献: [12] 林天宝, 李有贵, 吕志强, 朱燕. 桑树资源综合利用研究进展. 蚕桑通报, 2008, 39(3): 1- 4. [13] 叶伟彬. 我国桑树栽培技术的现状及发展对策. 蚕业科学, 1996, 22(4): 235- 240. [14] 唐翠明, 罗国庆, 陈训庭, 肖更生, 吴福泉, 杨琼, 吴剑安, 任德珠. 果叶两用无籽桑树品种“大10”的育成及其栽培技术. 苏州大学学报: 工科版, 2005, 25(2): 35- 38. [15] 罗培, 周申立. 土地利用变化对城郊农业区生态效益的影响——以四川省南充市高坪区为例. 生态与农 村环境学报, 2007, 23(4): 6- 10. [17] 柯裕州, 周金星, 张旭东, 孙启祥, 左力. 盐胁迫对桑树幼苗光合生理生态特性的影响. 林业科学, 2009, 45(8): 61- 66. [18] 许大全, 张玉忠, 张荣铣. 植物光合作用的光抑制. 植物生理学通讯, 1992, 28(4): 237- 243. [23] 左娟, 王戈, 唐源盛, 秦银林, 王莲, 张海坦. 领春木幼苗形态及生物量分配对光环境的响应. 中国农学通报, 2010, 26(21): 85- 89. [25] 李玉霖, 崔建垣, 苏永中. 不同沙丘生境主要植物比叶面积和叶干物质含量的比较. 生态学报, 2005, 25(2): 304- 311. [26] 王艳红, 王珂, 邢福. 匍匐茎草本植物形态可塑性、整合作用与觅食行为研究进展. 生态学杂志, 2005, 24(1): 70- 74. [29] 盛承发. 作物对虫害补偿作用本质的探讨. 生态学报, 1989, 9(3): 207- 212. [30] 原保忠, 王静, 赵松岭. 植物补偿作用机制探讨. 生态学杂志, 1998, 17(5): 45- 49. [35] 卢辉, 韩建国, 张泽华. 典型草原亚洲小车蝗危害对植物补偿生长的作用. 草业科学, 2008, 25(5): 112- 116. [37] 王世绩, 刘雅荣, 朱春全, 沈应柏. 杨树失叶对生长超越补偿作用的研究. 林业科学研究, 1993, 6(3): 294- 298. Effect of branch number on the growth and development ofMorusalbasaplings HUAN Huihui1, XU Xiao1,2,*, LIU Gang3, HE Jundong1, YANG Yanxia1, HUANG Kechao1 1CollegeofLifeScience,ChinaWestNormalUniversity,Nanchong637009,China2KeyLaboratoryofSouthwestChinaWildlifeResourcesConservation(ChinaWestNormalUniversity),MinistryofEducation,Nanchong637009,China3SericulturalResearchInstitute,SichuanAcademyofAgriculturalSciences,Nanchong637000,China MorusalbaL. is a valuable multipurpose species and is widely distributed in central, northern and southwestern China. This species is one of the most economically important cultivated tree species in China and also provides basic raw materials supporting vigorous development of China′s sericulture and textile industries. Most previous studies related toM.albahave primarily focused on cultivation techniques, pest control, quality improvement and development of resources. Previous studies have not yet provided data related to the photosynthetic capacity of this species or leaf growth patterns, and in particular, no studies have addressed the change of biomass in plants with a different number of branches. In this study, 3-year-old mulberry seedlings were transplanted from the garden of the Sichuan Academy of Agricultural Sciences to investigate the effects of branch number on plant growth. Five branch number models were used; that is, one, two, three, four, or five branches were left on the stem of saplings for experimental purposes, and the saplings were allowed to grow for 6 months. We investigated differences in various gas exchange factors, including net photosynthetic rate, stomatal conductance, intercellular CO2concentration and transpiration rate for plants using the five branch models during the growing season. From the aspect of plant morphological growth, we measured the growth rates based on leaf number, branch length and basal diameter for the five branch models, once every ten days. After the growing season, we measured the differences of leaf biomass, above ground stem biomass and total biomass among plants used for the five branch model experiments. We also analyzed biomass allocation inM.albawith the different branch models. The results show that the single-branch saplings had the highest net photosynthetic rate (Pn) (8.6 μmol·m-2·s-1). As the number of branches on a plant increased, thePnwas observed to decrease significantly and remained relative stable (4.3 μmol·m-2·s-1) when the number of branches was three or more. In contrast, stomatal conductance (gs), intercellular CO2concentration, (Ci) and transpiration rate (E) showed no significant changes in allM.albasaplings. Also, total leaf number (TLN), total leaf area (TLA), and total stem lengths (TSL) of saplings increased significantly as the number of branches increased to a maximum of 114.3 leaves, 10481.1 cm2, and 457.1 cm, respectively. However, the number of leaves per branch (LN/B), basal diameter per branch (BD/B), mean surface area per leaf (LA/L) and specific leaf area (SLA) obviously decreased in multiple-branch saplings and to 22.9 leaves, 7.57 mm, 87.3 cm2and 48.91 cm2/g, respectively. Moreover, branch number had no effect on the total dry biomass accumulation and allocation, but mean leaf dry mass per branch (LM/B), mean stem dry mass per branch (SM/B), and mean dry mass per branch (DM/B) gradually decreased with the increase in branch number, with values of 8.61 g, 9.51 g and 18.12 g, respectively. The results suggest that an increase in branch number may result in more intense competition for light resources between leaves, resulting in a lower net photosynthetic rate, smaller leaf area, and shorter stem length per branch as leaves compete for light and resources used to produce biomass. To eliminate the negative effects of such competition as much as possible, saplings can grow additional leaves as well as enlarge their total leaf area to make better use of limited light resources. Morusalba; branch number; net photosynthesis rate; morphological growth; biomass accumulation. 四川省青年科技基金资助项目(2012JQ0043) 2013- 06- 10; 2013- 10- 24 10.5846/stxb201306101645 *通讯作者Corresponding author.E-mail: xuxiao_cwnu@163.com 郇慧慧,胥晓,刘刚,贺俊东,杨延霞,黄科朝.不同分枝数对桑树幼苗生长发育的影响.生态学报,2014,34(4):823- 831. Huan H H, Xu X, Liu G, He J D, Yang Y X, Huang K C.Effect of branch number on the growth and development ofMorusalbasaplings.Acta Ecologica Sinica,2014,34(4):823- 831.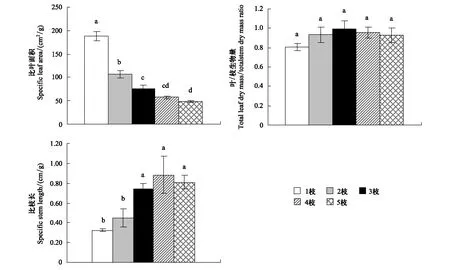

3 讨论与结论
