固定化Gibberella intermedia转化3-氰基吡啶制备烟酸
2014-08-08杨涛李恒龚劲松熊雷朱小燕许正宏史劲松
杨涛,李恒,龚劲松,熊雷,朱小燕,许正宏,史劲松
(江南大学药学院,江苏 无锡 214122)
烟酸属于维生素B系列化合物,是人体不可缺少的营养物质,是医药原料和食品添加剂,目前全球市场对烟酸的需求量预计在5.5万~6万吨。烟酸的生产主要采用化学合成法,如氨氧化法、高锰酸钾氧化法、硝酸氧化法、臭氧氧化法等[1]。化学法生产烟酸时,反应条件苛刻,需要高温高压,过程能耗较大,并且会产生大量的废气废渣等。因此,人们希望能够采用生物技术来进行绿色制造。生物催化法生产烟酸条件温和,反应过程易于控制,对环境的影响小,相比于化学合成法具有明显优势。
腈水解酶在生物合成羧酸方面具有较大的应用潜力,目前已有多种腈类化合物可以通过腈水解酶催化合成相应的有机酸[2-3]。到目前为止,尽管已有大量的不同菌属来源的微生物被报道具有腈水解酶活性,包括Pseudomonas putida[4],Bacillus subtilis[5],Aspergillus niger[6]等,然而多数研究主要集中围绕细菌腈水解酶展开。真菌腈水解酶相比于细菌腈水解酶具有诸多优势,如良好的选择性和温度稳定性等,但目前已开展的真菌腈水解酶相关研究工作仍然非常有限[7]。
作者实验室前期成功筛选获得了一株含有极高腈水解酶活性的真菌Gibberella intermediaCA3-1[8],该菌株在3-氰基吡啶生物转化合成烟酸的反应中表现出较大的应用潜力。
腈类化合物在纯酶催化下能更高效地进行生物转化反应[9],但酶分离纯化及催化过程中腈水解酶易失活[10]。相比来说,全细胞转化则具有更好的稳定性,并且转化成本低[11]。而固定化全细胞则能进一步提高生物催化剂的应用价值和使用效率,与游离细胞相比,固定化细胞有利于产物的分离提取,可增加细胞的重复利用批次[12-13],并能提高细胞对底物和产物的耐受性,降低生产成本[14]。
包埋法是最为常用的固定化方法[15],已有多种材料用于腈水解酶产生菌的固定化,包括海藻酸 钠[16]、琼脂[17]、卡拉胶[9]、聚丙烯酰胺[11]。G. intermedia是丝状真菌,是否可以采用上述材料进行包埋用于腈类化合物的生物转化,目前国内外尚没有相关文献报道。作者利用复合材料固定化方法克服单一材料固定化细胞保留活力低、机械强度差等问题,增强固定化细胞的应用潜力。
1 材料与方法
1.1 材料
1.1.1 菌种
G. intermediaCA3-1,由作者实验室筛选获得,已保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号CGMCC No. 4903。
1.1.2 主要试剂和设备
试剂材料:3-氰基吡啶、烟酸(纯度≥98%),Sigma公司;海藻酸钠、壳聚糖、聚乙烯醇、氯化钙、硼酸、三聚磷酸钠、己内酰胺等主要试剂均为国产分析纯试剂;酵母粉和葡萄糖为生化等级试剂。
主要设备:DHZ-DA型恒温摇床,太仓市实验设备厂;电子天平,美国SARTORIUS;高效液相色谱仪,美国Agilent公司;Multitron培养振荡器,瑞士INFORS HT;立式冷冻高速离心机,日本日立公司。
1.1.3 培养基
种子培养基(g/L):硝酸钠3,磷酸氢二钾1,硫酸镁(MgSO4·7H2O)0.5,氯化钾0.5,硫酸亚铁0.01,蔗糖30。
发酵培养基(g/L):磷酸二氢钾2.72,硫酸亚铁0.014,葡萄糖10,酵母粉7.5,氯化钠1.16,己内酰胺3.39,充分溶解后调pH值为7.0。
上述培养基均在121℃、20min进行灭菌处理。
1.2 方法
1.2.1 菌体培养与菌悬液制备
G. intermediaCA3-1培养:将CA3-1菌种由斜面接入种子培养基,在30℃、200r/min的摇床上振荡培养36h,得到种子液。按1%的接种量取种子液,接种至新鲜的发酵培养基中,在30℃、200r/min的摇床上振荡培养60h。
菌悬液制备:将上述发酵液于8000r/min、4℃下离心6min获得菌丝体,用生理盐水洗涤2次后,加入适量生理盐水制备16g/L的菌悬液。
1.2.2 固定化细胞的制备
海藻酸钠-壳聚糖固定化:称取一定量的海藻酸钠在50℃水浴中搅拌溶解,同时称取一定量壳聚糖用2%乙酸溶解。准确将16g/L的菌悬液与等体积的海藻酸钠溶液混合均匀,用蠕动泵缓慢的将上述混合液滴入到4℃,0.6% CaCl2溶液中成球固化;固化结束后,将固定化细胞置于一定浓度的壳聚糖溶液中覆膜10min。经PBS缓冲液(pH值7.0)洗涤3次置于4℃备用。
海藻酸钠-明胶固定化:准确将16g/L的菌悬液与等体积含有适量海藻酸钠和明胶的固化材料溶液混合,不断搅拌混合均匀,通过蠕动泵恒定速度滴入到4℃,0.6% CaCl2溶液中成球固化。固化结束,以PBS缓冲液(pH=7.0)洗涤3次后置于4℃备用。
壳聚糖-聚乙烯醇固定化:准确将16g/L的菌悬液与等体积含有适量壳聚糖和聚乙烯醇的固化材料溶液混合均匀。利用蠕动泵以恒定速度将以上混合液滴入到4℃,含有8%三聚磷酸钠的饱和硼酸溶液中成球固化。制备结束,用PBS缓冲液(pH值7.0)洗涤3次后置于4℃备用。
1.2.3 固定化细胞机械强度的测定
从固定化细胞中挑选100颗大小均匀的固定化颗粒,连同30颗玻璃珠置于150mL三角瓶中,加水20mL,在220r/min、30℃旋转式摇床处理48h。观察未破碎的固定化细胞数(n)。
机械强度=n/100×100%
1.2.4 pH值对游离细胞和固定化细胞的影响
取等量的固定化细胞和游离细胞,在30℃, pH值分别为3、5、6、7、8、9、11条件下反应一定时间后,分别取样测定酶活。以最适pH值下的酶活为100%计算其他pH值下样品的相对活力。
1.2.5 温度对游离细胞和固定化细胞的影响
取等量的固定化细胞和游离细胞,分别在25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃,最适pH值下保温一定时间,分别取样测定酶活。以最适温度下的酶活为100%计算其他温度下样品的相对活力。
1.2.6 游离细胞和固定化细胞温度稳定性实验
取一定量固定化细胞分别于30℃、40℃、50℃水浴保温,定期取样测定固定化细胞的酶活力,考察温浴过程酶活的变化情况。
1.2.7 酶活力的定义及测定
一个单位酶活(U)的定义:在一定条件下,每分钟催化氰基水解产生1μmol/L羧酸的酶量。
酶活力测定:取适量固定化细胞置于10mL用PBS缓冲液配置的100mmol/L 3-氰基吡啶溶液中,在30℃摇床上反应20min。反应结束,过滤收集转化液。
转化液离心取上清液,稀释后利用高效液相色谱(Agilent)在268nm下检测,色谱柱为C18柱(Waters,4.6mm×150mm,5μm),流动相为乙腈∶磷酸(0.025%)=3∶2,流速为1mL/min,柱温30℃。每组实验做3个平行测定。
2 结果与讨论
2.1 细胞的固定化
2.1.1 固定化细胞复合材料比例选择
海藻酸钠-壳聚糖固定化:海藻酸钠固定化细胞后,再用壳聚糖溶液处理,可在其表面覆膜一层薄膜,能够起到增强固定化细胞强度的作用,但也会影响固定化细胞对底物以及产物的通透性。实验研究了不同壳聚糖的浓度对催化活力和机械强度的影响,结果见图1。
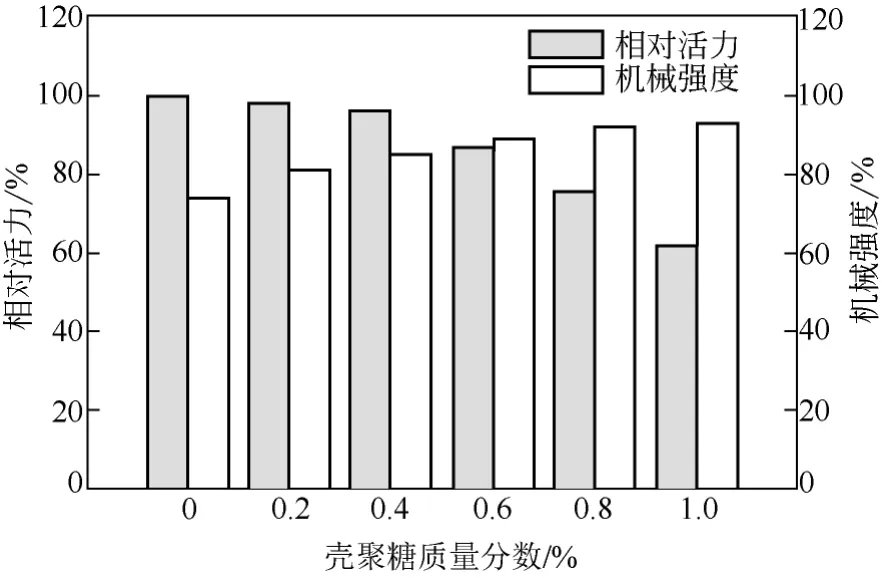
图1 壳聚糖浓度对固定化细胞酶活及机械强度的影响
随着壳聚糖浓度不断增大,固定化细胞活力逐渐降低。主要原因为壳聚糖浓度增加后,在固定化细胞表面形成的膜厚度和致密性也相应增强,增大 了物质进出固定化细胞的阻力,导致了固定化细胞催化活力的降低。壳聚糖浓度为0.4%时,对固定化细胞活力影响小,并且机械强度也提高到12%。因此0.4%为壳聚糖覆膜的适宜浓度。
海藻酸钠-明胶固定化:海藻酸钠和明胶可以共混,然后用于菌丝体的固定化。
这种复合材料固定的方法,可通过调节凝胶浓度改善固定化细胞的机械强度和包埋率。与单一海藻酸钠凝胶相比,在其中加入明胶后,使得凝胶的孔径更大,更为松散,这对底物进出固定化细胞有促进作用[18]。如图2所示,2.5%海藻酸钠与2%明胶固定化细胞的活力最高,较单一海藻酸钠固定化细胞活力提高8%左右,而且机械强度也有一定程度增加。
同样,壳聚糖与聚乙烯醇也可以进行复合固定。单独的壳聚糖固定化凝胶网络疏松,空隙较多,机械强度较差,而聚乙烯醇凝胶柔韧性好,机械强度高,网格致密。两种材料复合使用,能够起到优势互补作用,使得固定后的细胞既具有较好的机械强度,也可保留较高酶活力。如图3所示,随着聚乙 烯醇浓度的增加,固定化细胞的机械强度不断提高,当添加浓度达到2%时,就可以使机械强度得到大幅提高。

图2 海藻酸钠-明胶浓度对固定化细胞强度和酶活的影响
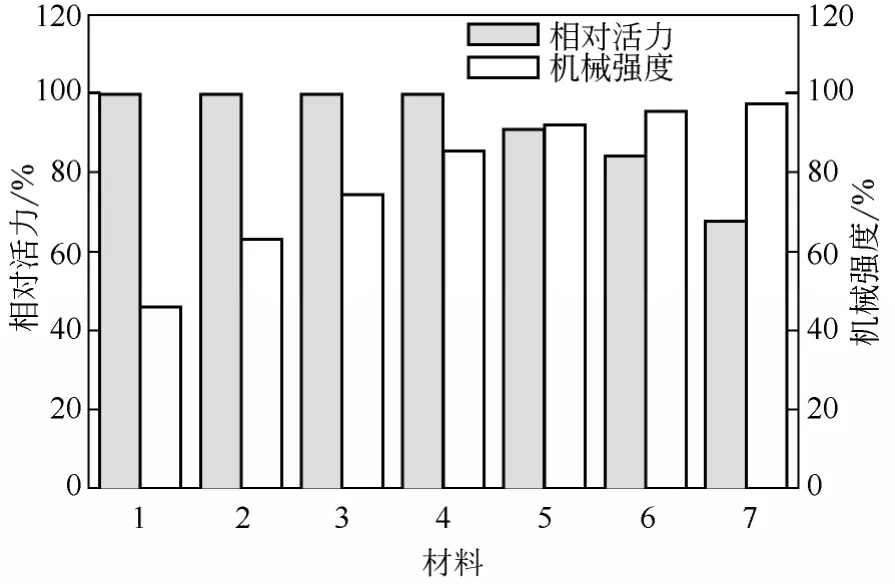
图3 壳聚糖-聚乙烯醇浓度对固定化细胞活力和强度的影响
2.1.2 固定化细胞制备材料的选择
选取3种复合材料的优化配比进行固定化菌体,进行底物3-氰基吡啶转化实验,比较固定化细胞的相对活力和机械强度。
如表1所示,3种复合材料制备的固定化细胞均为球形。海藻酸钠-壳聚糖复合凝胶和聚乙烯醇-壳聚糖复合凝胶的机械强度高于海藻酸钠-明胶复合凝胶;聚乙烯醇-壳聚糖固定化后的相对酶活力达到85%,海藻酸钠-明胶次之,海藻酸钠-壳聚糖的活力仅为76%。此外,对于丝状真菌而言,制球的工艺操作难度也是一项重要的衡量指标,聚乙烯醇-壳聚糖复合凝胶制备最为简易,其次是海藻酸钠-明胶复合凝胶,海藻酸钠-壳聚糖凝胶制备过程复杂,难度最大。海藻酸钠凝胶对磷酸盐的耐受性差,并且在中性条件下小球易裂解,不易长期保存[19];相比之下,壳聚糖-聚乙烯醇复合凝胶具有较好的磷酸盐耐受性,而且底物3-氰基吡啶能够提高聚乙烯 醇的稳定性,因此,从应用角度来看,壳聚糖-聚乙烯醇是固定化G. intermedia的理想载体。

表1 不同复合材料固定化的比较
2.2 pH值对固定化细胞和游离细胞活力的影响
对壳聚糖-聚乙烯醇复合固定化细胞的转化pH值进行研究,由图4可知,尽管固定化细胞最适反应pH值仍为7,但固定化后对酸碱的耐受性显著 增加。
2.3 固定化细胞最适转化温度
考察复合固定细胞和游离细胞的最适转化温度,测定结果如图5所示。
固定化细胞最适反应温度为45℃,比游离细胞提高5℃,并且固定化细胞在30~50℃范围内酶活均达到80%以上,固定后能提高菌体对环境温度的适应性[11]。
2.4 固定化细胞半衰期
研究固定化菌体在不同温度下的半衰期,考察其温度稳定性。图6显示的是固定化细胞在30℃、40℃、50℃下随时间变化的残留酶活力。通过计算,在上述温度下相应的半衰期分别为330.5h、128.3h、11.2h,比游离细胞分别提高了1.43倍、1.76倍和1.75倍[8]。这表明固定化能在一定程度上对细胞起到良好的保护作用,热稳定性显著提升,这也是固定化细胞可以重复多批次利用的前提。
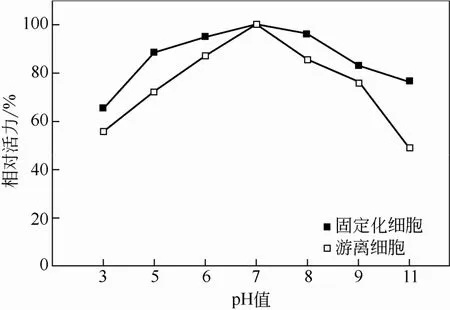
图4 pH值对固定化细胞和游离细胞酶活的影响

图5 温度对固定化细胞和游离细胞活力影响

图6 聚乙烯醇-壳聚糖固定化细胞的温度稳定性
2.5 固定化细胞底物浓度选择
底物浓度是影响固定化细胞酶活力和转化率的重要因素[21],其中,高浓度3-氰基吡啶对细胞的毒性作用也得到了文献证实,以Nocardia globerulaNHB-2腈水解酶为例,当浓度超过300mmol/L时,即表现出明显的底物抑制[22]。采用50~700mmol/L的不同初始底物浓度来考察其对固定化细胞和游离细胞活力的影响,结果如图7所示,当3-氰基吡啶的浓度低于100mmol/L时,相比固定化细胞,G. intermedia游离细胞具有更高酶活力,表明固定化细胞在转化过程中受到了传质阻力的影响;不过,当底物浓度高于100mmol/L时,游离细胞受到底物抑制作用导致转化率不断降低。对于固定化细胞而言,底物浓度在50~300mmol/L下,其烟酸产率不断提高;底物浓度高于300mmol/L后,烟酸产率开始降低。该过程说明,固定化材料对细胞起到了保护作用,使其对高浓度底物的耐受性显著提高。随着底物浓度增加,这种优势能得到进一步体现,传质阻力的影响则相应弱化。
当初始底物浓度达到300mmol/L时,固定化细胞能在60min内完全转化,而游离细胞需要100min,见图8。由此可见,固定化细胞相比游离细胞底物 耐受性明显提高,并能转化高浓度的底物。

图7 不同浓度底物对固定化细胞和游离细胞酶活力影响

图8 不同浓度底物转化过程曲线
2.6 固定化细胞重复批次实验
利用固定化细胞和游离细胞进行批次转化,研究固定化细胞和游离细胞的操作稳定性。转化过程在最适条件下进行,底物浓度为300mmol/L。每一批次反应结束后,催化剂经过洗涤后转入新的转化体系中进行下一批次转化。如图9所示,游离细胞可重复利用9次,每克干细胞能转化生产93.9g烟酸;固定化细胞则能重复利用26次,每克干细胞可生产283.5g烟酸。固定化细胞的转化能力是游离细胞的3倍,其细胞利用率显著增加。
2.7 固定化细胞的补料分批转化
对固定化细胞分批补料连续转化模式进行研究,以考察其对于连续转化操作的适应性。实验过程中,每隔1h向反应体系中添加300mmol/L 3-氰基吡啶并且取样检测转化情况,见图10。
分批补料12次,固定化细胞均能将底物完全转化,其转化能力相当于每克干细胞产生132.6g烟酸。当超过12次后,由于底物抑制作用转化能力开始下降,反应体系中底物3-氰基吡啶出现积累。当补料至第19次时,固定化细胞相对酶活只有约30%,转化能力大幅度下降。以19批次进行计算,则每克 干细胞的转化能力达到191.3g烟酸。

图9 固定化细胞和游离细胞的重复利用性能

图10 固定化细胞补料分批转化
3 结 论
利用复合固定化技术对G. intermediaCA3-1游离细胞进行固定化和转化条件研究,以固定化细胞的相对酶活和机械强度作为综合考察因素,选择出聚乙烯醇-壳聚糖为理想的复合包埋材料。采用这种方式的固定化细胞,其热稳定性和操作稳定性均比游离细胞有明显改善,并对高浓度底物的耐受性显著增强,单位细胞的转化能力大幅提高。菌体固定化后,其利用效率得到改善,可用于连续循环转化,提高了生产强度,便于产品的后续分离,使生物法制备烟酸更为经济。
[1] 王奇昌,白金泉,郭丰艳,等. 烟酸制备的研究进展[J]. 广东化工,2008,35(3):32-35.
[2] Banerjee A,Sharma R,Banerjee U C. The nitrile-degrading enzymes:Current status and future prospects[J].Appl. Microbiol. Biotechnol.,2002,60(1-2):33-44.
[3] Velankar H,Clarke K G,du Preez R,et al. Developments in nitrile and amide biotransformation processes[J].Trends Biotechnol.,2010,28(11):561-569.
[4] Banerjee A,Kaul P,Banerjee U C. Purification and characterization of an enantioselective arylacetonitrilase fromPseudomonas putida[J].Arch. Microbiol.,2006,184(6):407-418.
[5] Zheng Y G,Chen J,Liu Z Q,et al. Isolation,identification and characterization ofBacillus subtilisZJB-063,a versatile nitrile- converting bacterium[J].Appl. Microbiol. Biotechnol.,2008,77(5):985-993.
[6] Kaplan O,Vejvoda V,Plihal O,et al. Purification and characterization of a nitrilase fromAspergillus nigerK10[J].Appl. Microbiol. Biotechnol.,2006,73(3):567-575.
[7] Vejvoda V,Kubáč D,Davidová A,et al. Purification and characterization of nitrilase fromFusarium solaniIMI196840[J].Process Biochem.,2010,45(7):1115-1120.
[8] Wu Y,Gong J S,Lu Z M,et al. Isolation and characterization ofGibberella intermediaCA3-1,a novel and versatile nitrilase- producing fungus[J].J. Basic Microbiol.,2013,53(11):934-941.
[9] Liu Z Q,Zhou M,Zhang X H,et al. Biosynthesis of iminodiacetic acid from iminodiacetonitrile by immobilized recombinant Escherichia coli harboring nitrilase[J].Appl. Microbiol. Biotechnol.,2012,22(1):35-47.
[10] Woodley J M. Choice of biocatalyst form for scalable processes[J].Biochem. Soc. Trans.,2006,34:301-303.
[11] Kaul P,Banerjee A,Banerjee U C. Stereoselective nitrile hydrolysis by immobilized whole-cell biocatalyst[J].Biomacromolecules,2006,7:1536-1541.
[12] 梅佳军,张常青,刘嵘明,等. 利用改性载体固定化大肠杆菌产琥珀酸[J]. 化工进展,2013,32(1):161-165.
[13] 汪云,王利群,何玉财,等. 两相体系中固定化黏红酵母CCZU-G5催化合成(R)-2-羟基-4-苯基丁酸乙酯[J]. 化工进展,2013,32(3):661-665.
[14] Dursun A Y,Tepe O. Internal mass transfer effect on biodegradation of phenol by Ca-alginate immobilizedRalstonia eutropha[J].J. Hazard. Mater.,2005,126(1-3):105-111.
[15] Sheldon R A,van Pelt S. Enzyme immobilisation in biocatalysis:Why,what and how[J].Chem. Soc. Rev.,2013,42(15):6223-6235.
[16] Wang Y S,Zheng R C,Xu J M,et al. Enantioselective hydrolysis of ®-2,2-dimethylcyclopropane carboxamide by immobilized cells of an R-amidase-producing bacterium,Delftia tsuruhatensisCCTCC M 205114,on an alginate capsule carrier[J].J. Ind. Microbiol. Biotechnol.,2010,37(5):503-510.
[17] Nigam V K,Khandelwal A K,Gothwal R K,et al. Nitrilase-catalysed conversion of acrylonitrile by free and immobilized cells ofStreptomycessp[J].J. Biosci.,2009,34(1):21-26.
[18] 王爱玲,杨江科,尹利,等. 海藻酸钠明胶协同固定化的研究[J]. 生物技术,2006,16(6):69-72.
[19] 李超敏,韩梅,张良,等. 细胞固定化技术——海藻酸钠包埋法的研究进展[J]. 安徽农业科学,2006,34(7):1281-1282,1284.
[20] Zhang Y W,Prabhu P,Lee J K. Alginate immobilization of recombinantEscherichia coliwhole cells harboring L-arabinose isomerase for L-ribulose production[J].Bioproc. Biosyst. Eng.,2010,33(6):741-748.
[21] Graham D,Pereira R,Barfield D,et al. Nitrile biotransformations using free and immobilized cells of a thermophilicBacillus spp[J].Enzyme Microb. Tech.,2000,26:368-373.
[22] Sharma N N,Sharma M,Bhalla T C. An improved nitrilase-mediated bioprocess for synthesis of nicotinic acid from 3-cyanopyridine with hyperinducedNocardia globerulaNHB-2[J].J. Ind. Microbiol. Biotechnol.,2011,38(9):1235-1243.
