A型禽偏肺病毒F蛋白的原核表达与抗原性分析
2014-08-08朱姗姗张春燕柳舒航李子璇
阎 旭,韦 莉,王 菁,朱姗姗,张春燕,柳舒航,全 荣,李子璇,刘 浩,刘 爵
(1.天津科技大学生物工程学院,天津 塘沽 300457;2.北京市农林科学院畜牧兽医研究所,北京 海淀 100097)
禽偏肺病毒病(Avian metapneumovirus,aMPV)是指由偏禽肺病毒引起的一种以禽呼吸道症状、头部肿胀和产蛋率下降为主要特征的疾病。禽偏肺病毒又称火鸡鼻气管炎病毒(TRTV),感染火鸡后可引起温和或中度上呼吸道感染-火鸡鼻气管炎(TRT);也可引起鸡的温和型上呼吸道或中枢神经系统疾病-肿头综合征(SHS)。禽偏肺病毒属于副黏病毒科、肺病毒亚科、肺病毒属,于1978年首次发现于南非共和国,随后从法国、英国、中国台湾、日本等国家和地区的呼吸道疾病或SHS发病鸡中分离到aMPV。1998年沈瑞忠[1]等人在我国黑龙江某肉鸡场的SHS鸡群中分离到了APV/Chick⁃en/China/1/98株。
1997年,在美国科罗拉多州首次分离到与欧洲等一些国家报道的毒株不同的aMPV,命名为aMPVC。根据吸附糖蛋白G蛋白核苷酸序列分析和单克隆抗体中和试验,aMPV分为A、B、C、D四个亚型。aMPV-A和aMPV-B主要分布在欧洲和南非,aMPVC感染以美国为主,aMPV-D仅在法国可检测到。通过特异性单克隆抗体中和试验检测表明,aMPV-C与aMPV-A、aMPV-B之间没有明显的血清学关系。一般情况下,aMPV-A和aMPV-B之间蛋白结构的同源性为70%~90%,二者与aMPV-C之间的同源性则为40%~70%,而aMPV-C与hMPV之间的蛋白结构比其他亚型更相似。
禽偏肺病毒是一种不分节段的单股负链RNA病毒,病毒粒子具有多形性,一般呈椭圆形,偶尔也有圆形或长线状形,直径80~300 nm,核衣壳大小约为15 nm,有囊膜,表面纤突长约13~15 nm[2]。aMPV共有8种结构蛋白,3种膜蛋白[3-5],即融合蛋白F、小疏水蛋白SH和糖蛋白G,其中F蛋白诱导与病毒包膜与宿主细胞质膜的融合,又称为融合蛋白。病毒包膜与细胞质膜的融合是把核衣壳传递到细胞质中,随后感染细胞,在感染的细胞质膜中表达的F蛋白可以介导与邻近细胞质融合形成合胞体[6-7],合胞体可能是病毒传播的机制。F蛋白为I型膜蛋白,编码540~580个氨基酸,研究表明,F蛋白是偏肺病毒宿主嗜性的主要决定因素[14]。本试验的目的是利用可溶性的大肠杆菌系统表达aMPV F基因,为今后的研究奠定基础。
1 材料与方法
1.1 质粒、菌种、酶类及其他试剂 Pcmv-myc-L质粒本实验室保存;pBCX载体谢青梅博士惠赠。基因工程宿主菌E.coli DH5α,TaKaRa公司购买;表达菌E.coli BL21(DE3)博迈德生物公司购买。PrimeSTAR HS DNA Polymerase,购自 TaKaRa公司;Trans2K DNA Marker,购自Transgen公司;快速凝胶回收试剂盒和小量质粒DNA提取纯化试剂盒,购自Omega公司;限制性内切酶HindⅢ、Kpn I和磷酸酶抑制剂,购自NEB公司;QIAquick PCR Purification Kit,购自Qiagen公司;T4 DNA连接酶,购自Fermentas公司;IPTG、Amp、溴化乙锭(EB),购自宝泰克生物科技有限公司;6×His-Tag融合蛋白亲和层析Ni-NTA凝胶,购自德国Qiagen公司。
1.2 F基因的扩增、回收 根据GenBank上发表的A型aMPV F蛋白基因序列,用Oligo 6.0软件设计一对特异性引物(F1/F2),F1:5′-GG GGTACC GAG⁃GCAGTATCCACATTAGGG-3′,F2:5′-CCC AAGCTT CTTGGCATCTGCACCTAG-3′。其扩增片段长度为1023 bp,以Pcmy-myc-L作为模板取0.2μL,加入上下游引物F1、F2各1μL,2.5 mmol/L dNTP 2μL,5×Buffer4μL,Prime STAR 0.2μL,加ddH20至20μL。PCR反应循环程序如下:95℃预变性5 min,94℃30 s,59℃1.5 min,循环35次,最后72℃延伸10 min。1%琼脂糖凝胶电泳检测扩增产物,OMEGA公司快速凝胶回收试剂盒回收目的片段。
1.3 重组质粒的构建与鉴定 回收的F基因经HindⅢ和KpnⅠ酶切,克隆至pBCX载体中,构建pBCX/AMV/A/F。将其转化入感受态BL21(DE3)中,鉴定为阳性的单菌落,加入终浓度分别为0.8、1.0、1.2 mmol/L IPTG进行诱导表达,确定最适诱导条件。
1.4 目的蛋白的可溶性分析、纯化及鉴定 参照确定的最适诱导条件,IPTG诱导表达4 h,离心收集菌体冰浴条件下超声破碎,分别取上清和沉淀进行SDS-PAGE电泳分析。按照Qiagen纯化蛋白试剂盒说明,在非变性的条件下,将1000 mL经IPTG诱导4 h后的菌液,取菌体裂解、离心,将上清通过Ni-NTA柱,收集洗脱液,并测蛋白浓度。将纯化所得蛋白分别进行SDS-PAGE电泳和WB。常规制备样品,12%SDS-PAGE分离蛋白,将蛋白转移至NC膜上,封闭NC膜,PBST洗膜3次,加入1∶800稀释的一抗溶液,室温孵育2 h,PBST液洗膜3次,放人1∶8000稀释HRP标记的羊抗鼠IgG二抗中,室温孵育1.5 h,PBST液洗膜3次,每次10 min。把NC膜浸入到配好的底物溶液中显色,出现颜色时,立刻用蒸馏水冲洗终止反应,拍照。
2 结果
2.1 F基因的PCR扩增结果 用所设计的F1/F2引物进行PCR扩增,从Pcmy-myc-L质粒中扩增的PCR产物于1%琼脂糖凝胶电泳时,可以见到长约1023 bp左右的电泳条带,大小与预期的相吻合(图1)。

图1 F基因的PCR扩增
2.2 重组质粒的酶切与PCR鉴定结果 挑取转化后的单菌落进行PCR鉴定,扩增到长约1023 bp的片段(图2)。aMPV-F基因PCR产物经纯化酶切后,插入pBCX载体的外源基因插入位点,构成重组质粒pBCX-F(图3)。
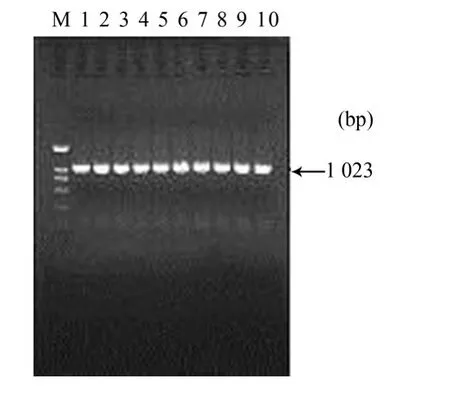
图2 单菌落PC R鉴定
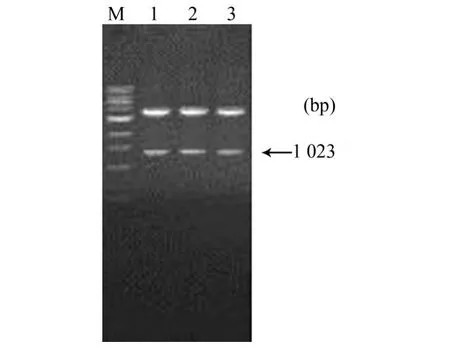
图3 重组质粒酶切鉴定
2.3 SDS-PAGE分析结果 取菌液接种到LA液体培养基中,37℃220 r/min离心振摇培养,待细菌浓度达到OD600为0.4~0.5时加入IPTG并使其终浓度达1 mmol/mL,取不同小时诱导的菌液进行SDS-PAGE检测,表达产物如图4所示,直接将融合蛋白细菌裂解上清用QIAGEN NI纯化柱纯化,在Clution Buffer洗脱液中含有目的融合蛋白,如图5所示。

图4 融合蛋白表达产物的S D S-PA G E检测
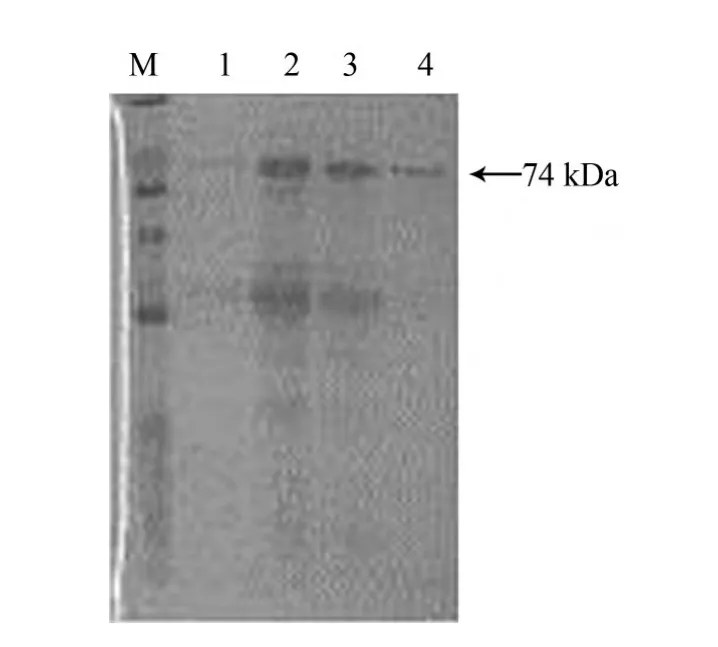
图5 融合蛋白纯化S D S检测

图6 表达重组蛋白的W estern-blotting鉴定
2.4 Western-blotting分析结果 经SDS-PAGE电泳,利用Western-blotting对纯化的aMPV F融合蛋白进行特异性鉴定。结果在预定的74 kDa上方处有一条较深的显色带,说明重组F蛋白具有抗原活性,大小与SDS-PAGE表达的蛋白大小一致。该结果证实了用载体pBCX表达的融合蛋白F均具有免疫活性。
3 讨论
目前我国是世界上第一养鸡大国,鸡的饲养量96亿只,每年因各类禽病带来的死亡率高达20%~25%,损失数百亿人民币。因此,研制特异、灵敏、简便的诊断试剂盒是我国当前防控疫病的迫切需求。在众多的表达系统之中,大肠杆菌表达系统是目前应用最为广泛的经典表达系统,具有结构简单、易操作、成本低廉的优点。本试验进行了A型aMPV F基因在大肠杆菌系统中的表达,所选取的表达载体pBCX是pet-43.1载体插入了msyB基因作为融合伴侣的改造载体,msyB基因编码蛋白是大肠杆菌本身的蛋白,是一种高可溶性多肽,本身在大肠杆菌中表达量很高,其作为载体蛋白具有稳定性、可溶性和表达水平高的特性;pBCX载体有6×His融合标签,有肠激酶的裂解位点,便于检测和纯化所表达的重组融合蛋白,本试验表达的F蛋白具有免疫原性,可以直接作为免疫原免疫动物,也可以纯化之后免疫动物,或与佐剂配合之后免疫动物。为了减少免疫的副作用,也可以用肠激酶处理该融合蛋白,将目标蛋白与伴侣蛋白裂解,收集、纯化目标蛋白,用目标蛋白作为抗原免疫动物。
本试验仅是初步探索了aMPV F基因在大肠杆菌中的表达情况,为更加深入地研究aMPV F基因的功能及其他重组蛋白的表达提供了参考,aMPV F基因在大肠杆菌中的成功表达为aMPV诊断抗原及基因工程疫苗的研制奠定了基础。
[1]沈瑞忠,曲立新,于康震,等.禽肺病毒的分离鉴定[J].中国预防兽医学报,1999,21(1):76-77.
[2]阚保东.禽肺病毒病简介[J].中国兽医科技,2000(5):42-43.
[3]吴东来,杨建德,李桂芝,等.肉鸡肿头综合征的病理形态学变化[J].中国预防兽医学报,1999,7,21(4):301-302.
[4]M mase.从日本肿头综合征鸡中测得禽肺病毒分析[C].世界禽病会第11届国际大会纪念专集,北京:1998:56.
[5]B W卡尼尔克.禽病学[M].高福,刘文军,译.9版.北京:北京农业出版社,1991:571-574.
[6]Buchholz U J,Biacchesi S,Pham Q N,et al.Deletion of M2 gene open reading frames 1 and 2 ofhuman metapneumovirus:ef⁃fects on RNA synthesis,attenuation,and immunogenicity[J].J Vi⁃ro,2005,79(11):6588-6597.
[7]Yu Q,Estevez C N,Roth J P,et al.Deletion of the M2-2 gene from avian metapneumovirus subgroup C impairs virus replica⁃tion and immunogenicity in Turkeys[J].Virus Genes,2011,42(3):339-346.
[8]Schowalter R M,Smith S E,Dutch R E.Characterization of hu⁃man metapneumovirus F protein-promoted membrane fusion:crit⁃ical roles for proteolytic processing and low pH[J].J Virol,2006,80(22):10931-10941.
[9]HerfstS,Mas V,Ver L S,etal.Low-pH-induced membrane fusion mediated by human metapneumovirus F protein is a rare,straindependentphenomenon[J].JVirol,2008,82(17):8891-8895.
[10]Chen L,Gorman J J,McKimm-Breschkin J,et al.The structure of the fusion glycoprotein of Newcastle disease virus suggests a novelparadigm for the molecular mechanism ofmembrane fusion[J].Structure,2001,9(3):255-266.
[11]Russell R,Paterson R G,Lamb R A.Studies with cross-linking reagents on the oligomeric form of the paramyxovirus fusion pro⁃tein[J].Virology,1994,199(1):160-168.
[12]Yin H S,Paterson R G,Wen X,et al.Structure of the uncleaved ectodomain of the paramyxovirus(hPIV3)fusion protein[J].Proc Natl Acad Sci USA,2005,102(26):9288-9293.
[13]Yin H S,Wen X,Paterson R G,et al.Structure of the parainflu⁃enza virus 5 F protein in its metastable,prefusion conformation[J].Nature,2006,439(7072):38-44.
[14]Homma M,Ouchi M.Trypsin action on the growth of Sendai vi⁃rus in tissue culture cells.3.Structural difference of Sendai virus⁃es grown in eggs and tissue culture cells[J].J Virol,1973,12(6):1457-1465.
