固定化硫酸盐还原菌选择性去除U(Ⅵ)的性能
2014-08-07唐振平王文涛谢水波高媛媛马华龙
唐振平,周 帅,王文涛,谢水波,2,*,高媛媛,马华龙
(1.南华大学 污染控制与资源化技术湖南省重点实验室,湖南 衡阳 421001;2.南华大学 铀矿冶生物技术国防重点学科实验室,湖南 衡阳 421001)
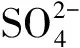
研究表明,在H2或乳酸盐等电子供体存在下,硫酸盐还原菌(SRB)可通过酶促作用直接还原/沉淀U(Ⅵ),阻止U(Ⅵ)的迁移和扩散[5-8]。而要实现SRB生物还原/沉淀U(Ⅵ)的产业化,固定化技术的应用极为关键[5-7]。现有的报道多集中于游离态SRB还原U(Ⅵ)途径和环境因子影响的探讨[9-10],但关于固定化SRB应用的研究较少;重金属离子和含氧阴离子等共存物对U(Ⅵ)还原过程的影响已有报道[1,10],但对有机物的影响缺乏系统研究;利用SRB去除污染物时多针对U(Ⅵ)[5,6-9]、Zn及Cu[11-15]等单一目标,有机或无机体系下U(Ⅵ)/重金属的选择性去除尚未见报道。
本工作拟利用聚乙烯醇和海藻酸钠制备硫酸盐还原菌微球,探讨Zn2+和Cu2+等重金属离子,乙酸钠、草酸钠和柠檬酸钠等有机物对其还原废水中U(Ⅵ)的影响,并考察其选择性去除U(Ⅵ)的技术参数。
1 实验
1.1 主要试剂与仪器
聚乙烯醇、海藻酸钠,分析纯,天津科密欧化学试剂开发中心;U3O8,分析纯,国家标准物质中心(北京),标准铀溶液采用GBW04201方法配制。
T6型紫外可见分光光度计,北京普析通用仪器有限责任公司;AA-6300型原子吸收分光光度计,日本岛津公司;TG16型高速离心机,长沙英泰仪器有限责任公司;PHS-3C型pH计,上海精密科学仪器有限公司;79-1型恒温磁力搅拌器,江苏教育玻塑厂;HZQ-C型空气浴恒温振荡器,哈尔滨东联电子技术开发有限公司。
1.2 SRB的分离与培养
自南华大学某下水道取黑色污泥,按5 g∶1 L将污泥接种入Postgate B液体培养基,置于35 ℃振荡培养箱中富集培养约1周。待液体培养基变黑且发出臭鸡蛋味后,采用平皿压层厌氧法对富集的SRB进行分离,即将琼脂浓度为2%的Postgate E固体培养基倒入已灭菌且编号的培养皿(90 mm×15 mm)中,分别按10-1、10-2、10-3和10-4稀释度吸取0.1 mL SRB富集液均匀涂布于固体培养基上。培养约3 d后,挑取内含黑色SRB菌落的琼脂块,采用Postgate C液体培养基对分离得到的SRB扩大培养约3 d。3次分离培养后的SRB菌体经离心(8 000 r/min,10 min)、冲洗(2.5 mg/L NaHCO3缓冲液,100 mL)后,置于盛有100 mL 2.5 mg/L NaHCO3缓冲液的150 mL血清瓶中,于4 ℃冰箱内保存。最终SRB菌悬液浓度约为35 g/L(以菌体干重计)。
1.3 固定化SRB微球的制备
将“聚乙烯醇-硫酸钠-硼酸法”[16]进行适当改进后用于制备固定化SRB微球。分别称取8 g聚乙烯醇和0.5 g海藻酸钠于100 mL烧杯中,再加入无菌水75 mL,加热至其完全溶解,冷却至35 ℃。加入25 mL上述SRB菌悬液,搅拌约30 min至其混匀。混合液中聚乙烯醇、海藻酸钠和SRB最终浓度分别为8、0.5、0.875 g/mL。用注射器将此混合液滴入盛有200 mL的CaCl2(2 g/mL)和饱和硼酸(6 g/mL)溶液(交联剂Ⅰ)的烧杯中,成球后用磁力搅拌器轻微搅动1.5 h。之后,将过滤后的微球转移至0.5 mol/L硫酸钠溶液(交联剂Ⅱ)中,再用磁力搅拌器轻微搅动2.5 h,倾去硫酸钠溶液,即得到成型的固定化SRB微球。最后,用无菌水冲洗微球2~3次,于4 ℃冰箱中保存备用。保持其他条件不变,不添加SRB菌悬液,采用以上方法制备空白微球。
1.4 实验方法

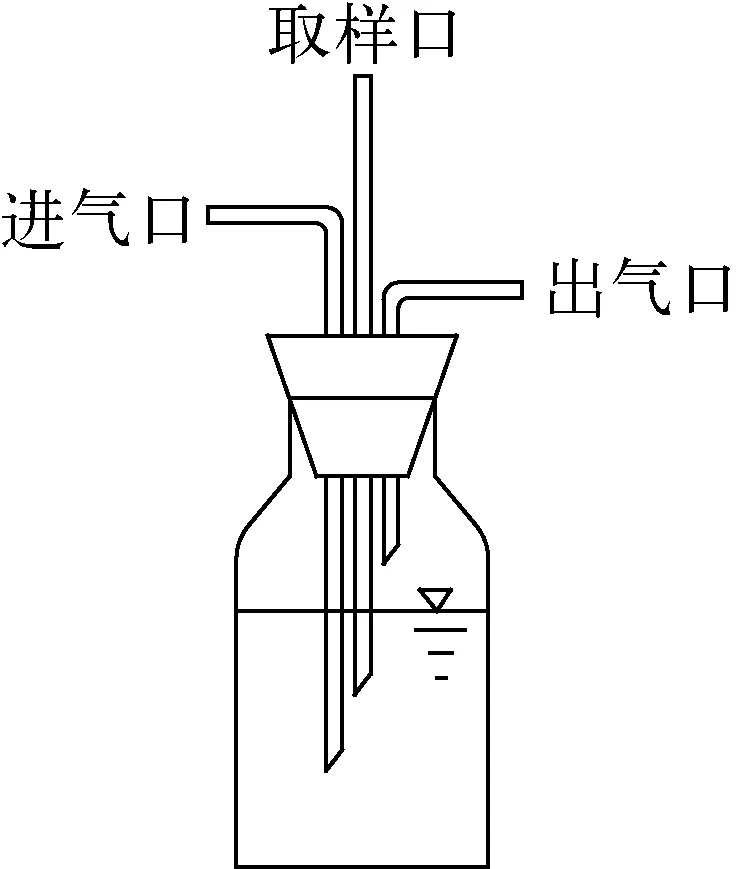
图1 厌氧培养装置
在150 mL血清瓶中分别加入100 mL上述培养液,用0.1 mol/L的NaOH和0.01 mol/L的HCl调pH值至6.0,于35 ℃下振荡培养,定时取样分析。培养过程中不添加酵母浸膏、维生素C等营养物质,以限制SRB生长,消除U(Ⅵ)还原的干扰因素[17];充高纯氮气和二氧化碳混合气(V(N2)∶V(CO2)=4∶1)控制厌氧条件。
1) 固定化SRB还原U(Ⅵ)的单因素实验
初始pH值影响实验:pH值设为2.0~6.0,设置梯度为1.0。
微球投加量影响实验:通过微球投加量控制菌体量(每g微球约含0.071 g SRB,以干菌计),微球投加量设为3~7 g,设置梯度为1 g。
2) 共存污染物对固定化SRB还原U(Ⅵ)的影响实验
Zn2+和Cu2+浓度对U(Ⅵ)还原的影响实验:分别加入25、50、100、120、140、150 mg/L Zn2+或Cu2+,以无外加重金属离子试样液为空白对照。
有机物对U(Ⅵ)还原的影响实验:分别加入10 mmol/L乙酸钠、草酸钠以及柠檬酸钠3种有机物,以无外加有机物作为空白对照。
3) 固定化SRB选择性去除U(Ⅵ)实验
间接选择性去除U(Ⅵ)实验:分别加入50 mg/L Zn2+、50 mg/L Cu2+及10 mmol/L柠檬酸钠。
1.5 分析方法

2 实验结果与讨论
2.1 固定化SRB还原U(Ⅵ)的实验结果
1) 初始pH值对固定化SRB还原U(Ⅵ)的影响
初始pH值对U(Ⅵ)去除率的影响示于图2。由图2可看出,初始pH值为2.0时,96 h内U(Ⅵ)去除率始终低于20%;随着初始pH值的升高,固定化SRB对U(Ⅵ)的还原能力增强,当初始pH值从2.0升至6.0时,实验96 h后U(Ⅵ)去除率从17.65%上升到94.76%。当初始pH值为3.0~6.0时,U(Ⅵ)的生物还原过程主要发生在前24 h内。
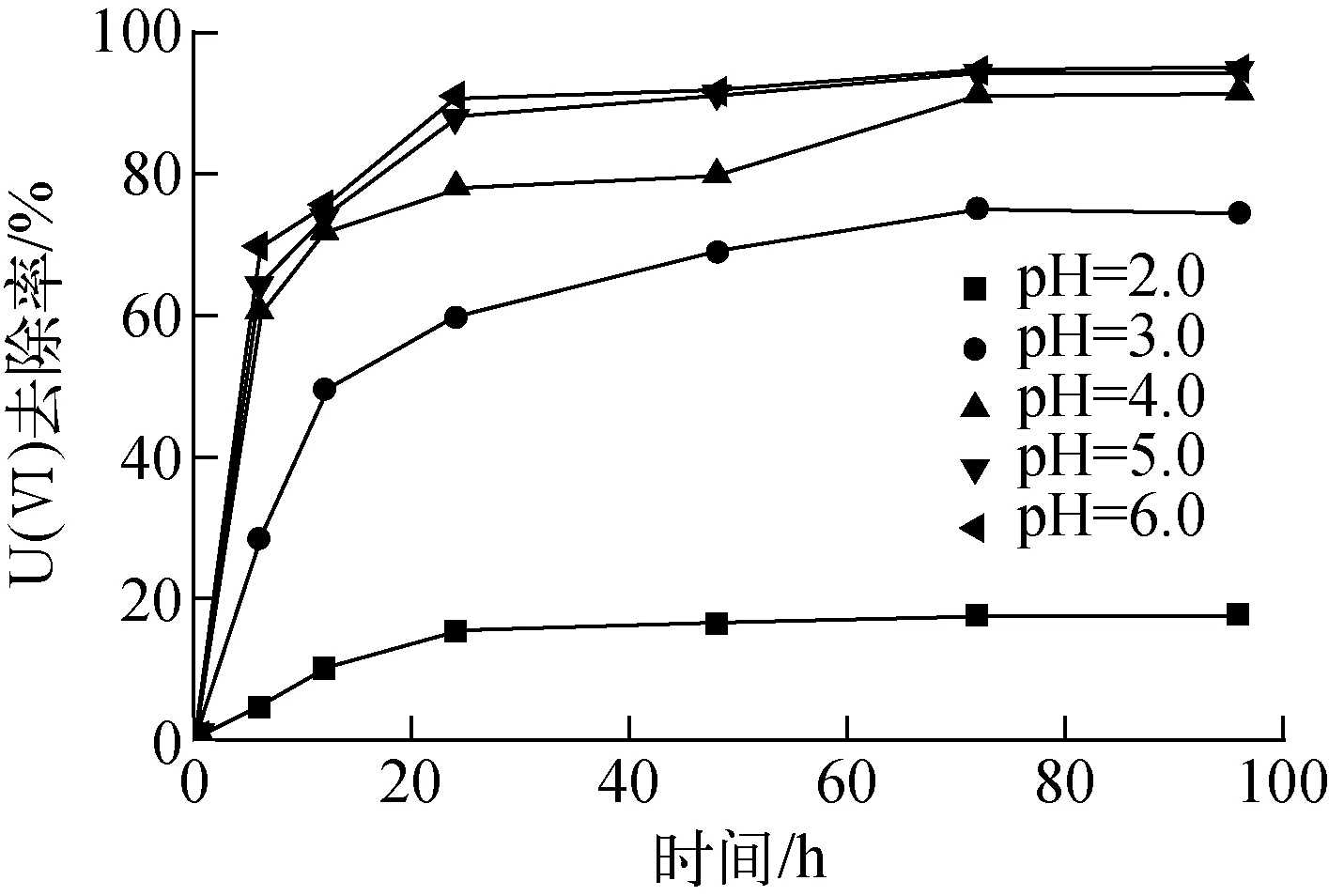
图2 初始pH值对U(Ⅵ)去除的影响
本课题组[1]曾探讨了初始铀浓度20 mg/L、温度35 ℃条件下pH值对游离态SRB还原U(Ⅵ)的影响。结果表明,当pH值为2.0或3.0时,6 d后U(Ⅵ)去除率均低于10%;当pH=6.0时,6 d后血清瓶中U(Ⅵ)几乎全部被还原。可见,在近中性环境中,SRB固定前后还原U(Ⅵ)的能力均较强;SRB经固定化后对低pH值的缓冲作用有所增强。这主要是由于大量SRB菌体被包裹在微球内部,削弱了强酸性环境对其还原酶体系生物学活性的抑制作用,同时降低了H+和U(Ⅵ)对SRB细胞壁上有限负电性活性部位的竞争,从而维持了其对U(Ⅵ)的还原能力[1]。为维持U(Ⅵ)的高效还原,后续实验均选择pH值为6.0。
2) 微球投加量对固定化SRB还原U(Ⅵ)的影响
微球投加量对固定化SRB还原U(Ⅵ)的影响实验结果示于图3,空白微球在24 h内对U(Ⅵ)的去除情况示于图4。分析图3可知,pH值为6.0时,U(Ⅵ)的去除主要在于微生物的活动,且发生在前24 h内。这是由于初始阶段电子供体充足,微生物代谢活动旺盛,U(Ⅵ)还原率增大显著;24 h后随电子供体的消耗,U(Ⅵ)还原率的增大趋于平缓。当微球投加量为6 g/L(相当于菌体投加量0.42 g/L)时,48 h内U(Ⅵ)还原率高达94.57%。超过该值,U(Ⅵ)还原效率随微球投加量的增加变化不大。这说明,对于U(Ⅵ)浓度为15 mg/L的溶液,6 g/L微球投加量已足够。此外,由图4可看出,空白微球对U(Ⅵ)也有一定的吸附作用,这可能与微球的多孔结构有关[18]。
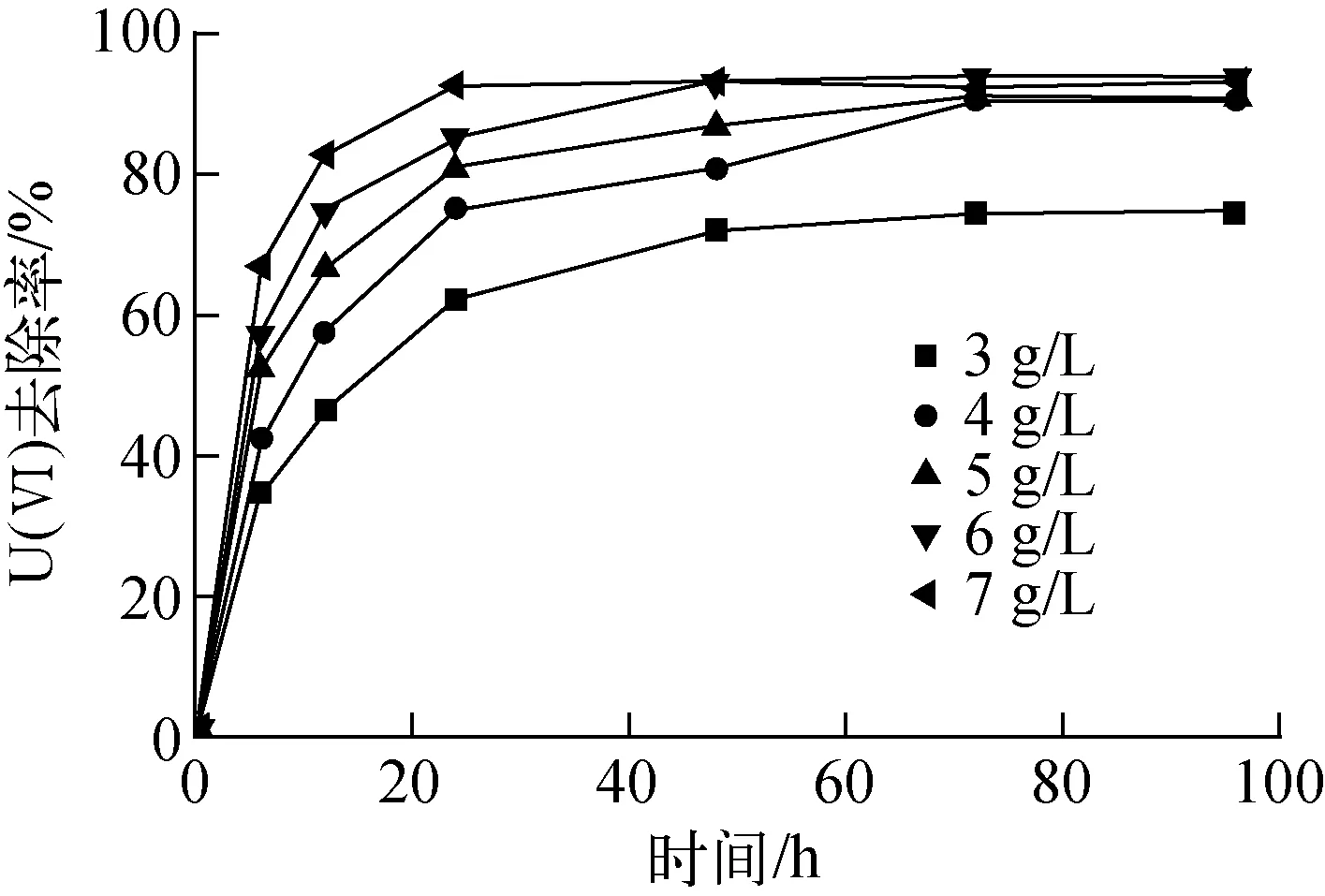
图3 微球投加量对U(Ⅵ)去除的影响

图4 空白微球投加量对U(Ⅵ)去除的影响
2.2 共存污染物对固定化SRB还原U(Ⅵ)的影响
1) 重金属离子对固定化SRB还原U(Ⅵ)的影响
图5、6分别为不同Zn2+和Cu2+浓度下,固定化SRB还原U(Ⅵ)的情况。从图5、6可知,当初始Zn2+或Cu2+浓度在25~120 mg/L范围时,U(Ⅵ)还原动力学曲线与空白对照组差异较小,在96 h后U(Ⅵ)去除率可达94%左右,说明Zn2+或Cu2+浓度在0~120 mg/L范围内对U(Ⅵ)的还原影响很小。当初始Zn2+或Cu2+浓度升高至140 mg/L时,U(Ⅵ)还原受到不同程度的抑制,而当其达到150 mg/L时,U(Ⅵ)浓度在初期稍有下降,随后保持稳定,表明U(Ⅵ)还原受到完全抑制。实验中发现,96 h后开启初始Zn2+或Cu2+浓度分别为25、50、100、120 mg/L和空白组血清瓶,均有较浓的臭鸡蛋味气体产生,且部分微球变黑。而初始Zn2+或Cu2+浓度为150 mg/L时,血清瓶中并未出现这两种现象。由此推断,Zn2+或Cu2+对SRB的毒阀值约为150 mg/L。Azabou等[11]和Jalali等[12]研究发现,Zn2+或Cu2+浓度高于150 mg/L时,对SRB具有致死作用,这与本实验结果基本一致。

图5 Zn2+浓度对U(Ⅵ)去除的影响
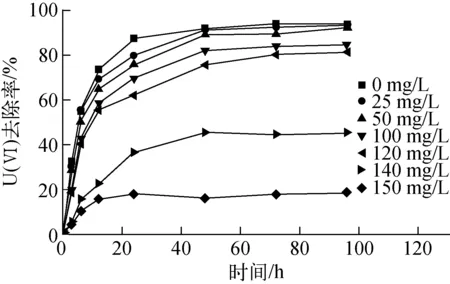
图6 Cu2+浓度对U(Ⅵ)去除的影响
重金属对SRB还原U(Ⅵ)的影响主要表现在其对SRB的毒害作用。Garcia等[14]研究表明,pH=7.0,Cu2+浓度为25、50、100 mg/L时,接种SRB 21 d后,Cu2+去除率高达99%,且产生黑色沉淀;当Cu2+浓度增至200 mg/L时,细菌未见生长。Kieu等[13]在探讨半连续搅拌槽反应器中SRB对重金属离子的去除效果时也得到了类似结论。Utgikar等[15]则报道,Zn2+和Cu2+对SRB的毒阀值分别为12 mg/L和20 mg/L。本课题组[1]早期在研究Zn2+和Cu2+对U(Ⅵ)还原的影响时也发现,Zn2+和Cu2+抑制阀浓度分别为15 mg/L和25 mg/L。究其原因主要在于,重金属对SRB的毒阀值和抑制程度受环境影响(如细胞周围的物化环境、SRB种系组成及生物反应器构建情况等)较大[13]。此外,大量研究[16,18]表明,微生物经包埋固定可有效缓冲重金属离子的冲击作用,这也可能是本实验中Zn2+和Cu2+浓度毒阀值偏高的原因之一。
2) 有机物对固定化SRB还原U(Ⅵ)的影响
实验中,分别以乙酸钠、草酸钠和柠檬酸钠为研究对象,考察其对固定化SRB还原U(Ⅵ)的影响。实验结果示于图7。由图7可看出,草酸钠和柠檬酸钠对U(Ⅵ)的还原存在不同程度的抑制作用,乙酸钠的影响较小。24 h内,与空白对照组相比,乙酸钠使U(Ⅵ)去除率升高约3%,而草酸钠和柠檬酸钠分别使U(Ⅵ)去除率降低约61%、76%。
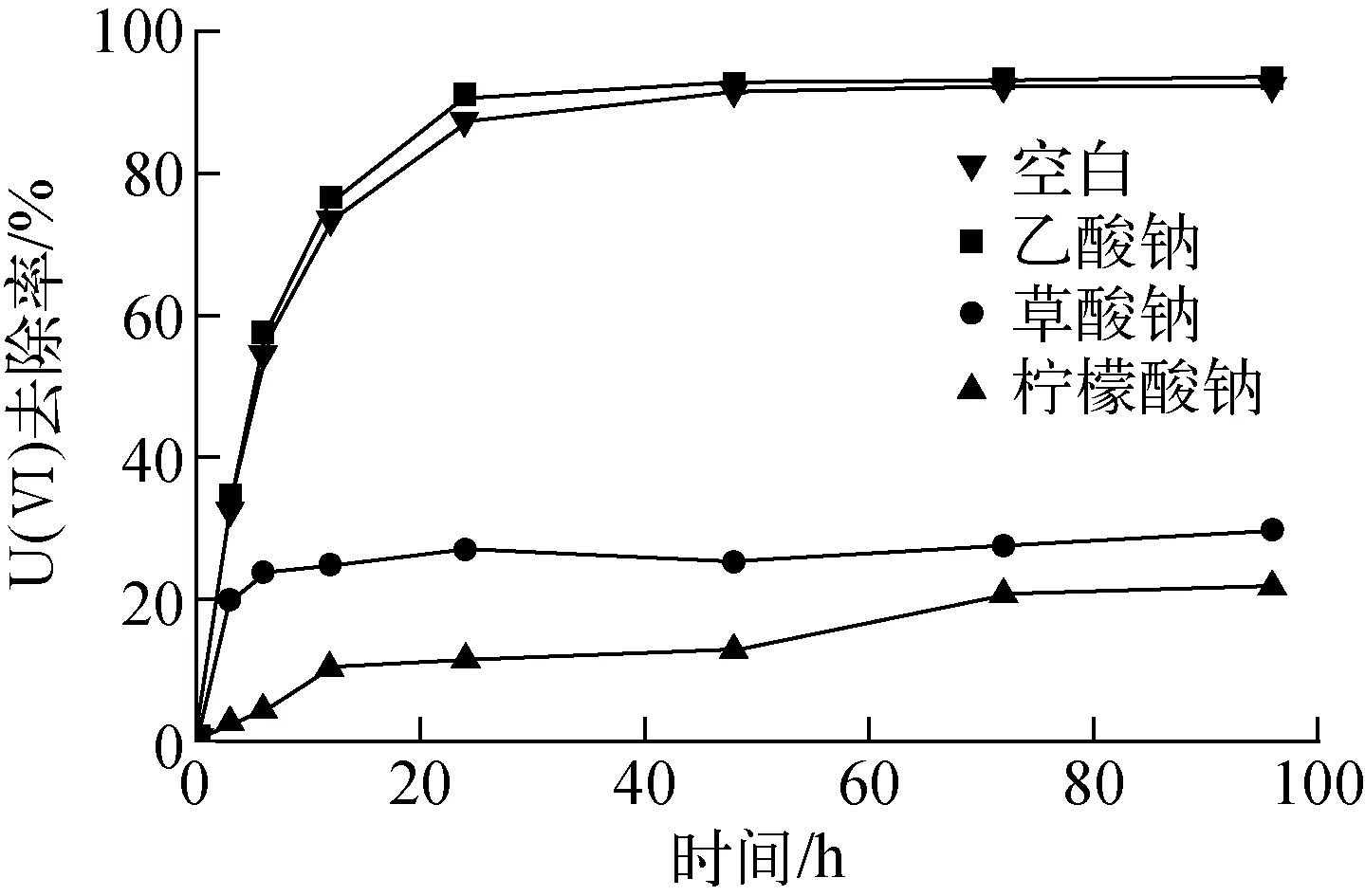
图7 有机物对U(Ⅵ)去除的影响
Ganesh等[19]通过在有机物存在条件下降解硫代硫酸盐的实验证实,有机物对U(Ⅵ)还原过程的影响差异不在于有机物对SRB产生的不同毒性。此外,在考察有机物对脱硫弧菌还原U(Ⅵ)的影响时还发现,乙酸钠、草酸钠和柠檬酸钠等有机物浓度均未显著降低,进而说明U(Ⅵ)还原趋势的差异也不在于SRB对有机物的选择性降解。结合上述分析及表1可知,有机物对固定化SRB还原U(Ⅵ)的影响差异主要在于有机配体的不同络合能力(柠檬酸钠>草酸钠>乙酸钠)。由于多齿配体有机物可与U(Ⅵ)络合,限制了U(Ⅵ)的还原[20]。
2.3 固定化SRB选择性去除U(Ⅵ)实验
SRB除通过酶促作用直接还原U(Ⅵ)外,还可利用代谢产物间接沉淀重金属[13,21],两种机制示于图8。由于这两种机制是互斥的,适当优化处理条件有可能实现铀的选择性沉淀,这对于修复铀污染和回收铀资源具有现实意义。
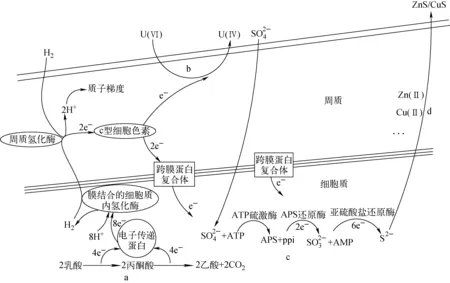
a——乳酸氧化过程;b——SRB通过酶促作用直接去除U(Ⅵ)的过程;c、d——SRB利用代谢产物沉淀去除重金属的过程
1) 固定化SRB直接选择性去除U(Ⅵ)实验

图9 固定化SRB直接选择性去除U(Ⅵ)

表1 有机配体类型及络合特性[19]
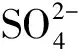
2) 固定化SRB间接选择性去除U(Ⅵ)实验
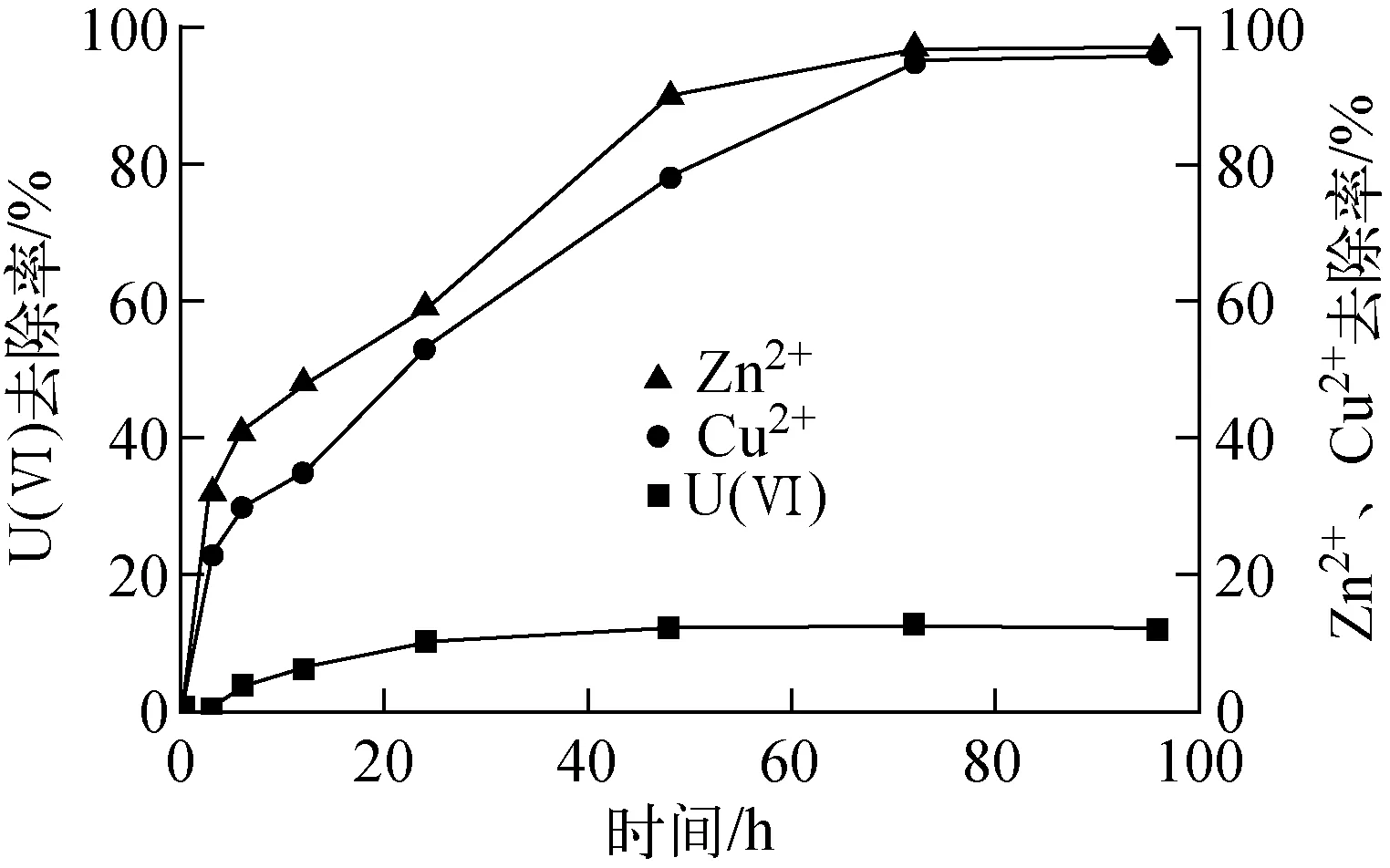
图10 固定化SRB间接选择性去除U(Ⅵ)
在柠檬酸钠存在情况下,Zn2+、Cu2+及U(Ⅵ)的去除实验结果示于图10。从图10可看出,在72 h内,Zn2+和Cu2+的去除率分别达到97.54%、95.48%,而U(Ⅵ)的去除率仅为12.07%。可见,通过引入柠檬酸钠,有利于重金属离子(Zn2+和Cu2+)的选择性沉淀。究其原因,U(Ⅵ)可与有机物形成可溶性络合物,而金属硫化物不具备这一性质[19]。结合前述分析可知,适当添加有机物有利于选择性沉淀重金属。当多齿配体有机官能团通过生物或光降解后[25],可利用直接法进一步还原/沉淀去除U(Ⅵ)。
3 结论
1) 在U(Ⅵ)还原过程中,硫酸盐还原菌经聚乙烯醇和海藻酸钠固定后对pH值的缓冲能力显著增强。当pH值为3.0~6.0时,固定硫酸盐还原菌可高效、稳定地还原/沉淀U(Ⅵ)。在U(Ⅵ)浓度为15 mg/L、微球投加量为6.0 g/L及温度为35 ℃的条件下,反应96 h后U(Ⅵ)去除率达到94.67%。
2) 当Zn2+或Cu2+浓度低于100 mg/L时,U(Ⅵ)还原未受显著影响;而当Zn2+或Cu2+浓度增至150 mg/L时,U(Ⅵ)还原被完全抑制。
3) 乙酸钠、草酸钠和柠檬酸钠3种有机物对固定化硫酸盐还原菌还原U(Ⅵ)的影响存在较大差异。当乙酸钠等单齿配体有机物存在时,U(Ⅵ)可被完全还原,而多齿配体有机物(草酸钠和柠檬酸钠)存在时,会延缓甚至抑制U(Ⅵ)的还原。
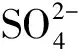
参考文献:
[1] 谢水波. 铀尾矿(库)铀污染控制的生物与化学综合截留技术[D]. 北京:清华大学环境学院,2007.
[2] 杨仕教. 原地破碎浸铀理论与实践[M]. 长沙:中南大学出版社,2003:283-284.
[3] WANG J L, CHEN C. Biosorption of heavy metal bySaccharomycescervisiae: A review[J]. Biotechnology Advances, 2006, 24(5): 427-451.
[4] HU K G, WANG Q L, TAO G Q, et al. Experimental study on restoration of polluted groundwater from in situ leaching uranium mining with sulfate reducing bacteria and ZVI-SRB[J]. Procedia Earth and Planetary Science, 2011, 2: 150-155.
[5] 吴唯民,CARLEY J,WATSON D,等. 地下水铀污染的原位微生物还原与固定:在美国能源部田纳西橡树岭放射物污染现场的试验[J]. 环境科学学报,2011,31(3):449-459.
WU Weimin, CARLEY J, WATSON D, et al. Bioreduction and immobilization of uranium in situ: A case study at a USA Department of Energy radioactive waste site, Oak Ridge, Tennessee[J]. Acta Scientiae Circumstantiae, 2011, 31(3): 449-459(in Chinese).
[6] WALL J D, KRUMHOLZ L R. Uranium reduction[J]. Annual Review of Microbiology, 2006, 60(1): 149-166.
[7] BEYENAL H, RAJESH K S, BRENT M P, et al. Uranium immobilization by sulfate-reducing biofilms[J]. Environmental Science and Technology, 2004, 38(7): 2 067-2 074.
[8] YOHHEY S, SHELLY D K, KENNTH M K, et al. Direct microbial reduction and subsequent preservation of uranium in natural near-surface sediment[J]. Applied and Environmental Microbiology, 2005, 71(4): 1 790-1 797.
[9] 谢水波,王水云,张浩江,等. 硫酸盐还原菌还原U(Ⅵ)的影响因素与机理[J]. 环境科学,2009,30(7):1 962-1 967.
XIE Shuibo, WANG Shuiyun, ZHANG Haojiang, et al. Efficiency and mechanism on reduction of U(Ⅵ) by sulfate reducing bacteria[J]. Environmental Science, 2009, 30(7): 1 962-1 967(in Chinese).
[10] YI Z J, TAN K X, TAN A L, et al. Influence of environmental factors on reductive bioprecipitation of uranium by sulfate reducing bacteria[J]. International Biodeterioration & Biodegradation, 2007, 60(4): 258-266.
[11] AZABOU S, MECHICHI T, SAYADI S. Zinc precipitation by heavy-metal tolerant sulfate-reducing bacteria enriched on phosogypsum as a sulfate source[J]. Minerals Engineering, 2007, 20(2): 173-178.
[12] JALALI K, BALDWIN S G. The role of sulphate reducing bacteria in copper removal from aqueous sulphate solutions[J]. Water Research, 2000, 34(3): 797-806.
[13] KIEU H T, MULLER E, HORN H. Heavy metal removal in anaerobic semi-continuous stirred tank reactors by a consortium of sulfate-reducing bacteria[J]. Water Research, 2011, 45(13): 3 863-3 870.
[14] GARCIA C, MORENO D A, BALLESTER A, et al. Bioremediation of an industrial acid mine water by metal-tolerant sulphate-reducing bacteria[J]. Minerals Engineering, 2001, 14(9): 997-1 008.
[15] UTGIKAR V P, CHAUDHARY N, KOENIGER A, et al. Toxicity of metals and metal mixtures analysis of concentration and time dependence for zinc and copper[J]. Water Research, 2004, 38(17): 3 651-3 658.
[16] TAKEI T, IKEDA K, IJIMA H, et al. Fabrication of poly(vinyl alcohol) hydrogel beads crosslinked using sodium sulfate for microorganism immobilization[J]. Process Biochemistry, 2011, 46(2): 566-571.
[17] YI Z J. Microbial removal of uranyl by sulfate reducing bacteria in the presence of Fe(Ⅲ) (hydr) oxides[J]. Journal of Environmental Radioactivity, 2010, 101(9): 700-705.
[18] WANG J S, HU X J, LIU Y G. Biosorption of uranium(Ⅵ) by immobilizedAspergillusfumigatusbeads[J]. Journal of Environmental Radioactivity, 2010, 101(6): 504-508.
[19] GANESH R, ROBINSON K G, REED G D, et al. Reduction of hexavalent uranium from organic complexes by iron and sulfate reducing bacteria[J]. Applied and Environmental Microbiology, 1997, 63(11): 4 385-4 391.
[20] SUZUKI Y, KAZUYA T, KOZAI N, et al. Effects of citrate, NTA, and EDTA on the reduction of U(Ⅵ) byShewanellaputrefaciens[J]. Geomicrobiology Journal, 2010, 27(3): 245-250.
[21] BOOCHAYAANANT B, GU B H, WANG W, et al. Can microbially-generated hydrogen sulfide account for the rates of U(Ⅵ) reduction by a sulfate-reducing bacterium?[J]. Biodegradation, 2010, 21(1): 81-95.
[22] 任南琪,王爱杰,赵阳国. 废水厌氧处理硫酸盐还原菌生态学[M]. 北京:科学出版社,2009:38-39.
[23] MATIAS P M, PEREIRA I A C, SOARES C M, et al. Sulphate respiration from hydrogen in desulfovibrio bacteria: A structural biology overview[J]. Progress in Biophysics and Molecular Biology, 2005, 89(3): 292-329.
[24] HEIDELBERG J F, SESHADRI R, HAVEMAN S A, et al. The genome sequence of the anaerobic, sulfate-reducing bacterium desulfovibrio vulgaris[J]. Hildenborough Nat Biotechol, 2004, 22(5): 554-559.
[25] BAILEYA E H, MOSSELMANS J F W, SCHOFIELD P F. Uranyl-citrate speciation in acidic aqueous solutions-an XAS study between 25 and 200 ℃[J]. Chemical Geology, 2005, 216(1-2): 1-16.
