钛种植体表面构筑多级微/纳米活性结构的研究
2014-08-07王世强陈艳文王周成
王世强,陈艳文,王周成
(厦门大学化学化工学院,福建 厦门 361005)
钛及其合金作为一种具有良好耐腐蚀性和生物相容性的生物材料[1-3],其弹性模量接近于成骨[4],不易产生应力屏蔽[5],被广泛应用于种植体[3,5].而如何实现材料植入后,短时间内即与周围骨组织实现机械锁合和化学键合,从而实现形成骨融合[6],同时保证材料与组织的长期稳定,对生物材料的应用有着重要的意义.许多学者认为,一定粗糙度的微米级形貌表面有利于比表面积的增加、成骨细胞的分化和细胞外基质的形成和矿化[7],同时能为组织和细胞生长提供支架,增大成骨细胞与材料的附着力[8-9];而纳米级形貌有利于某些蛋白的合成和吸附,从而促进成骨细胞的黏附[10-11].为了在钛表面构筑多级形貌结构,从而利于种植体的短期负载和长期稳定,本实验采用喷砂酸蚀和阳极氧化的方法,在纯钛表面构筑多级微/纳米结构,经过相应的高温热处理,进而在表面获得亲水性好、生物活性佳的活性表面,以此达到增加种植体的作用面积、优化其表面生物活性的目的.
1 实验方法
1.1 钛的表面处理
选用工业级的TA2级纯钛片(10 mm×10 mm×1 mm)进行预处理,经Al2O3砂纸逐级打磨至划痕均匀后,依次浸入丙酮、乙醇和去离子水中室温下超声清洗10 min作除油处理,后置于V(65%HNO3)∶V(40%HF)∶V(去离子水)=3∶1∶2配比的溶液中酸洗2 min.将预处理后样品分为4组.1) 酸洗对照组(control):选用打磨除油酸洗2 min的样品作为对照组;2) 喷砂酸蚀组(sandblasting and acid-etching,SLA):经打磨除油酸洗2 min后,表面采用180目Al2O3(粒径约80 μm)喷砂,压力为0.5 MPa,距离为1 cm,除油处理后置于V(98%H2SO4)∶V(37%HCl)=3∶1混合液中,60 ℃下酸蚀30 min;3) 喷砂酸蚀-阳极氧化组(SLA-anodizing,SLA-A):以喷砂酸蚀处理后的钛样品为阳极,铂片为阴极,在质量分数为0.5%的HF溶液体系中,20 V电压,30 ℃进行阳极氧化3 min;4) 喷砂酸蚀-阳极氧化热处理组(SLA-A-heating,SLA-A-H):喷砂酸蚀阳极氧化后样品置于管式炉中,在400 ℃下保温热处理2 h.
4组样品进行相应处理后,均用大量去离子水冲洗,40 ℃烘箱中干燥至恒质量,备用.
1.2 表面表征及成分分析
采用德国LEO公司生产的LEO-1530场发射扫描电子显微镜(SEM,加速电压20 kV)及其带有的Oxford能量散射光谱仪(EDS)观察样品表面的形貌及化学元素组成;采用Rigaku公司生产UltimaⅣ射线衍射仪(XRD,Cu-Kα靶,管电压30 kV,管电流15 mA)分析表面的物相组成;采用KRUSS公司生产的DSA30接触角测量仪测试表面的静态接触角.
1.3 体外细胞培养实验
将打磨除油酸洗钛片(control)设为对照组,SLA、SLA-A、SLA-A-H钛片设为表面处理组.37 ℃、5%(体积分数)CO2下培养MG-63(人成骨肉瘤)细胞生长铺展到80%~90%,使用预冷磷酸盐缓冲液(PBS溶液)洗涤2次,加入2.5 mg/mL胰酶消化后,培养液终止反应并制备细胞悬液,调整细胞浓度到1×105mL-1时,接种至对照组和表面处理组的钛片表面.置于37 ℃、5%CO2饱湿适度培养箱中培养.观察细胞培养第3天,使用PBS溶液清洗去除未黏附细胞,2.5%(体积分数)戊二醛固定2 h,预冷PBS溶液清洗后分别以体积分数为30%,50%,70%,90%,100%的乙醇依次梯度脱水每次10 min,最后过渡到100%叔丁醇中,4 ℃过夜结晶,冷冻干燥后用离子溅射镀膜技术表面喷金,通过SEM观察细胞在材料表面生长、黏附状况.
2 结果与讨论
2.1 表面形貌
图1为纯钛表面经不同方式处理后的表面SEM图.图1(a)为钛基体经打磨酸洗预处理后的表面形貌,酸洗去除钛表面氧化膜,形成略带棱角的相对平整表面,高放大倍数下(图1(b))可以观察到相对光滑、洁净的表面.酸洗表面经喷砂酸蚀处理后(图1(c)和(d))形成了丰富的表面形貌,图中颜色较暗的部分为凹陷区,存在砂粒撞击形成的10~20 μm不均匀的凹陷,凹陷中存在酸蚀形成的5~8 μm的微米级孔洞结构,高放大倍数下可见表面相对洁净,无明显的锐利边缘,从而在一定程度上形成了多级微米的SLA表面.随后,对SLA表面进行阳极氧化,由图1(e)和(f)可见,喷砂酸蚀形成的多级微米级形貌基本上无明显变化,仍为明显的不均匀凹陷和酸蚀孔洞,高放大倍数下可见在喷砂酸蚀后的表面生成了一层连续且规则排列的纳米级结构,其纳米管直径约为10 nm,说明通过喷砂酸蚀加阳极氧化的处理方法构造了多级微/纳米表面形貌.对形成的多级微/纳米结构作相应的热处理后(如图1(g)和(h)所示),其表面多级形貌基本上无明显变化,依然保持了多级微/纳米的复合结构形貌.
2.2 表面结构和成分
对不同处理后的样品成分进行能谱分析,如图2所示.能谱显示酸洗后表面为纯钛(图2(a));经Al2O3喷砂后,表面有大量的Al2O3砂粒夹杂,而之后的酸蚀处理表面将夹杂的Al2O3等大量溶解,纯钛基体裸露出来,显示为单一的纯钛成分(图2(b));在此表面上进行相应的阳极氧化,能谱结果表明表面为Ti(质量分数72.95%,下同)、O(27.05%)元素(图2(c)),说明纯钛基体作为阳极在氧化过程中,形成了钛的氧化物;阳极氧化后样品热处理2 h后,氧化膜颜色由浅灰色变为浅紫色,能谱结果显示含有Ti(65.75%)、O(34.25%)(图2(d)),说明在热处理过程中,钛与空气中的氧气发生氧化作用,使得氧化膜的厚度增加,氧质量分数进一步提高.
如图3所示,采用XRD对表面晶型进行表征,酸洗和喷砂酸蚀后的纯钛表面,基本为纯钛的衍射峰;阳极氧化后,相比于纯钛表面,衍射峰亦无明显变化,结合能谱中氧质量分数的提高,说明阳极氧化过程中生成了无定形的氧化钛;而对无定形的氧化钛经400 ℃热处理后,XRD谱在25°左右出现锐钛矿相(101) 的特征衍射峰,说明表面氧化钛由无定形转变为锐钛矿型二氧化钛,SLA-A-H表面二氧化钛结晶度较SLA-A得到了明显提高.
2.3 亲水性能
图4为不同处理后干燥0.5 h所测得的接触角.酸洗后纯钛表面为亲水性,表面接触角为(62.9±0.8)°(图4(a));喷砂后酸蚀溶解了表面夹杂的Al2O3,在表面成分不发生改变情况下,样品表面粗糙度增加,导致接触角略微增加到(69.9±1.3)°(图4(b));阳极氧化处理后,接触角进一步减少,基本上能铺展表面,为超亲水表面(图4(c));热处理后,较未热处理的SLA-A接触角基本无明显变化(图4(d)).这说明通过在基体上进行多级微/纳米形貌的构造,基体表面的亲水性能得到大幅度提高.
SLA后的阳极氧化是场致氧化,即在电场作用下发生反应:
2H2O →2O2-+4H+,
Ti →Ti2++2e,
Ti2++2O2-→TiO2+2e.

(a),(b) control;(c),(d) SLA;(e),(f) SLA-A;(g),(h) SLA-A-H.图1 不同处理后的钛样品表面SEM图Fig.1 SEM photographs of Ti samples prepared by different treatments

图2 不同处理后钛表面EDS谱图Fig.2 EDS patterns of Ti samples prepared by different treatments

图3 不同处理后钛表面XRD谱图Fig.3 XRD patterns of Ti samples prepared by different treatments
这是SLA-A能表现出超亲水性能的主要原因.反应初期在金属表面形成一层初始氧化层,此后O2-向金属/氧化物界面迁移,继续与金属反应生成TiO2,Ti4+向氧化物/电解液界面迁移产生氧空位,游离的水分子被吸附到缺陷位,形成羟基组,羟基组进一步吸附水分子,形成物理吸附层,从而产生亲水表面.亲水性种植体在生物体内表面不易形成血栓、血块,新鲜循环的血液有利于植入体表面的矿化从而促进与骨质的结合,也在一定程度增加种植体植入后的成功概率.
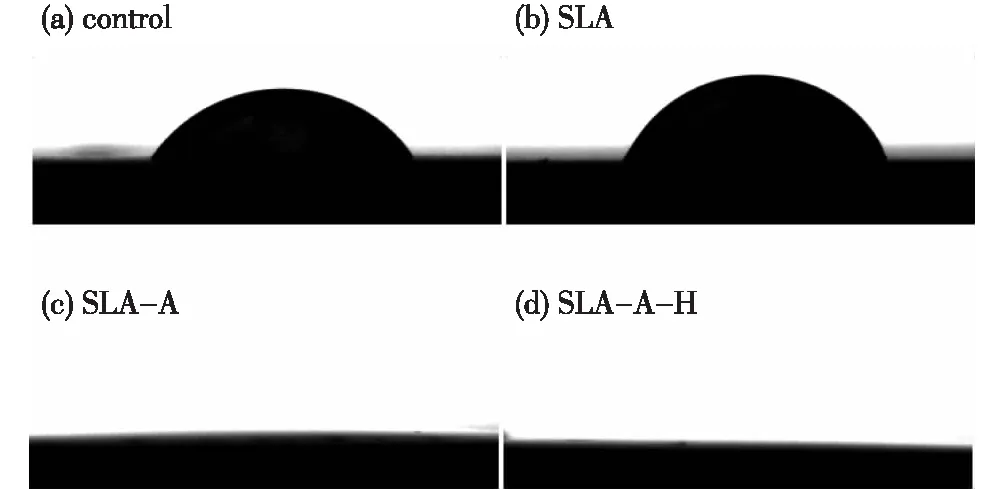
图4 水滴在不同处理后钛样品表面的光学图Fig.4 Optical images of water droplets on different treated Ti samples
2.4 生物活性
图5为成骨细胞培养3 d后在不同处理样品表面生长情况的SEM图.图5(a)和(b)为对照组,细胞呈多边形,周围存在大量伪足,但微绒毛很少.经喷砂酸蚀处理后,如图5(c)和(d),明显可见喷砂酸蚀形成微米孔洞上附着大量的成骨细胞,细胞呈多边形或梭形交错相连,少数细胞能充填在大的微米孔内,细胞周围存在大量的伪足吸附在表面或孔洞中,同时微绒毛相比对照组表面有较大程度的增加.SLA表面经过阳极氧化处理后,如图5(e)和(f)所示,同SLA表面的细胞形态基本相同,有大量的伪足存在,但相比之下,其伪足和微绒毛有进一步增加,说明相比之下其细胞黏附能力增强.对此表面进行相应热处理后,如图5(g)和(h)所示,其表面微/纳米形貌基本未发生改变,同时表面细胞的形态及伪足攀爬状态和微绒毛的形成也未发生明显的改变.
以上实验说明,样品表面的形貌及成分对成骨细胞的贴壁情况及黏附生长状况均有较大的影响,一定程度上反映了不同处理表面的生物活性.相比于平整的钛表面,多级微米形貌生长的成骨细胞能部分生长在微米孔内或孔上,其伪足及微绒毛也能大量吸附在表面的微米结构上,说明多级微米形貌在一定程度上有利于细胞的黏附和生长.随后通过引入纳米形貌,其微绒毛有更大程度的增加,说明构筑的多级微/纳米复合结构相对于对照组具有更好的生物活性.
3 结 论
1) 采用180目Al2O3颗粒对纯钛基体进行喷砂和相应酸蚀处理,获得了10~20 μm不均匀的凹陷和5~8 μm微米级孔洞的表面形貌,构成了初步的表面两级微米结构,随后在0.5%HF溶液中进行阳极氧化,在保留已有的两级微米级形貌的同时,获得直径约为10 nm的无定形氧化钛纳米结构,经400 ℃热处理2 h后,无定形氧化钛转变为锐钛矿型,在钛基体表面构筑出多级微/纳米活性表面结构,其亲水性能由一般亲水转变为超亲水,从而达到增加种植体的作用面积、改善表面亲水性的目的.
2) 细胞黏附实验表明,细胞在样品表面的黏附和亲和力的优劣程度依次为SLA-A-H>SLA-A>SLA>control,说明表面形貌、粗糙度、结晶度、亲水性能均影响细胞的黏附和亲和力,而构筑的含锐钛矿的多级微/纳米复合结构使得样品比表面积有了较大程度的增加,增加了细胞与表面的接触面积,从而更加有利于成骨细胞在其表面的生长,也利于后期植入材料与骨组织的骨性结合.

(a),(b)control;(c),(d)SLA;(e),(f)SLA-A;(g),(h)SLA-A-H.图5 不同处理后的钛样品表面MG-63细胞培养3 d后的SEM图Fig.5 SEM images of MG-63 cells on different treated Ti samples for 3 d
[1] Long M,Rack H.Titanium alloys in total joint replacement:a materials science perspective [J].Biomaterials,1998,19:1621-1639.
[2] McCracken M.Dental implant materials:commercially pure titanium and titanium alloys [J].Journal of Prosthodontics,1999,8:40-43.
[3] Williams D F.Titanium as a metal for implantation.Part 1:physical properties[J].Journal of Medical Engineering & Technology,1977,1(4):195-198,202.
[4] Niinomi M.Mechanical properties of biomedical titanium alloys[J].Materials Science and Engineering:A,1998,243(1):231-236.
[5] Wang K.The use of titanium for medical applications in the USA[J].Materials Science and Engineering:A,1996,213(1):134-137.
[6] Albrektsson T,Brånemark P I,Hansson H A,et al.Osseointegrated titanium implants:requirements for ensuring a long-lasting,direct bone-to-implant anchorage in man[J].Acta Orthopaedica,1981,52(2):155-170.
[7] Abron A,Hopfensperger M,Thompson J,et al.Evaluation of a predictive model for implant surface topography effects on early osseointegration in the rat tibia model[J].The Journal of Prosthetic Dentistry,2001,85(1):40-46.
[8] Fu Q,Hong Y,Liu X,et al.A hierarchically graded bioactive scaffold bonded to titanium substrates for attachment to bone[J].Biomaterials,2011,32(30):7333-7346.
[9] Schwartz Z,Nasazky E,Boyan B D.Surface microtopography regulates osteointegration:the role of implant surface microtopography in osteointegration[J].The Alpha Omegan,2005,98(2):9.
[10] Puckett S,Pareta R,Webster T J.Nano rough micron patterned titanium for directing osteoblast morphology and adhesion[J].International Journal of Nanomedicine,2008,3(2):229.
[11] Yao C,Slamovich E B,Webster T J.Enhanced osteoblast functions on anodized titanium with nanotube-like structures[J].Journal of Biomedical Materials Research Part A,2008,85(1):157-166.
