应用HPLC-MS技术测定健康受试者和肝癌患者血浆中13种胆汁酸的含量
2014-08-06兰红涛金柔男张国庆第二军医大学附属东方肝胆外科医院上海200438
吕 磊,赵 亮,兰红涛,金柔男,张国庆 (第二军医大学附属东方肝胆外科医院,上海 200438)
胆汁酸是胆汁的主要脂质成分,在脂肪代谢中起重要作用,按结构可分为游离型胆汁酸和结合型胆汁酸[1]。胆汁酸与肝胆系统疾病以及能引起胆汁酸代谢变化的其他疾病关系密切,不同病程患者的胆汁酸变化趋势和程度均不同。因此,血清胆汁酸水平是衡量肝胆功能正常与否的重要指标[2,3]。临床上对胆汁酸的测定多为血清总胆汁酸,对肝胆系统疾病诊断特异性较低,而全面了解血清胆汁酸质和量的变化无疑对肝胆疾病早期诊断和分度具有重要意义[4,5]。高效液相色谱[6]、气相色谱[7]、毛细管电泳[8]等方法都曾应用于胆汁酸的定量检测,在检测灵敏度、测定速度和样品通量上均无法和质谱法相比拟,未能应用于临床。高效液相色谱-质谱(HPLC-MS)联用技术是近年来迅速发展的定量分析技术,由于具有高选择性、高灵敏度的特点,逐渐成为生物样品检测的首选方法。近几年,对体内胆汁酸含量测定的研究者多采用LC-MS/MS法[9-12],其结果对临床有一定指导意义,未见对健康受试者和肝癌患者血浆胆汁酸含量对比的报道。本研究建立了HPLC-MS同时检测健康人和原发性肝癌患者血浆中13种胆汁酸的方法,拟通过两组对象体内胆汁酸组分的含量对比分析,探索胆汁酸在肝癌患者体内的代谢机制和分布差异,为肝胆疾病的临床诊断提供借鉴。
1 仪器和试药
1.1仪器 安捷伦1100高效液相色谱串联1946D单四级杆质谱(美国安捷伦公司);配有ESI源及Chemstation工作站。XW-80A型涡旋混合器(上海琪特分析仪器有限公司),TGL-16G型高速离心机(上海安亭科学仪器有限公司),METTLER AE240十万分之一电子天平(德国梅特勒公司)。
1.2药品和试剂 13种胆汁酸对照品详见表1,均由诗丹德生物技术有限公司提供(纯度>99%),内标红霉素购自中国药品生物制品检定所(批号:130307-200916)。甲酸、氨水、乙腈均为色谱纯,购自Fisher公司,水为纯化水。
2 方法和结果
2.1分析条件
2.1.1色谱条件 色谱柱:SHISEIDO MG C18(100 mm×3.0 mm,3.0 μm),流动相:A乙腈-B水(含0.1%甲酸和0.5%氨水),梯度洗脱,A相比例随时间的变化:30%~40%(0~4 min),40%~80%(4~8 min),80%(8~12 min);流速: 0.4 ml/min,进样时间12 min,平衡时间5 min, 柱温:25℃,进样量:5 μl。
2.1.2质谱条件 采用ESI源负离子模式,毛细管电压3 000 V,干燥气流速10 L/min,雾化气压力45 psi,干燥气温度350℃。选择离子模式(SIM),分段监测,碎片电压200 V,13种胆汁酸的监测离子均为[M-H]-,内标的监测离子为[M+Cl]-。优化后的质谱参数及其保留时间见表1。
2.2溶液的配制
2.2.113种胆汁酸标准溶液的配制 精密称取13种胆汁酸对照品,置于50 ml容量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得13种对照品储备液。分别取适量单个对照品储备液混合加入50 ml容量瓶中,用甲醇定容,即得混合对照品储备液。按照1比1、2、4、10、20、40、100、200的比例逐级稀释,即得8个浓度混合对照品系列标准溶液,于4℃冰箱保存待用。
2.2.2内标溶液的配制 精密称取红霉素对照品6.5 mg,置于50 ml量瓶中,加乙腈溶解并稀释至刻度,摇匀,即得130 μg/ml的内标储备液。取该储备液0.5 ml置于50 ml量瓶中,加入乙腈稀释至刻度,摇匀,即得1.3 μg/ml红霉素乙腈标准溶液,于4℃冰箱保存待用。
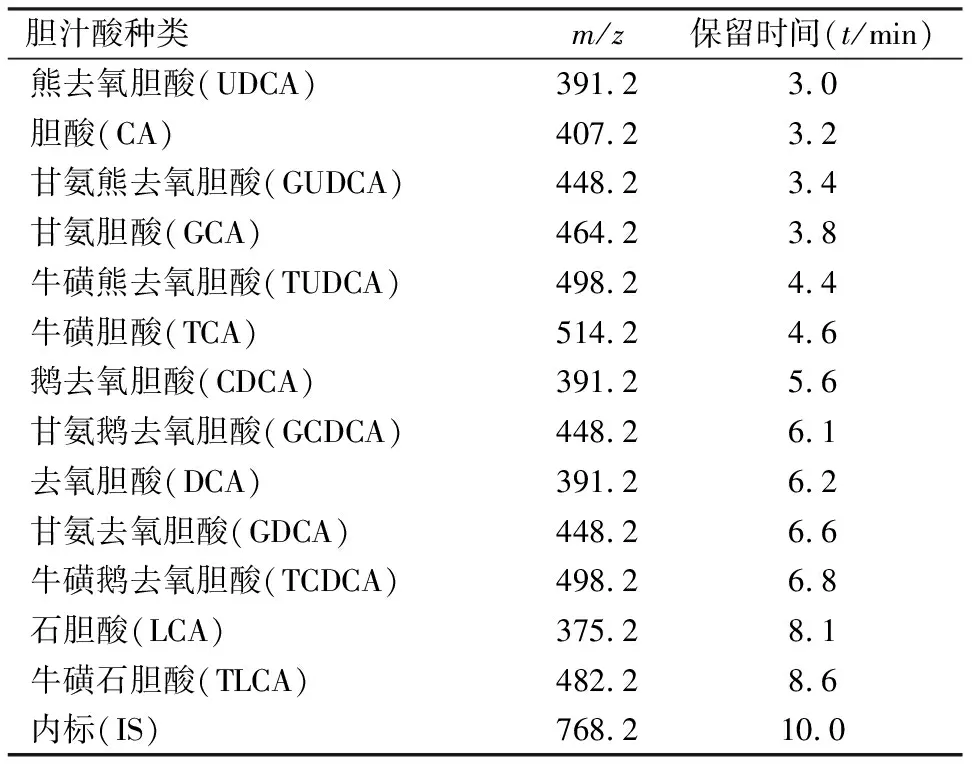
表1 13种胆汁酸的优化质谱参数及保留时间
2.3样本收集 采集第二军医大学附属东方肝胆外科医院2012年1月—6月收治的原发性肝癌患者血液标本50例,门诊健康体检人群血液标本20例。标本采集人群的性别、年龄经χ2检验差异均无统计学意义,具有可比性。50例原发性肝癌患者诊断标准符合《中国肝癌诊疗指南》(2009版),20例健康者均无高血脂、高血压、糖尿病等病史,经体检和实验室检测证实其心、肝、肾和胰功能正常,实验前未服用任何药物,符合全国临床实验标准委员会对健康人群标准。血液标本均采集于入院未经任何治疗时,清晨抽取空腹血4 ml,3 000 r/min离心10 min,分装于-80℃冰箱保存至实验分析。
2.4血浆样品前处理 血浆样品经室温解冻后,精密量取200 μl,置1.5 ml离心管中,加入400 μl红霉素乙腈溶液(1.3 μg/ml),涡旋30 s,12 000 r/min离心3 min;取500 μl上清液,在40℃氮气吹干,残渣用100 μl 30%乙腈溶解,涡旋离心,吸取上清液80 μl于进样瓶中,取5 μl进样分析。
2.5血浆样品分析方法学验证
2.5.1标准曲线及线性范围 胆汁酸属内源性物质,血浆中含有一定量的胆汁酸,故须选择低本底值的血浆样品作为空白对照。取空白血浆 200 μl,精密加入系列胆汁酸混标溶液50 μl,旋涡混匀,配成8个浓度的标准胆汁酸含药血浆,按“2.4” 项下操作,进样分析,记录色谱图,计算各胆汁酸峰面积与内标峰面积的比值。以添加浓度(X)为横坐标,各胆汁酸扣除空白后的峰面积与内标的峰面积比值(Y)为纵坐标,得回归方程、线性范围及相关系数见表2。

表2 13种胆汁酸的回归方程、线性范围及相关系数
2.5.2定量限与检测限 经逐级稀释,分别按S/N>10和S/N>3测得13种胆汁酸的定量下限(LLOQ)分别为9.0、9.9、6.5、7.0、6.6、6.8、9.0、7.8、5.3、5.1、4.5、8.0和5.0 ng/ml;检测限(LLOD)分别为3.0、3.3、2.2、2.3、2.2、2.3、3.0、2.6、1.8、1.7、1.5、2.7和1.7 ng/ml。
2.5.3精密度试验 制备低、中、高浓度的标准含药血浆(相当于标准曲线的第2、5、7个浓度点),每个浓度各5份,按本文“2.4”项下操作,进样分析。并于每天配制低、中、高浓度血浆样本各5份,按本文“2.4”项下操作,进样分析,连续测定3 d,计算日内和日间精密度。结果13种胆汁酸的日内精密度均<5%,日间精密度均<7%,符合方法学要求。
2.5.4加样回收率试验 按上述方法制备血浆样品,进样分析,计算待测物峰面积和内标峰面积的比值,代入标准曲线,得实测浓度,再乘以血浆体积得实测量,计算减去空白量的实测量与理论加入量的比值,得回收率。13种胆汁酸的回收率范围为82.67%~109.75%。
2.5.5稳定性试验 同法制备血浆样品,分别考察在室温放置24 h、4℃放置24 h以及反复冻融下的稳定性。结果RE%的范围为-10.43%~13.16%,精密度均<15%,表明样品稳定性良好。
2.6样品的测定 健康受试者20名,肝癌患者50名。血浆样品按本文“2.4”项下操作,并进行测定,以待测物的峰面积与内标峰面积的比值(以EIC图为准),代入随行标准曲线回归方程,求得血浆样品中待测物的浓度。LC-MS图谱见图1,样品测定结果见表3。

图1 13种胆汁酸浓度图谱
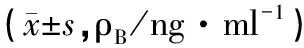
表3 健康受试者和肝癌患者血浆中13种胆汁酸测定结果
3 讨论
3.1提取条件优化 不同胆汁酸其羟基的数目和位置各异,理化性质相差很大,加之血浆中各种胆汁酸的含量不尽相同,用一两种提取溶剂很难将所有组分全部提取出来。液-液萃取和固相萃取法不仅操作烦琐、耗时较长,而且提取效率难以保证。本研究采用蛋白沉淀法,只需少量血浆样本,方法快速、简便、高效。
3.2色谱条件优化 由于各种胆汁酸的理化性质差异较大,并且存在同分异构体,短时间内实现色谱分离比较困难,故本研究选用乙腈-甲酸-氨水缓冲
体系作为流动相,进行梯度洗脱。分别考察了甲酸和氨水的浓度对灵敏度和分辨率的影响,试验结果表明,当甲酸为0.1%,氨水为0.5%,流动相呈弱碱性(pH=8)时,分离效果最佳。
3.3质谱条件优化 胆汁酸在负离子检测模式下响应较好,可以获得稳定的[M-H]-。质谱参数通过流动注射分析(FIA)方法进行优化,考察了干燥气流速6~12 L/min、雾化器压力30~50 psi,发现10 L/min和45 psi的组合雾化效果最好,灵敏度最佳。对于最重要的参数碎片电压,考察了50~250 V,发现200 V的时候本底最低,响应最好。
3.4健康受试者与肝癌患者胆汁酸浓度差异 由表3可知,健康对照组和原发性肝癌患者组的血清中胆汁酸的种类相似,未发现特异性的胆汁酸,LCA和TLCA的浓度极低,基本上检测不到,分析原因可能是因为胆汁酸的肠-肝循环中,胆汁酸在肠道的重吸收主要依靠主动重吸收方式,而LCA及其复合物可溶性差,因而大部分不被吸收而直接排出体外。另外,与健康对照组相比,原发性肝癌患者血浆以结合型胆汁酸升高为主,其中牛磺酸结合型胆汁酸TUDCA和TCDCA的含量超过健康人10倍以上,而TCA的含量升高也在5倍以上;两种甘氨酸结合型胆汁酸包括GCA和GCDCA的含量也超过健康人达5倍以上,而其他6种胆汁酸除DCA外,含量也有一定升高,但与健康人相比差异不显著。
4 小结
本研究所建方法实现了13种胆汁酸成分的同时检测,灵敏度高、选择性好、线性范围宽,适用于临床应用和实验室研究;同时应用该方法首次探讨了原发性肝癌患者与健康人体内血清胆汁酸的成分和含量差异,为肝癌患者体内胆汁酸的代谢和疾病的临床诊治奠定基础。
【参考文献】
[1] 周 毅. 胆汁酸的临床诊断及应用进展[J].放射免疫学杂志, 2012, 25(3): 267-268.
[2] 李淑华, 阮桂芝. 胆汁酸在肝胆疾病诊断中的价值[J].中国医药指南, 2011, 9(13): 253-254.
[3] 段凤梅. 血清胆汁酸测定在肝病诊断中临床应用[J].中国医药指南, 2011, 9(28): 18-19.
[4] 翟庆云. 总胆汁酸及肝功指标检测在肝病诊断中的意义[J].中国社区医师, 2008, 10(9): 64-65.
[5] 王孔明, 林 红.不同肝胆疾病患者血清总胆汁酸测定的临床意义[J].河北医科大学学报, 2011, 32(4): 475-476.
[6] 王文娟, 邓文平, 王 猛, 等. 高效液相色谱法同时测定胆汁中9种结合型胆汁酸[J].重庆医科大学学报, 2009, 34(1): 59-62.
[7] Batta AK, Salen G. Gas chromatography of bile acid[J].J Chromatogr B, 1999, 723(1-2): 1-5.
[8] Rodriguez VG, Lucangioli SE, Fernandez GC,etal.Determination of bile acid in pharmaceutical formulations using micellar electrokinetic chromatography[J].J Pharm Biomed Anal, 2000, 23(2-3): 375-380.
[9] 李水军, 刘罡一, 印其友, 等. 液相色谱-串联质谱法测定血清中15种胆汁酸[J].分析测试学报, 2007, 26(3): 315-322.
[10] Tagliacozzi D, Mozzi AF, Casetya B,etal.Quantitative analysis of bile acid in human plasma by liquid chromatography-electrospray tandem mass spectrometry: a simple and rapid one-step method[J].Clin Chem Lab Med, 2003, 41(12): 1633-1640.
[11] 邓文平, 王文娟, 邵 勇, 等. 高效液相色谱-串联质谱法测定妊娠肝内胆汁淤积患者血清牛磺结合型胆汁酸[J]. 重庆医科大学学报, 2009, 34(6): 732-734.
[12] 丁 敏, 叶 炼, 王 猛, 等. 高效液相色谱-串联质谱法同时测定血清中游离和结合型胆汁酸[J].分析化学, 2007, 35(10):1506-1508.
